土壤铅胁迫对紫金牛生理特性的影响
2019-04-23王佳星余国源黄琛斐廖飞勇
王佳星,余国源,谢 瑛,黄琛斐,廖飞勇
(1.中南林业科技大学 风景园林学院,湖南 长沙 410004; 2.中南林业科技大学 外国语学院,湖南 长沙 410004)
在众多重金属中,铅不是生物代谢所必须的元素,因此,当土壤中的铅积累时,会因其自身具有的难转移、毒性强的特点对植物产生较大的毒害作用[1]。目前,全世界每年排放废料中的铅大部分进入土壤,致使世界各国都出现了土壤铅污染。我国重金属超标的农产品产量与面积约占污染物超标农产品总产量与总面积的80%以上,其中,铅是最主要的污染物之一[2]。受铅胁迫时,植物的生长发育和生理代谢均会受到影响。研究表明,当铅质量分数达到1 500 mg/kg时,茼麻的生长高度及生物量干质量变化趋势相似,均受到显著抑制[3]。在蚕豆的铅胁迫试验中,通过添加离子态的重金属铅,使土壤长期保持在一定的铅浓度范围,随着胁迫时间的延长,其保护酶合成系统遭到破坏,代谢能力逐渐减弱[4]。土壤铅污染不仅对生态系统的正常功能造成破坏,同时也会通过食物链危害人的身体健康,因此,选择耐铅胁迫能力强、观赏效果良好的园林植物进行铅污染土地绿化及土壤修复已成为研究热点。
紫金牛(Ardisiajaponica)为紫金牛科紫金牛属常绿小灌木或亚灌木植物,在我国分布广泛,全株及根部均可作药用[5]。其植株低矮,枝叶常绿,秋冬果色艳丽,挂果持久,观赏价值极佳,且具有良好的耐阴性,于密林之下也能生长,可作为优良的地被植物与室内观赏植物等,用途广泛[6]。但目前对于紫金牛的研究多集中在药用价值的开发[7-8]等方面,对于其重金属抗性方面的研究少见探讨。鉴于此,研究土壤中不同质量分数的铅离子对紫金牛各生理指标的影响,旨在探讨紫金牛对于重金属铅胁迫的适应性和生长表现,进一步探索其抗性机制及耐受能力,为其在重金属铅污染地区进行土地绿化及土壤修复提供理论基础。
1 材料和方法
选取中南林业科技大学校园内3年生紫金牛苗作为试验材料,将其移入直径168 mm、高138 mm的塑料花盆中,每盆1株,每盆干土质量1 kg[V(黄土)∶V(泥炭土)=1∶1]。培育60 d后选择生长一致的25株进行试验,室内碘钨灯人工照光,照光时间为8:00—18:00,自然温度和湿度[9]。
将土壤中铅质量分数[以干土中纯Pb2+计,药品为Pb(CH3COO)2·3H2O]设置5个处理组:对照(0 mg/kg,CK)、处理Ⅰ(500 mg/kg)、处理Ⅱ(800 mg/kg)、处理Ⅲ(1 200 mg/kg)和处理Ⅳ(1 800 mg/kg),每组5株,每次测量重复3次采样(保证植株不因过度采样影响生长)。常规浇水保证土壤湿润,并将花盆底托内渗出液倒回盆中,防止重金属离子流失。每15 d记录植物的生长情况并测定各项指标,60 d后结束试验[10]。
叶绿素荧光参数[PSⅡ最大原初光化学量子效率Fv/Fm、光化学猝灭系数(qP)、电子传递效率(ETR)]、净光合速率使用美国生产的LI-6400 XTR便携式光合仪进行测定[11],叶绿素总量测定采用分光光度法[12],丙二醛(MDA)含量测定采用硫代巴比妥酸法[13],可溶性糖含量测定采用蒽酮法,可溶性蛋白含量测定采用考马斯亮蓝法[14],超氧化物歧化酶(SOD)活性测定采用氮蓝四唑法[15]。
采用SPSS 22.0和Excel软件对数据进行分析和作图。
2 结果与分析
2.1 铅胁迫对紫金牛叶绿素总量的影响
叶绿素含量的高低反映植物的光合作用能力强弱[16]。由表1可知,受铅胁迫15 d后,与对照相比,各铅胁迫处理组叶绿素总量均呈下降趋势,但差异不显著。处理后30 d,各铅胁迫处理组与对照间差异仍不显著,但处理Ⅰ与处理Ⅱ叶绿素总量已大于对照。处理后60 d,处理Ⅰ与处理Ⅱ叶绿素总量继续上升,为对照的1.06倍和1.22倍,而处理Ⅲ和处理Ⅳ叶绿素总量则持续下降,仅为对照的82.83%和77.39%,处理Ⅱ、处理Ⅳ与对照差异显著。
2.2 铅胁迫对紫金牛荧光参数的影响
Fv/Fm为PSⅡ最大原初光化学量子效率[17]。由表2可知,处理后15 d,与对照相比,各铅胁迫处理组Fv/Fm呈下降趋势,且处理Ⅳ与对照差异显著。处理后30 d,处理Ⅱ、处理Ⅳ的Fv/Fm较15 d略升高,但仍低于对照,说明铅胁迫对紫金牛光系统Ⅱ的原初光能转换效率造成影响。至处理后45 d,处理Ⅰ、处理Ⅱ的Fv/Fm大于对照。处理后60 d,各铅胁迫处理组与对照差异显著,处理 Ⅰ 的Fv/Fm升至最高,为对照的1.03倍,处理Ⅳ的Fv/Fm降至最低,为对照的92.16%。
qP为光化学猝灭系数,其值越高,说明植物对于光能的利用效率越高。由表2可知,至处理后30 d,与对照相比,各铅胁迫处理组qP持续下降,处理Ⅳ与对照差异显著。处理后45 d,处理Ⅰ、处理ⅡqP高于对照。处理后60 d,处理ⅡqP升至最高,而处理Ⅲ、处理ⅣqP在胁迫过程中则持续降低,说明低质量分数铅胁迫在一定程度上促进了紫金牛对光能的利用效率,而较高质量分数的铅胁迫则产生抑制作用。
ETR表示电子传递效率。由表2可知,处理后15 d,与对照相比,各铅胁迫处理组ETR降低,处理Ⅳ与对照差异显著。处理后30 d,各铅胁迫处理组ETR上升,处理Ⅰ、处理ⅡETR高于对照。至处理后45 d,处理Ⅰ—Ⅳ ETR达到胁迫周期内最高值,分别为对照的110.40%、107.54%、87.69%、78.18%。处理后60 d,各铅胁迫处理组ETR下降,处理Ⅳ ETR降到最低并与对照差异显著,仅为对照的72.46%。

表1 铅胁迫对紫金牛叶绿素总量的影响Tab.1 Effects of Pb stress on total chlorophyll content of Ardisia japonica mg/g
注:同列不同小写字母表示差异达显著水平(P<0.05),下同。
Note:Different lowercase letters in the same column indicate significant differences(P<0.05),the same below.
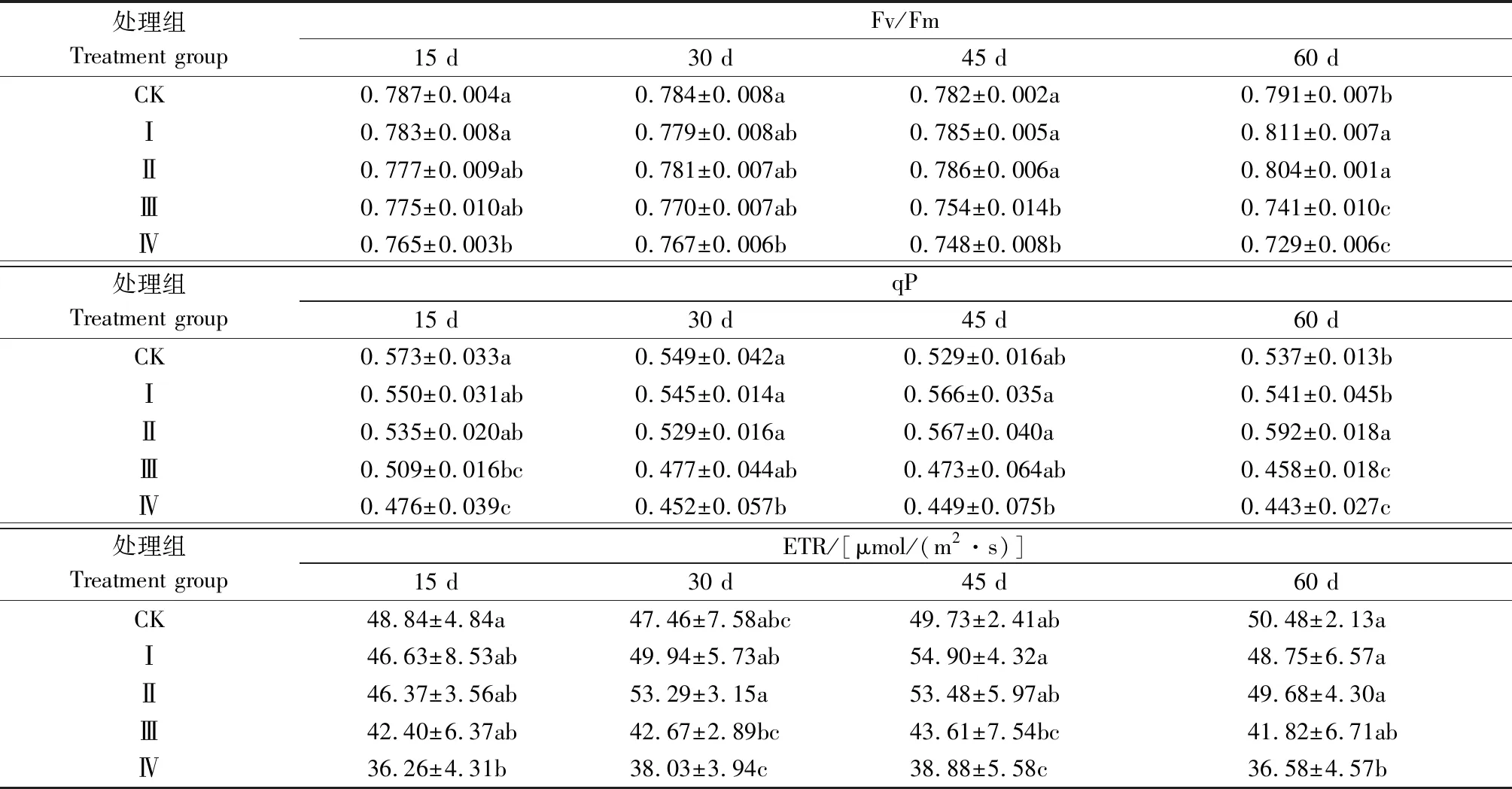
表2 铅胁迫对紫金牛荧光参数的影响Tab.2 Effects of Pb stress on fluorescence parameters of Ardisia japonica
2.3 铅胁迫对紫金牛净光合速率的影响
由表3可知,胁迫开始后15 d,各铅胁迫处理组净光合速率呈下降趋势。至处理后30 d,处理Ⅰ、处理Ⅱ和处理Ⅲ净光合速率有所上升。处理后60 d,处理Ⅰ净光合速率升至最高,为对照组的1.23倍,且与对照差异显著。在60 d的胁迫过程中,处理Ⅰ和处理Ⅱ净光合速率由15 d的低于对照逐渐升高,处理Ⅳ净光合速率则始终保持下降趋势,说明较高质量分数的铅胁迫对紫金牛的光合产生抑制作用。
2.4 铅胁迫对紫金牛可溶性糖含量的影响
可溶性糖是一种重要的渗透调节物质,当植物受到逆境胁迫时,植物体可通过积累可溶性糖来调节体内渗透势[18]。由表4可知,处理后15 d,各铅胁迫处理组可溶性糖含量上升,均达到胁迫周期内各组最高值,说明在短期铅胁迫下,植物加强可溶性糖的积累,以适应外界环境的变化,其中,处理Ⅲ可溶性糖含量较对照提高38.58%,升幅最高。处理后30 d,各铅胁迫处理组可溶性糖含量下降。至处理后60 d,各组可溶性糖含量降至最低,处理Ⅲ、处理Ⅳ与对照差异显著,仅为对照的54.15%、41.96%。表明短时间内铅胁迫可促进可溶性糖的形成,且较高质量分数胁迫的促进作用优于低质量分数,但随着胁迫时间的延长,可溶性糖的合成受到阻碍。

表3 铅胁迫对紫金牛净光合速率的影响Tab.3 Effects of Pb stress on net photosynthetic rate of Ardisia japonica μmol/(m2·s)
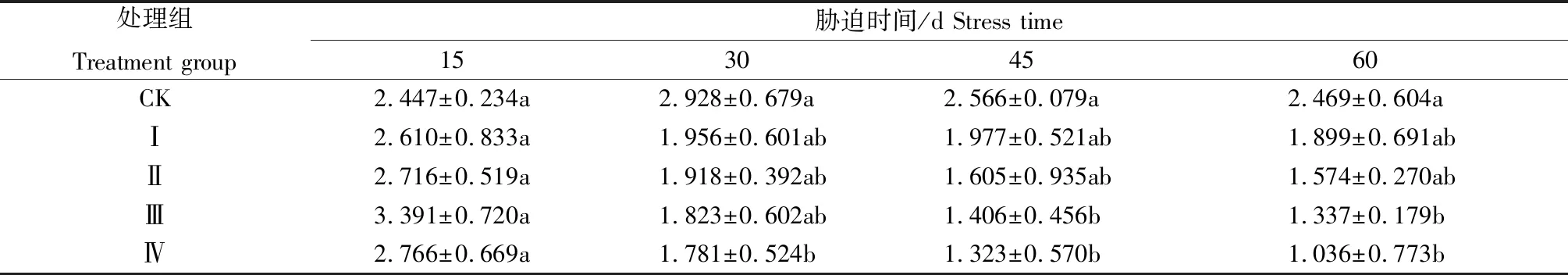
表4 铅胁迫对紫金牛可溶性糖含量的影响Tab.4 Effects of Pb stress on soluble sugar content of Ardisia japonica %
2.5 铅胁迫对紫金牛可溶性蛋白含量的影响
可溶性蛋白含量是衡量植物抗逆性的一个重要指标[19]。表5表明,胁迫开始后各铅胁迫处理组可溶性蛋白含量呈先升高后降低的趋势。处理后15 d,各铅胁迫处理组可溶性蛋白含量均高于对照,处理Ⅲ、处理Ⅳ与对照差异显著。处理后45 d,处理Ⅰ与处理Ⅱ可溶性蛋白含量持续升高,而处理Ⅲ与处理Ⅳ则开始下降。至处理后60 d,各铅胁迫处理组可溶性蛋白含量均下降至低于对照,且铅质量分数越高,下降幅度越大。
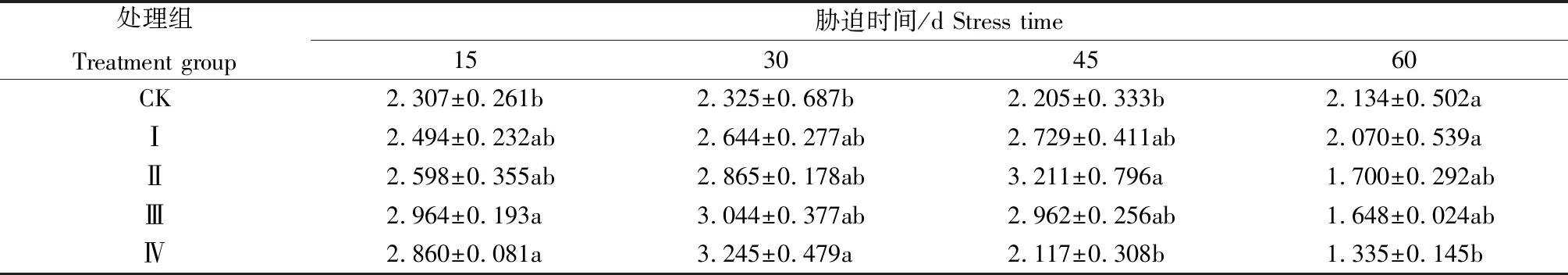
表5 铅胁迫对紫金牛可溶性蛋白含量的影响Tab.5 Effects of Pb stress on soluble protein content of Ardisia japonica mg/g
2.6 铅胁迫对紫金牛MDA含量的影响
MDA的产生会加剧膜的损伤,因此,在植物抗性生理研究中其含量是衡量植物抗逆性的一个常用指标。由表6可知,在整个胁迫周期中,MDA含量的变化整体呈上升趋势。处理后15 d,各处理组MDA含量略有升高,但均与对照差异不显著。处理后45 d,处理Ⅳ与对照差异显著。处理后60 d,Ⅰ、Ⅱ、Ⅲ、Ⅳ各处理组的MDA含量达到最大值,分别为对照的1.16、1.57、1.61、2.00倍。

表6 铅胁迫对紫金牛MDA含量的影响Tab.6 Effects of Pb stress on MDA content of Ardisia japonica μmol/g
2.7 铅胁迫对紫金牛SOD活性的影响
SOD能保护细胞对抗活性氧的伤害[20]。由表7可知,在60 d的胁迫周期中,处理Ⅰ、处理Ⅱ和处理Ⅲ的SOD活性呈先升后降的趋势,处理Ⅳ的SOD活性由15 d的高于对照持续下降至低于对照。处理后15 d,各铅胁迫处理组SOD活性高于对照,但与对照差异不显著。处理后30 d,处理ⅠSOD活性达到最高值,为对照的1.58倍。至处理后60 d,各铅胁迫处理组SOD活性降至胁迫周期内最低值,处理Ⅳ与对照差异显著,说明长期的铅胁迫已对植物细胞造成伤害。

表7 铅胁迫对紫金牛SOD活性的影响Tab.7 Effects of Pb stress on SOD activity of Ardisia japonica U/g
3 结论与讨论
叶绿素含量往往与植物对于光能的捕获能力呈正相关,并可以反映出植物受重金属胁迫的毒害程度。蔡思琪[10]研究表明,双荚决明在吸收重金属铅离子后其植株内叶绿素含量呈先升后降的趋势,低质量分数铅在短期内可以促进双荚决明叶绿素的合成,而在长期胁迫下,叶绿素合成的酶活性受到抑制,叶绿素合成受阻。本试验结果表明,在整个胁迫周期内,低质量分数铅处理下的紫金牛由开始的叶绿素含量低于对照逐渐升高,到处理后60 d高于对照,说明在较长期低质量分数铅处理下,紫金牛的叶绿素合成仍得到促进,其对于铅胁迫的抵抗能力较强。而高质量分数处理组中随着胁迫时间的增长,紫金牛叶片的叶绿素含量持续降低,紫金牛光合作用受到影响,其原因是铅的积累影响了叶绿素合成过程中重要酶的活性,从而间接影响叶绿素的形成,也有可能是胁迫影响了植物对于Mg、N、Fe等元素的吸收,从而降低叶绿素合成。
光系统Ⅱ吸收的光能主要有3个去向:转变为化学能存贮、转变成热散失、以荧光的形式散发出来。植物叶绿素荧光参数的变化可以反映出其对光能的利用情况,从而判断植物是否遭受逆境胁迫。植物在未受胁迫时Fv/Fm值一般在0.75~0.85,其值降低,说明植物受到损伤[21]。由本试验结果可知,短期内铅胁迫下紫金牛PSⅡ反应中心内光能转换效率受到影响,随着胁迫时间的增长,低质量分数处理组的光化学量子效率得到促进,而高质量分数的铅胁迫则使PSⅡ反应中心内光能转换效率持续降低,说明在长期高质量分数铅处理下,光合作用的原初反应受到抑制。ETR可用于度量光化学反应中碳固定的电子传递情况,其数值的变化直接影响植物对于活跃化学能的转换能力[22]。胁迫45 d,低质量分数处理组ETR有所升高,但在60 d试验结束后,各铅胁迫处理组ETR均低于对照,且铅质量分数越高,下降幅度越大,说明胁迫时间超出一定范围之后,紫金牛的表观光合电子传递效率受到影响。qP反映了PSⅡ反应中心的开放程度,qP数值越高,说明植物光能被存储为化学能的比例越高[23]。本试验结果表明,胁迫结束后,低质量分数铅胁迫处理组qP值高于对照,而高质量分数铅胁迫处理组qP值则持续降低,说明高质量分数铅胁迫下紫金牛部分光能以热量的形式散失,用于化学合成的光能减少,植物光合能力受到影响。以上结果表明,随着胁迫的进行,高质量分数铅胁迫处理组紫金牛PSⅡ功能受损,电子传递速率下降,导致光能转换率降低,植物化学能的固定能力下降,这与其净光合速率变化趋势一致。而在低质量分数铅胁迫下,紫金牛光化学量子效率、光化学猝灭系数和净光合速率均得到一定程度的促进。
MDA是膜脂过氧化的重要产物,逆境中其含量升高说明植物细胞正受到膜脂过氧化的伤害[24-28]。本试验结果表明,随着紫金牛胁迫程度的加深,MDA含量不断升高,植物受到迫害的程度不断加重,逆境改变了生物膜的通透性和流动性,造成其功能受损,正常的机体平衡被打破。
植物在逆境环境中,细胞内的渗透势和机体内超氧自由基升高,细胞水势平衡受损,活性氧对植物造成毒害作用。胁迫初期,植物叶片受到刺激使可溶性糖积累来降低细胞渗透势,后期数值下降,说明可溶性糖合成机制受到破坏。叶片可溶性蛋白含量和SOD活性变化趋势相似,说明初期细胞保水能力下降,超氧自由基增加,机体启动防御机制,增强合成可溶性蛋白并使SOD活性增加,增强保水力,降低渗透势,清除超氧自由基的危害,而随着胁迫周期的增长,其可溶性蛋白合成机制可能受到破坏,抗氧化酶活性受到抑制,导致植物生理代谢紊乱,这与前人研究结果一致[29]。
综合以上分析可知,紫金牛对于土壤铅胁迫的抗性较强,从叶绿素总量、净光合速率、Fv/Fm、qP的变化趋势来看,低质量分数的铅胁迫可在60 d内促进紫金牛生长,且就可溶性糖含量、可溶性蛋白含量和SOD活性来说,植株体在低质量分数长时间胁迫下其调节细胞渗透势和清除活性氧的能力下降未达到显著水平。在土壤铅质量分数达到1 800 mg/kg时,其植株黄斑较重,但也不至死亡,说明紫金牛对于高质量分数铅胁迫耐受力显著,具有长期在铅污染地区生长的基础,可为土壤重金属铅污染区绿化花卉苗木的培育提供理论参考。
