小檗碱对NAFLD大鼠肝组织氧化损伤及SIRT1/p53通路的影响*
2019-04-22陈润森唐凯锐邓远军张玉佩杨钦河
陈润森, 唐凯锐▲, 梁 曙, 邓远军, 聂 桓, 张玉佩, 金 玲, 杨钦河△
(暨南大学 1中医学院, 2附属第一医院, 广东 广州 510632)
随着城市化的发展,人们的生活方式发生改变并出现营养过剩等情况,亚洲地区非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)的患病率高达25%,成为常见的慢性肝病,其中继发于NAFLD的肝细胞癌和终末期肝病的发病率也呈现着逐年上升的趋势[1]。NAFLD的发病机制尚未完全明确,现有理论认为其发病与脂肪变性、氧化损伤和肠道菌群紊乱等多种因素有关[2]。研究表明,沉默信息调节因子2同源蛋白1(silent mating type information regulation 2 homolog 1, SIRT1)/p53信号通路的激活与NAFLD脂肪变性和氧化损伤发病机制密切相关[3-4]。近年来,小檗碱的抗氧化和降脂作用已经被多次报道[5-6]。而且我们前期研究表明,小檗碱对高脂饲料喂养的NALFD大鼠疗效明显,其通过激活上游腺苷酸活化蛋白激酶来上调SIRT1蛋白的表达,从而改善脂质代谢紊乱,但其对下游SIRT1/p53信号通路相关蛋白的影响尚有待阐明[7-8]。因此,本研究通过观察小檗碱对高脂饮食诱导的NAFLD大鼠模型的干预作用,并探讨其对SIRT1/p53信号通路相关蛋白的影响,以期进一步阐明小檗碱对NAFLD的作用机制,为小檗碱在临床上防治NAFLD提供参考资料。
材 料 和 方 法
1 实验动物
24只SPF级SD雄性大鼠,体重200 g±20 g,购自广州中医药大学实验动物中心,动物许可证号:SCXK(粤)2013-0034。
2 主要试剂、器材与仪器
实验用药盐酸小檗碱片产自赤峰蒙欣药业有限公司(国药准字H15020568),购自暨南大学第一附属医院药房;丙二醛(malondialdehyde,MDA)含量测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)测试盒、总抗氧化能力(total anti-oxidant capatity, T-AOC)检测试剂盒、油红O试剂盒及总胆固醇(total cholesterol,TC)和甘油三酯(triglyceride, TG)含量测定试剂盒均购自南京建成生物工程研究所;OCT冰冻包埋剂购自SAKURA;RIPA裂解液和Bradford蛋白浓度测定试剂盒购自碧云天生物技术公司;抗SIRT1和GAPDH抗体购自Cell Signaling Technology;抗p53和乙酰化p53(acetylated p53,Ac-p53)抗体购自Abcam;ECL发光液购自Millipore。冷冻切片机和电动多功能显微镜(Leica);透射电子显微镜(TECNAI-10)(Philips);高通量组织研磨机(TissueLyser Ⅱ型)(QIAGEN);多功能酶标仪(赛默飞世尔仪器有限公司)。
3 方法
3.1动物分组及模型建立 大鼠饲养于24 ℃±2 ℃,明暗12 h交替的SPF级动物房[暨南大学实验动物管理中心,许可证号:SYXK(粤)2013-0117]。造模方法采用高脂饮食诱导NAFLD大鼠模型[8],其中高脂饲料含基础饲料88%、猪油10%、胆固醇1.5%和胆盐0.5%,购自广东省医学实验动物中心,许可证号:SCXK(粤)2013-0002。大鼠经适应性饲养1周后,按照随机数字表均分为3组:正常(normal)组、模型(model)组与小檗碱(berberine)组。正常组给予基础饲料喂养,模型组及小檗碱组给予高脂饲料喂养;小檗碱组在造模的同时给予盐酸小檗碱(100 mg·kg-1·d-1[9])灌服,其余2组给予等体积的蒸馏水灌服。各组动物均自由饮水进食,持续16周。
3.2标本采集 连续用药16周后,各组动物禁食不禁水12 h后,用戊巴比妥钠(40 mg/kg)腹腔注射进行麻醉,开腹并取腹主动脉血,然后取出肝脏,取数块右叶肝组织用于病理学观察,剩余肝组织于-80 ℃超低温冰箱保存待测。
3.3肝组织病理学观察 取各组新鲜右叶肝组织的相同部位,OCT包埋后行冰冻切片,箱体温度-15 ℃,冻头温度-20 ℃,切片厚度8 μm,展片后进行油红O染色,染色后镜检采集图像;另取新鲜右叶肝脏组织块于4%多聚甲醛中固定12 h后,进行常规脱水、石蜡包埋,使用石蜡切片机切片,厚度为5 μm,行常规HE染色后镜检并采集图像;取各组新鲜右叶肝组织1 mm×1 mm×1 mm体积,于2.5%戊二醛电镜固定液中固定24 h,PBS洗后以1%锇酸固定液固定,丙酮进行逐级脱水,用Epon 812包埋剂进行包埋,于60 ℃聚合24 h,超薄切片机切片后用醋酸铀及枸橼酸铅双重染色,用透射电子显微镜观察肝组织的超微结构。
3.4生化指标分析 各组精确称取100 mg肝组织,加0.9 mL无水乙醇置于EP管中,采用高通量组织匀浆机制作肝组织匀浆,4 ℃、956×g,离心10 min,取上清,用TC和TG试剂盒测定肝组织匀浆上清中TC和TG含量水平。
3.5氧化应激指标检测 各组称取100 mg肝组织,加入0.9 mL生理盐水后制作肝组织匀浆,4 ℃、664×g,离心10 min,取上清液进行肝组织的SOD活性、MDA含量及T-AOC的检测,具体步骤按照试剂盒说明书操作。
3.6Western blot检测大鼠肝组织SIRT1、 p53和Ac-p53蛋白含量水平 各组称取20 mg肝组织于EP管中,加入200 μL RIPA裂解液制成肝组织匀浆,离心后取上清,使用Bradford法检测上清液中蛋白浓度。样品经SDS-PAGE分离蛋白后,转印至PVDF膜上,用TBST稍洗后加入5%脱脂奶粉封闭60 min。洗膜后加Ⅰ抗稀释液于4 ℃过夜孵育,洗膜后加Ⅱ抗稀释液置室温摇床孵育1 h,充分洗涤。选择GAPDH抗体作为内参照。Ⅱ抗孵育后,将膜置于干净的保鲜膜上,在膜上滴加适量ECL化学发光液,确保均匀覆盖并放置3 min~5 min,后于暗室内压片显影。
4 统计学分析
用SPSS 19.0对数据进行统计,绘图软件采用GraphPad Prism 5.0。计量资料采用均数±标准差(mean±SD)表示,各组间两两比较采用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 各组大鼠一般情况观察
正常组大鼠毛发光亮致密,动作敏捷,反应迅速,大便黑褐色,笼中垫料湿度一般。与正常组相比,模型组大鼠体态明显肥胖,体毛枯黄而稀疏,动作反应迟缓,大便色黄质软有油腻感,笼中垫料湿度大。小檗碱组大鼠在体态、毛发、大小便、动作反应等方面均较模型组好转。体重情况详见图1。

Figure 1.The body weight in each group. Mean±SD.n=8.**P<0.01vsnormal group;▲P<0.05vsmodel group.
图1各组大鼠体重
2 HE染色
正常组肝细胞结构清晰、呈多边形,肝索呈放射状排列,胞质呈紫红色,细胞核大而圆,处于细胞中央,偶见少量脂滴;模型组肝细胞结构不清晰,肝索放射状排列不明显,细胞明显肿大如气球状,视野中可见大量大小不一圆形脂肪空泡,脂肪空泡将细胞核压至一侧;小檗碱组与模型组相比,肝细胞、肝索结构等有所改善,细胞形态好转,脂肪空泡明显变少,见图2。
Figure 2.HE staining of liver tissues in rats (scale bar=100 μm).
图2各组大鼠肝组织HE染色
3 油红O染色
正常组肝细胞呈淡紫色,细胞核呈蓝色,细胞界限清晰,排列有序,胞内未见明显红染脂滴。模型组明显可见肝细胞肿大,胞内大量橘红色脂滴,胞核被挤至一侧,甚至相邻细胞内脂滴融合。小檗碱组视野中橘红色脂滴明显减少,细胞形态等都有不同程度改善,见图3。
Figure 3.Oil red O staining of liver tissues in rats (scale bar=100 μm).
图3各组大鼠肝组织油红O染色
4 透射电镜观察
正常组中肝细胞结构完整,胞内线粒体丰富,胞质中偶见少量脂滴分布,直径少于1 μm,内质网结构正常。模型组中肝细胞结构模糊,边界不清,胞内线粒体肿胀,胞质内有大量不同大小的圆形脂滴,部分脂滴直径可达3 μm,内质网扩张。与模型组相比,小檗碱组的肝细胞中脂滴直径与聚集程度都明显减小,最大的脂滴直径为2 μm,线粒体肿胀和内质网的损伤明显减轻,见图4。
Figure 4.Transmission electron microscopic photographs of liver tissues in rats (scale bar=2 μm). Red arrows: adipose degeneration; green arrow: swollen mitochondria; blue arrows: expanded endoplasmia.
图4各组大鼠肝组织透射电子显微镜观察
5 各组大鼠肝脂含量变化
与正常组相比较,模型组肝组织匀浆中TC和TG含量水平显著升高(P<0.01);与模型组相比,小檗碱组肝组织匀浆中TC和TG含量水平显著下降(P<0.05或P<0.01),见图5。
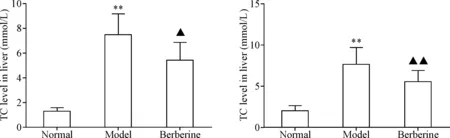
Figure 5.The levels of TC and TG in the liver of rats. Mean±SD.n=8.**P<0.01vsnormal group;▲P<0.05,▲▲P<0.01vsmodel group.
图5各组大鼠肝组织TC和TG水平
6 各组大鼠肝组织SOD活性、MDA含量和T-AOC的变化
与正常组比较,模型组肝组织匀浆中MDA的水平显著升高,而SOD活性和T-AOC显著降低(P<0.01);小檗碱组与模型组相比,肝组织匀浆中MDA的水平显著降低而SOD活性和T-AOC显著升高(P<0.01),见表1。
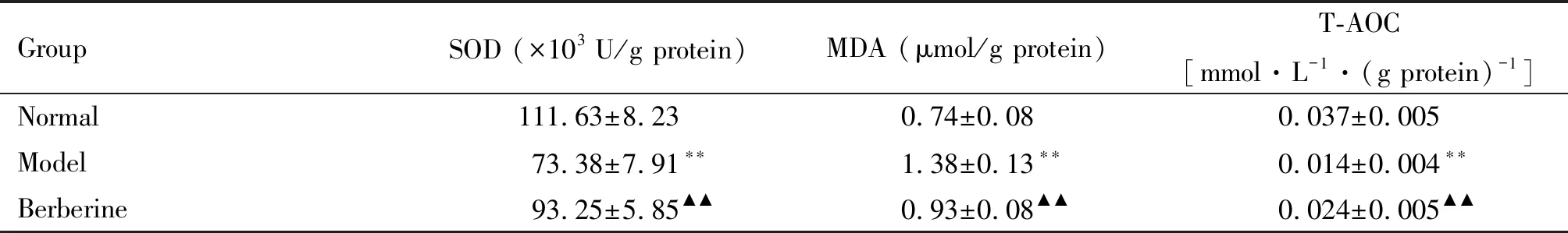
表1 肝组织SOD活性、MDA含量及T-AOC水平变化的比较
**P<0.01vsnormal group;▲▲P<0.01vsmodel group.
7 各组大鼠肝组织SIRT1/p53通路相关蛋白的变化
与正常组相比,模型组大鼠肝组织SIRT1蛋白相对表达量显著降低(P<0.05),而Ac-p53相对表达量显著上升(P<0.01);与模型组相比,小檗碱组大鼠肝组织SIRT1蛋白相对表达量显著升高(P<0.05),而Ac-p53相对表达量显著下降(P<0.01)。3组间的总p53相对表达量没有显著差异,见图6。
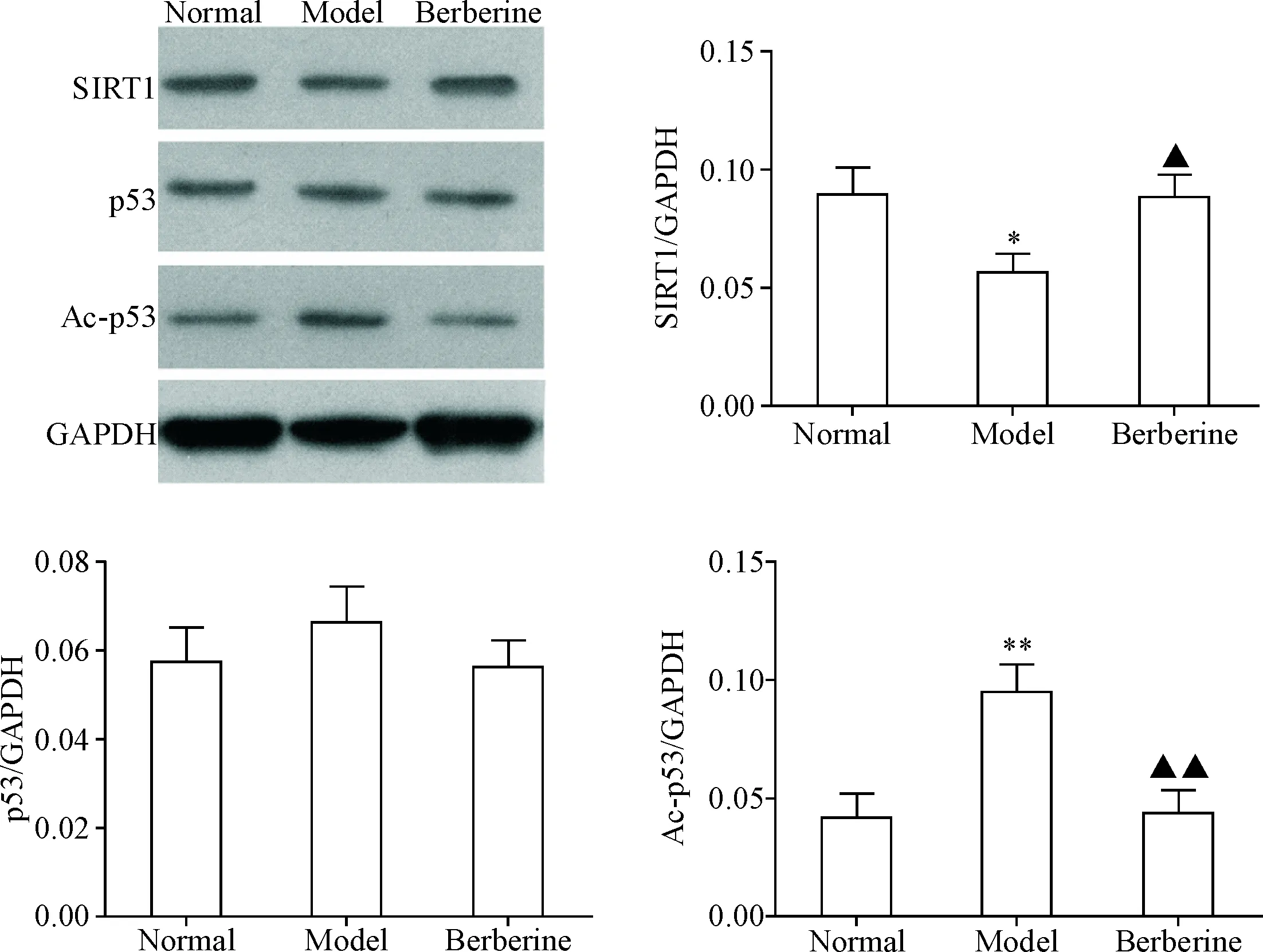
Figure 6.The expression levels of SIRT1, p53 and Ac-p53 proteins in liver tissues of rats. Mean±SD.n=5.*P<0.05,**P<0.01vsnormal group;▲P<0.05,▲▲P<0.01vsmodel group.
图6各组大鼠肝组织SIRT1、p53和Ac-p53蛋白表达水平
讨 论
随着多种新型检查手段的发展与标志物的发现,无创诊断NAFLD的技术趋于成熟,但肝组织活检仍然是NAFLD诊断的金标准[10]。本研究通过组织病理观察到模型组大鼠肝脏存在明显的脂质沉积;同时,模型组肝组织匀浆TC、TG的含量较正常组显著升高,提示高脂饮食喂养大鼠16周成功诱导NAFLD动物模型。
小檗碱是从黄连和黄柏等传统中草药中提取的一种的生物碱,临床常用来治疗湿热蕴结胃肠道等疾病。研究表明,小檗碱具有抗氧化、降低血脂和血糖等作用,还能作为保肝剂用于多种肝毒性因子诱导的肝脏疾病[11-14]。本研究表明,在小檗碱干预下,高脂饮食喂养大鼠肝脏的氧化损伤和脂质蓄积状态有显著改善,对NAFLD的防治具有意义。
氧化应激损伤是NAFLD发生发展的重要因素之一[15]。研究表明,测定肝组织中SOD的活性以及MDA和T-AOC的含量可以反映肝脏氧化应激损伤的程度[16-18]。我们的实验结果显示,模型组大鼠的肝组织匀浆中MDA的水平显著升高,而SOD活性和T-AOC显著降低,提示NAFLD大鼠肝脏出现严重的氧化损伤状况。而在小檗碱的干预下,NAFLD大鼠肝脏的SOD活性和T-AOC含量显著增加,而MDA的含量显著降低,提示小檗碱干预能提高NAFLD肝脏的抗氧化能力并改善肝脏的脂质过氧化,从而减轻NAFLD肝脏的氧化损伤。SIRT1是一种烟酰胺腺嘌呤二核苷酸依赖性蛋白质脱乙酰基酶,其能显著降低机体内活性氧的水平并改善在氧化应激条件下细胞的存活状态[19]。Ren等[20]研究指出,蓝莓汁和双歧杆菌可以上调SIRT1蛋白的表达从而增强NAFLD大鼠肝脏的抗氧化能力。肿瘤抑制因子p53在NAFLD的发病机制中或许扮演着重要的角色,其是SIRT1的去乙酰化目标之一,正常情况下通过MDM2介导的泛素化及降解途径维持着低水平表达,在病理状态下通过乙酰化等转录修饰以表现其活性[21-22]。研究表明,p53抑制剂干预能抑制p53的转录从而减少由饮食引起的NAFLD小鼠肝脏的氧化损伤[4]。更有研究表明,SIRT1激活剂能提高SIRT1蛋白的表达,从而增强对p53的去乙酰化来减轻细胞的凋亡活性[23]。结合我们的Western blot结果,小檗碱改善NAFLD大鼠肝脏的氧化损伤状态可能通过上调SIRT1蛋白的表达,从而抑制p53的乙酰化来实现。
脂质紊乱所引起的肝细胞脂肪变性也是NAFLD发病机制中的因素之一[24]。SIRT1能抑制脂肪合成与促进脂肪酸β-氧化,是减轻NAFLD肝脏脂肪积蓄的潜在药物靶点之一[25]。据相关文献报道,肝脏特异性敲除SIRT1小鼠在普通饲料喂养的情况下,会出现肝脏脂肪性变[26]。临床研究表明,NAFLD患者血清中SIRT1 mRNA和蛋白的相对表达量比健康受试者明显下降[27];动物实验得出高脂饮食喂养的SD大鼠肝脏SIRT1水平显著下降的结论[28]。我们的结果也显示,在高脂饲料喂养16周后,大鼠肝脏的脂肪积蓄较为严重,而且肝组织SIRT1蛋白表达显著下降,而Ac-p53蛋白表达显著上升。p53不仅与肝脏的氧化状态有关,还能调控肝脏的脂质代谢。Castro等[29]等研究指出,熊去氧胆酸可以通过上调体内和原代大鼠肝细胞中SIRT1蛋白的表达从而降低Ac-p53的表达来改善NAFLD的严重程度。所以,通过调控SIRT1/p53通路,增强SIRT1蛋白的表达,降低p53的乙酰化水平以减弱其活性,是治疗NAFLD的潜在机制与途径之一。
本研究结果表明,小檗碱干预高脂饮食喂养大鼠16周后,大鼠肝脏的脂肪积蓄减轻,肝组织SIRT1蛋白表达显著上升,而Ac-p53蛋白表达显著下降。有研究指出,小檗碱能减轻高脂高糖喂养的普通C57BL/6小鼠肝脏脂肪变性,但是小檗碱的这种有益作用并没有在同样饮食情况下的SIRT1肝脏特异性敲除小鼠身上观察到[30],这表明SIRT1是小檗碱降脂作用的一个关键因素。结合本研究的结果,提示小檗碱通过上调SIRT1蛋白的表达,从而抑制p53的乙酰化,这可能是小檗碱干预减轻肝脏脂质蓄积、治疗NAFLD的机制之一。
综上所述,小檗碱减轻高脂饮食诱导的NAFLD大鼠肝脏氧化损伤反应和脂肪蓄积可能是通过调控SIRT1/p53通路来实现。
