特异性小干扰RNA沉默CHOP对肾小管上皮细胞凋亡的影响*
2019-04-22祝高红王筱雯栾江威
祝高红, 王筱雯, 戚 畅, 栾江威
(华中科技大学同济医学院附属武汉儿童医院肾病内科, 湖北 武汉 430010)
急性肾损伤是一种严重危害人类健康的临床危重症,可导致机体多种器官发生损伤[1-2]。近年来临床治疗和研究急性肾损伤的技术在不断提高,但仍然无法解决急性肾损伤患者住院周期长、耗费医疗资源多及预后差等问题,给社会和家庭带来严重的经济负担。目前,研究表明肾小管上皮细胞凋亡率的增加、氧化应激、炎症以及内质网应激等异常在急性肾损伤的发生、发展中起作用作用[3-6]。
C/EBP同源蛋白(C/EBP homologous protein,CHOP)是内质网应激相关蛋白。在细胞的凋亡过程中,内质网应激活化CHOP,促进细胞的凋亡。研究表明,肾组织中CHOP的表达量异常,促进肾小管上皮细胞凋亡,加重肾损伤程度,提示CHOP在肾损伤过程中发挥重要作用[7-8]。因此本实验通过小干扰RNA(small interfering RNA,siRNA)特异性敲减CHOP的表达量,观察其表达量的变化对体外培养的肾小管上皮HK2细胞凋亡的影响。
材 料 和 方 法
1 一般资料
收集2014年~2017年武汉市儿童医院肾内科1~10岁肾损伤患者103例以及健康对照98例,1 000×g离心收集患者静脉血清,患者或其家属均签署知情同意书,并由武汉市儿童医院医学伦理委员会审批通过。
2 实验试剂和仪器
肾小管上皮HK2细胞购自中科院上海细胞库。胎牛血清和DMEM培养基购自Gibco;青-链霉素、二喹啉甲酸(bicinchoninic acid,BCA)、MTT试剂盒和转化生长因子β1(transforming growth factor-β1,TGF-β1)购自Sigma;增强化学发光(enhanced chemiluminescence,ECL)试剂盒购自上海普飞生物公司;细胞凋亡检测试剂盒购自江苏碧云天生物有限公司;TRIzol购自Invitrogen;荧光定量PCR试剂盒购自赛默飞世尔公司;Lipofectamine 2000购自杭州吉诺生物有限公司;siRNA购自上海吉玛生物公司;抗CHOP抗体和抗GAPDH抗体购自北京博奥森生物有限公司;抗细胞核抗原Ki-67抗体、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体、caspase-3抗体及cleaved caspase-3抗体购自Cellular Signaling Technology。PCR扩增仪购自BIO-RAD;酶标仪购自赛默飞世尔公司。
3 方法
3.1qPCR实验 根据TRIzol试剂说明书提取血清或细胞中总RNA,反转录为cDNA。以cDNA为模板进行PCR扩增反应。上海生工合成CHOP引物,CHOP的上游引物序列为5’-AGTCTCTGCCTTTCGCCTTT-3’,下游引物序列为5’-GGTGCTTGTGACCTCTGCT-3’。反应条件为:95 ℃ 5 min;95 ℃ 15 s、60 ℃ 30 s、72 ℃ 30 s,40 cycles。以GAPDH为内参照,采用2-ΔΔCt法计算CHOP mRNA的相对表达量。
3.2细胞的培养和处理 肾小管上皮细胞HK2培养于含10%胎牛血清和1%的青-链霉素的DMEM培养基,放入37 ℃、5% CO2的细胞培养箱中,当细胞浓度达到80%左右,加入胰酶进行消化、传代。选取生长状态良好的细胞,加入TGF-β1(5 μg/L)处理细胞,构建肾小管上皮细胞损伤模型[9]。
3.3Western blot实验 提取各组细胞中的总蛋白,BCA法检测浓度,沸水变性10 min;吸取40 μg总蛋白进行10% SDS-PAGE。将分离得到的蛋白转移至聚偏氟乙烯膜中,室温下置于5%的脱脂奶粉溶液中封闭30 min;加入 I 抗,4 ℃孵育过夜,TBST漂洗后加入 II 抗,37 ℃孵育2 h,TBST漂洗后加入ECL液孵育5 min,曝光、拍照,Quantity One分析蛋白质灰度值。
3.4细胞的转染 肾小管上皮HK2细胞分为3组:对照(control)组、阴性(negative)组和si-CHOP组。对照组为常规培养的细胞,阴性组和si-CHOP组分别转染阴性对照siRNA和CHOPsiRNA。转染前24 h,将细胞接种于6孔板中培养,待细胞密度达到90%,根据Lipofectamine 2000说明书开始转染,qPCR和Western blot鉴定转染效果。
3.5MTT法检测细胞活力 将各组肾小管上皮HK2细胞的密度调整5×103个,接种于96孔板上,培养48 h后,加入20 μL MTT溶液,37 ℃孵育4 h,加入200 μL DMSO,酶标仪中检测细胞在570 nm的吸光度(A)。
3.6流式细胞术检测细胞的凋亡情况 调整肾小管上皮HK2细胞密度为1×109/L,培养24 h后,每孔加入10 μL 膜联蛋白 V-FITC和5 μL 碘化丙啶,避光,4 ℃染色15 min,流式细胞术分析细胞的凋亡率。
4 统计学分析
采用SPSS 22.0软件进行统计处理。实验重复3次,实验结果以均数±标准差表示(mean±SD)。两组间数据的比较采用t检验,多组数据间的比较采用单因素方差分析,组间多重比较使用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 CHOP mRNA在肾损伤患者血清中的水平
qPCR检测健康对照和肾损伤患者血清中CHOP的mRNA水平,结果显示肾损伤患者血清中CHOP的mRNA水平明显高于健康对照者(P<0.05),见图1。
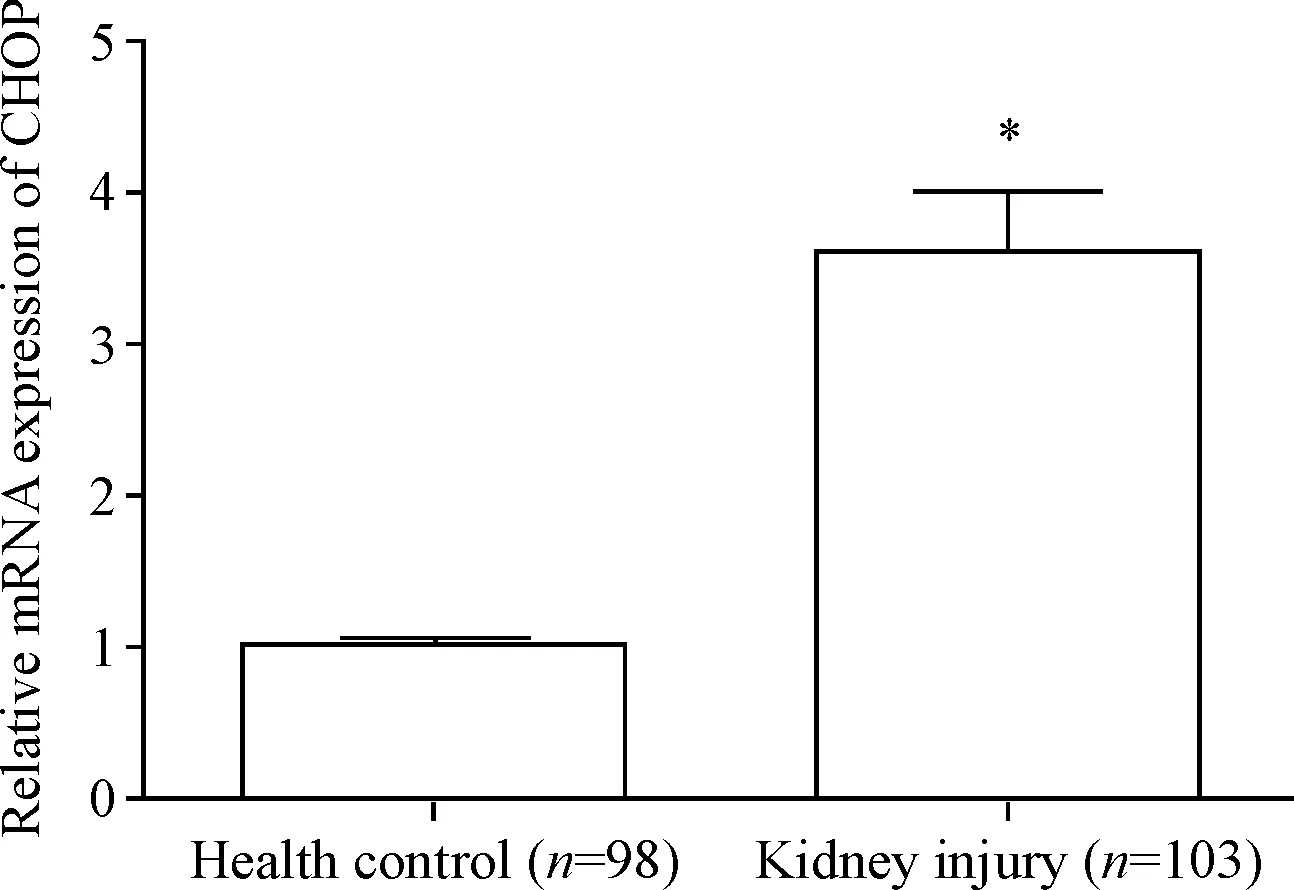
Figure 1. The mRNA levels of CHOP were detected by qPCR. Mean±SD.*P<0.05vshealth control.
图1qPCR检测CHOP的mRNA水平
2 敲减CHOP表达对肾小管上皮HK2细胞中CHOP表达量的影响
肾小管上皮HK2细胞转染CHOPsiRNA后,CHOP的mRNA表达量较对照组显著降低(P<0.05),见图2。
3 敲减CHOP表达对肾小管上皮HK2细胞活力的影响
敲减CHOP表达后,肾小管上皮HK2细胞的活力较对照组显著增强(P<0.05),见图3。
4 敲减CHOP表达对肾小管上皮细胞HK2凋亡的影响
敲减CHOP表达后,肾小管上皮HK2细胞的凋亡率较对照组显著降低(P<0.05),见图4。
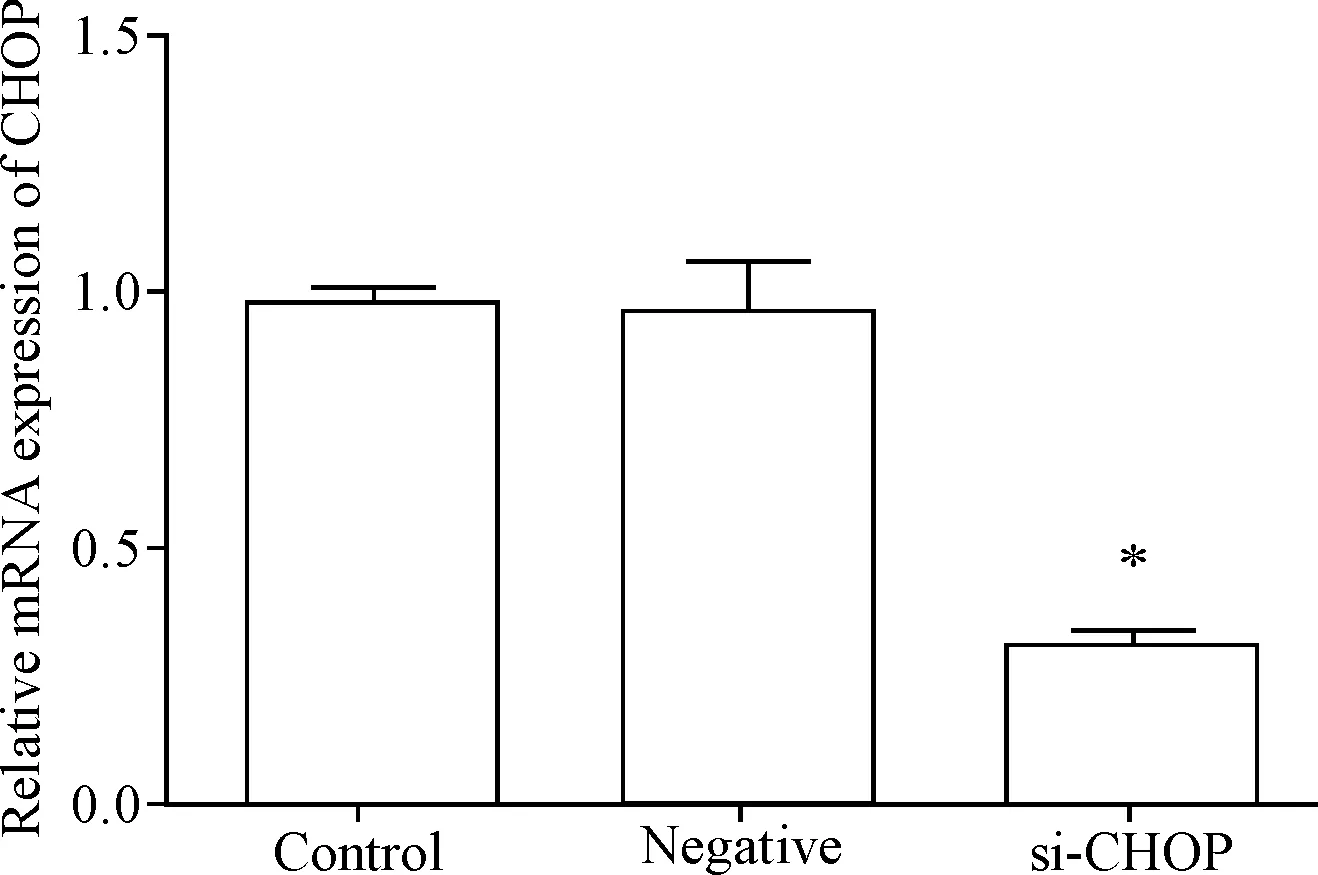
Figure 2.The mRNA expression of CHOP was detected by qPCR after transfection.Mean±SD.n=3.*P<0.05vscontrol group.
图2qPCR检测转染后CHOP的mRNA表达量

Figure 3.The effect ofCHOPexpression knock-down on the viability of renal tubular epithelial HK2 cells. Mean±SD.n=3.*P<0.05vscontrol group.
图3敲减CHOP表达对肾小管上皮HK2细胞活力的影响
5 敲减CHOP表达对增殖和凋亡相关蛋白水平的影响
与对照组相比,敲减CHOP表达显著增加肾小管上皮HK2细胞中Ki-67和PCNA的蛋白水平,降低cleaved caspase-3的蛋白水平(P<0.05),但对caspase-3蛋白水平无显著影响,见图5。
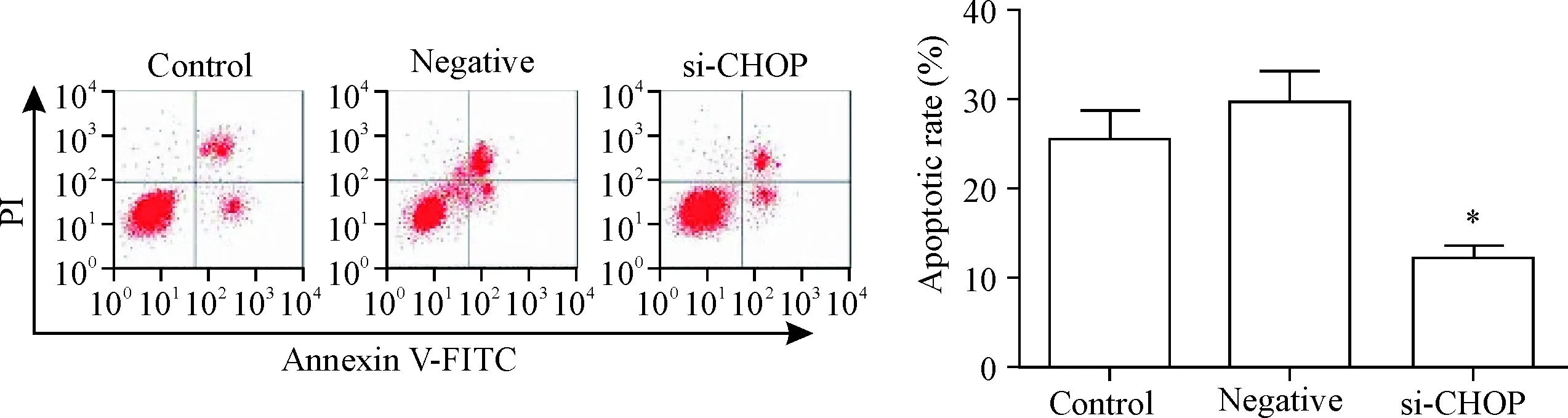
Figure 4.The effect ofCHOPexpression knock-down on the apoptosis of renal tubular epithelial HK2 cells. Mean±SD.n=3.*P<0.05vscontrol group.
图4敲减CHOP表达对肾小管上皮HK2细胞凋亡的影响

Figure 5.The effect ofCHOPexpression knock-down on the expression levels of proliferation- and apoptosis-related proteins. Mean±SD.n=3.*P<0.05vscontrol group.
图5敲减CHOP表达对增殖和凋亡相关蛋白水平的影响
讨 论
急性肾损伤是一种发病率较高的临床危重症,受多种原因的影响导致肾功能低下,伴有少尿或无尿的症状,其死亡率较高。内质网应激在急性肾损伤发病机制中起重要作用,并在急性肾损伤的预防、诊断和治疗过程中发挥重要的作用,有望成为治疗急性肾损伤的新靶点,具有重要的应用前景[10-11]。因此研究急性肾损伤的分子机制、寻找治疗急性肾损伤的新靶点,有助于提高其治疗手段,降低急性肾损伤的死亡率以及提高其预后,对早期诊断、治疗急性肾损伤具有重要意义。CHOP是内质网应激中的重要转录因子,在哺乳动物细胞中广泛表达。机体在正常状态下,CHOP在细胞浆中少量表达,当病理状态下,发生内质网应激促进CHOP的表达量,调控基因的表达。研究发现,在穿心莲内脂诱导的肾小管上皮HK2细胞凋亡增加的过程中,降低CHOP表达量显著抑制细胞的凋亡[12]。醛固酮可导致肾小管上皮细胞凋亡率升高,加重肾损伤过程,siRNA特异性降低CHOP表达量可逆转醛固酮的肾损伤作用[13],表明CHOP在肾损伤导致的肾小管上皮细胞凋亡的过程中发挥重要作用。在本实验中,肾损伤患者的血清中CHOP表达量显著高于健康对照组,表明CHOP的表达量调节肾损伤的发生、发展过程。
细胞的增殖以及凋亡的动态平衡对机体器官和组织正常生长、发育具有十分重要的作用。Ki-67、PCNA及caspase-3对细胞的增殖和凋亡具有重要意义。Ki-67位于10q2.5染色体上,是检测肿瘤细胞增殖活性的重要标志物,目前已经应用于多种肿瘤的早期诊断和预防过程中[14-16]。PCNA在正常细胞以及病理状态下的细胞中均有表达,是检测细胞异常增殖的关键蛋白。Caspase-3是细胞凋亡信号通路caspase家族的枢纽蛋白,当细胞凋亡信号通路被激活,可诱导产生酶级联反应,激活caspase-3蛋白的活化,从而诱导细胞的凋亡。本研究结果显示,给予TGF-β1构建的肾小管上皮HK2细胞损伤模型中,细胞中CHOP的表达量增加,细胞活力降低,凋亡率显著升高;转染CHOPsiRNA显著降低肾小管上皮HK2细胞中CHOP的表达量;特异性敲减CHOP的表达量显著增加肾小管上皮HK2细胞的活力,抑制其凋亡,增加Ki-67和PCNA蛋白的表达,下调cleaved caspase-3的蛋白水平。
综上所述,敲减CHOP的表达量可通过调节增殖和凋亡相关蛋白水平抑制肾小管上皮HK2细胞的凋亡,增强细胞的活力。本研究为急性肾损伤的分子诊断和治疗提供了潜在的靶点。
