黔产淡黄花百合中多糖含量的测定
2019-04-22黄芯琦周小媚钟可刘珂杨婷婷张丹
黄芯琦,周小媚,钟可,2*,刘珂,杨婷婷,张丹
(1.贵阳中医药大学,贵州 贵阳 550025;2.国家苗药工程技术研究中心,贵州 贵阳 550025)
百合科百合属植物淡黄花百合(LiliumsulphureumBaker)是山百合药材的基原之一,收载于2003版《贵州省中药材、民族药材质量标准》,药用部位为干燥的肉质鳞叶,是贵州省常用的民族民间药,具有清心安神,养阴润肺之功效[1]。多糖是百合科百合属植物的活性成分之一,具有抗肿瘤、抗氧化、抗疲劳、降血糖、调节免疫力等药理作用[2-4]。目前,有关山百合药材中多糖含量的研究尚未见报道,本文拟以黔产淡黄花百合为实验对象,采用苯酚-硫酸法测定其多糖的含量,并对显色条件、提取条件进行了摸索考察,建立最佳的含量测定方法。对贵州不同产地的淡黄花百合的多糖含量进行了测定,为山百合药材质量研究提供参考。
1 材料
1.1 材料与试剂
实验所用淡黄花百合采自贵州省,均为野生品,来源见表1,经贵阳中医学院张文龙副教授和钟可副教授鉴定为百合科植物淡黄花百合LiliumsulphureumBaker。鳞茎放入烘箱低温烘干,粉碎过4号筛备用。D-无水葡萄糖(中国食品药品检定研究院,批号110833-201506,仅供国家药品标准检验用);95%乙醇(国药集团化学试剂有限公司,AR,批号:20151222);苯酚(重庆川东化工有限公司,AR,批号:20130501);浓硫酸(重庆川东化工有限公司,AR,批号:20160601);实验用水均为娃哈哈纯净水。
1.2 仪器
紫外分光光度计(上海元析仪器有限公司,UV—5900);电子天平(XS205,瑞士梅特勒公司);回流装置;水浴锅(常州澳华仪器有限公司,HH-6);数显电热鼓风干燥箱(上海博讯公司,GZX-9070MBE)。
2 方法与结果
2.1 对照品溶液的配制
精密称取D-无水葡萄糖对照品10.02 mg于50 mL的容量瓶中,加水至刻度,摇匀,得到浓度为0.200 4 mg/mL的葡萄糖对照品储备液。
2.2 检测波长的确定
精密移取2.1项下对照品溶液2 mL于15 mL具塞试管中,精密加入5%苯酚1 mL和浓硫酸5 mL[5-6],摇匀,常温避光静置显色40 min,以相应试剂为空白,扫描吸收光谱(200~800 nm)。见图1。
精密移取2.5.3项下供试品溶液2 mL于15 mL具塞试管中,精密加入5%苯酚1 mL和浓硫酸5 mL,摇匀,常温避光静置显色40 min,以相应试剂为空白,扫描吸收光谱(200~800 nm)。见图2。
扫描结果表明,在489.5 nm处葡萄糖对照品和样品溶液有最大吸收,故选择489.5 nm为测定波长。

表1 样品来源

图1 葡萄糖对照品波长扫描图
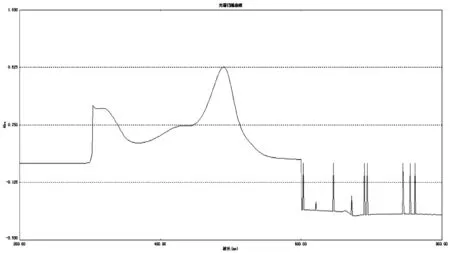
图2 样品波长扫描图
2.3 显色条件的确定
精密量取2.1项下的对照品储备液8 mL,置于50 mL的容量瓶中,加水至刻度,摇匀。精密吸取该溶液2 mL置于15 mL的具塞试管中,加入5%苯酚1 mL混匀,迅速加入5 mL浓硫酸,混匀,按表2的条件显色,以相应试剂为空白,在489.5 nm处测其吸光度。

表2 多糖显色条件考察(n=3)
由以上结果确定显色条件为:精密吸取上述溶液2 mL置于15 mL的具塞试管中,加入5%苯酚1 mL混匀,迅速加入5 mL浓硫酸,混匀,避光静置40 min,显色。
2.4 标准曲线的绘制
精密吸取2.1项下对照品储备液2、3、4、5、6 mL置于25 mL的容量瓶中,加水至刻度,摇匀。精密吸取上述各溶液2 mL置于15 mL的具塞试管中加入5%苯酚1 mL混匀,迅速加入5 mL浓硫酸,混匀,常温避光静置显色40 min,以相应试剂为空白,在489.5 nm处测其吸光度,以葡萄糖对照品浓度为横坐标,吸光度为纵坐标,绘制标准曲线并计算回归方程和相关系数。得到回归方程为A=13.076x+0.057,r=0.999 8,线性范围0.016 0~0.048 1 mg/mL。
2.5 供试品提取条件考察
同属药用植物多糖的含量测定中常用的提取方法有回流提取和超声波提取,回流提取操作简单、成本低廉但时间长,超声提取操作简便、快速[7]。为了明确哪种方法更适合淡黄花百合中多糖的提取,本实验比较了回流提取与超声提取。
2.5.1 超声提取
精密称取5号样品粉末,每份约50 mg,置于250 mL锥形瓶中,加入50 mL 95%乙醇,超声30 min,于90℃水浴挥干,得滤渣;加水50 mL于50℃下超声提取30 min、45 min、60 min,过滤,取滤液于250 mL容量瓶中,残渣用蒸馏水洗涤,加水至刻度,摇匀,即得供试品溶液。精密量取上述溶液2 mL于具塞15 mL试管中,按2.3项下条件显色,以相应试剂为空白,在489.5 nm下进行检测。实验结果见表3。
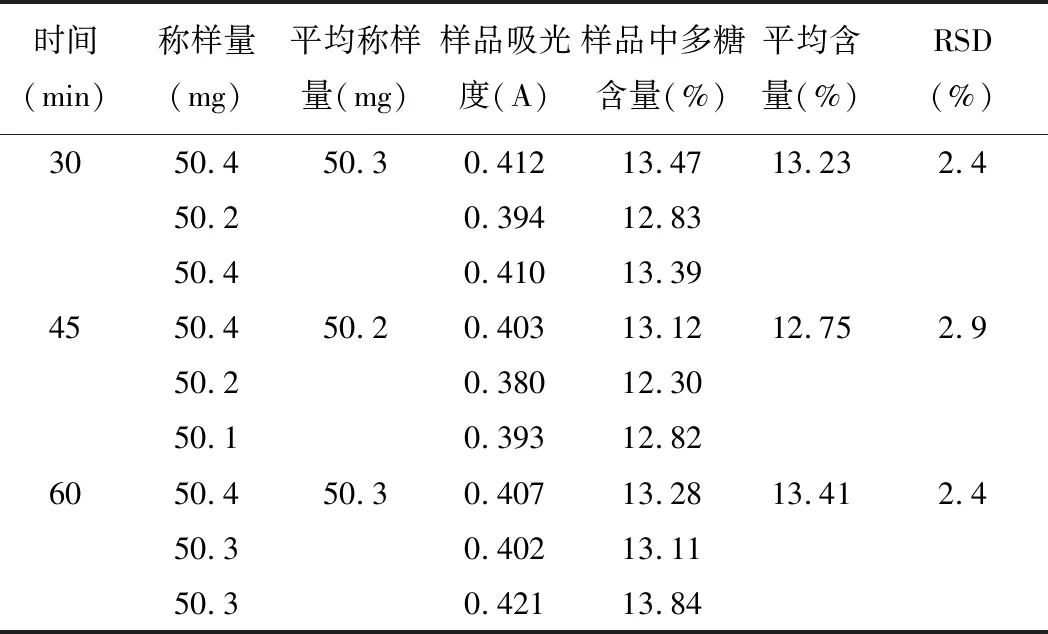
表3 超声提取时间考察(n=3)
由测定结果可知:超声提取60 min时,多糖含量最高,所以将多糖超声提取的时间定为60 min。
精密称取5号样品粉末,每份约50 mg,置于250 mL锥形瓶中,加入50 mL95%乙醇,超声30 min,于90℃水浴挥干,得滤渣;加水50 mL于30℃、40℃、50℃下超声提取60 min,过滤,取滤液于250 mL容量瓶中,残渣用蒸馏水洗涤,加水至刻度,摇匀,即得供试品溶液。精密量取上述溶液2 mL于具塞15 mL试管中,按2.3项下条件显色,以相应试剂为空白,在489.5 nm下进行检测。结果见表4。
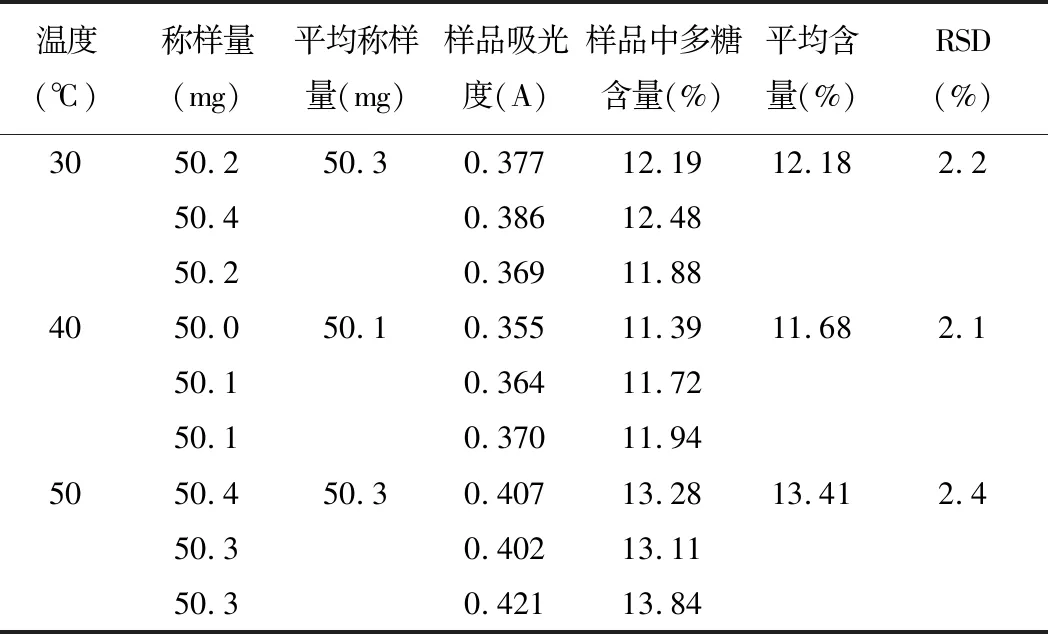
表4 超声提取温度考察(n=3)
由测定结果可知:超声提取温度为50℃时,多糖含量最高,所以将多糖的超声提取温度定为50℃。由以上实验结果可知,超声提取的最佳条件为:超声温度50℃下提取60 min。
2.5.2 回流提取
精密称取5号样品粉末,每份约50 mg,置250 mL圆底烧瓶中,加入50 mL95%乙醇,于80℃下回流30 min,90℃水浴挥干,收集滤渣;冷却至室温,加水50 mL,温度固定为蒸馏水的沸点,沸腾后回流1 h、1.5 h、2 h[8],过滤,得滤液,置于250 mL容量瓶中,残渣用蒸馏水洗涤,加水至刻度,摇匀,即得供试品溶液。精密量取上述溶液2 mL于具塞15 mL试管中,按2.3项下条件显色,以相应试剂为空白,在489.5 nm下进行检测。见表5。
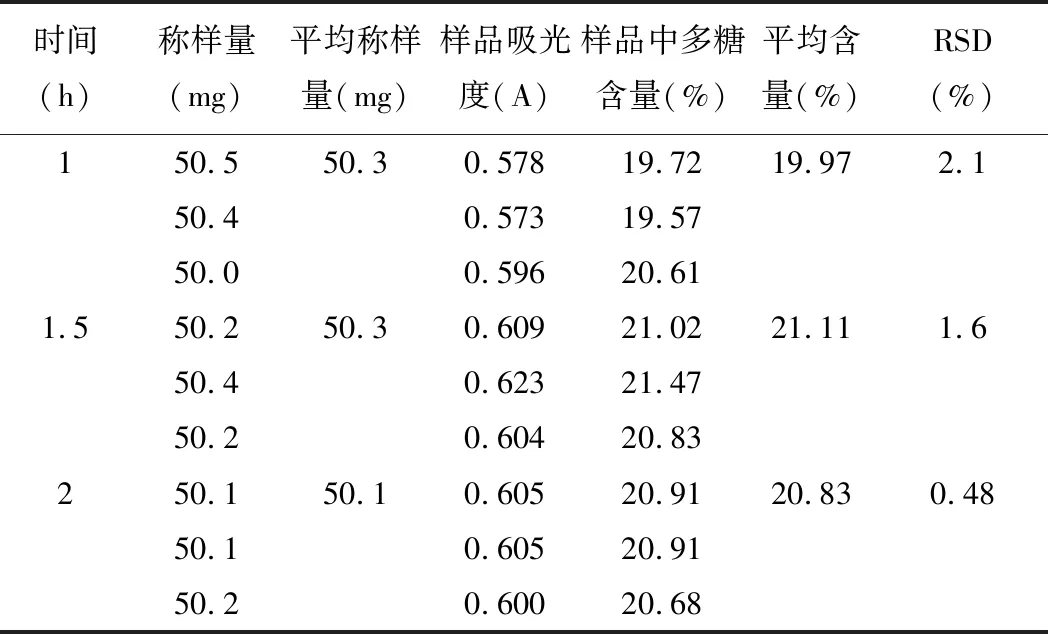
表5 回流提取时间考察(n=3)
由测定结果可知:回流提取的最佳提取条件为:沸腾后提取1.5 h。
2.5.3 供试品溶液制备方法的确定
通过比较超声提取与回流提取多糖的含量,供试品溶液的最佳制备方法为:精密称取药材粉末,每份约50 mg,置250 mL圆底烧瓶中,加入95%乙醇50 mL,于80℃下回流30 min,90℃水浴挥干,收集滤渣;冷却至室温,加水50 mL,沸腾后回流1.5 h,过滤,得滤液,转移至250 mL容量瓶中,残渣用蒸馏水洗涤,加水至刻度,摇匀,即得供试品溶液。
2.6 精密度试验
取浓度为0.032 1 mg/mL的葡萄糖标准品溶液2 mL于15 mL具塞试管中,按2.3项下操作,以相应试剂为空白,在489.5 nm下进行检测连续测定6次。记录其吸光度值,RSD=0.88%,表明仪器精密度良好,符合要求。
2.7 稳定性试验
精密称取5号样品粉末,每份约50 mg于250 mL的圆底烧瓶中,照2.5.3项方法制备供试品溶液,按2.3项下操作,以相应试剂为空白,在489.5 nm下连续测定5次,分别于0、0.5、1.5、3.5、6.5 h测定其吸光度值,RSD=1.9%。结果表明本法所测样品在6.5 h内稳定。
2.8 重复性试验
精密称取6份5号样品粉末,每份约50 mg于250 mL圆底烧瓶中,照2.5.3项方法制备样品溶液,按2.3项下操作,以相应试剂为空白,在489.5 nm下进行检测。测定其吸光度值,并由回归方程计算样品中多糖的百分含量。得平均含量为19.96%,RSD=2.7%,结果所测样品的重复性良好。
2.9 加样回收率试验
精密称取5号样品粉末6份,每份约25 mg于250 mL的圆底烧瓶中,照2.5.3项方法制备,过滤得滤液后,在每份样品中分别加入5.0 mg的葡萄糖对照品,加水定容至250 mL容量瓶。按2.3项下操作,以相应试剂为空白,在489.5 nm下进行检测,测定吸光度并计算回收率,得平均回收率为99.1%,RSD=0.95%,结果见表6。
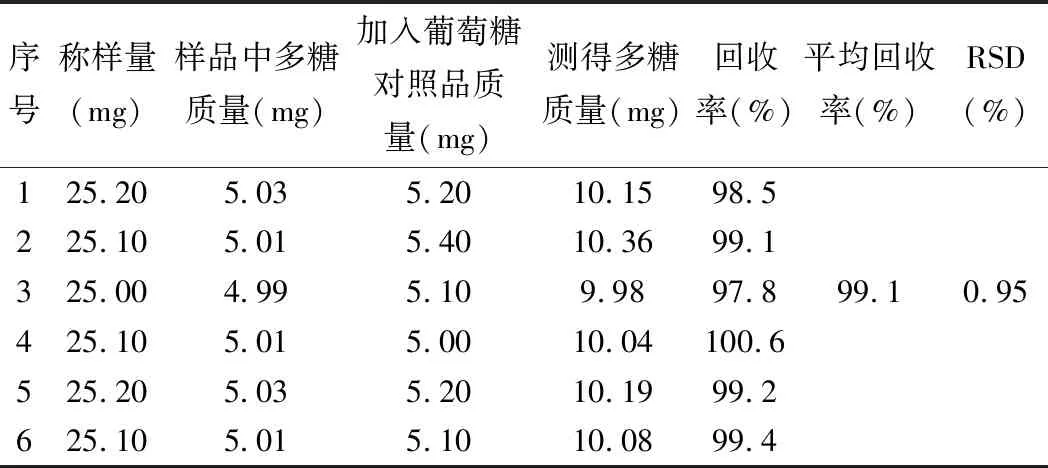
表6 加样回收率试验结果(n=6)
2.10 样品中多糖的含量测定
按2.5.3项方法制备样品溶液,按2.3项下操作,以相应试剂为空白,在489.5 nm下进行测定,由回归方程计算样品中多糖的百分含量。结果见表7。
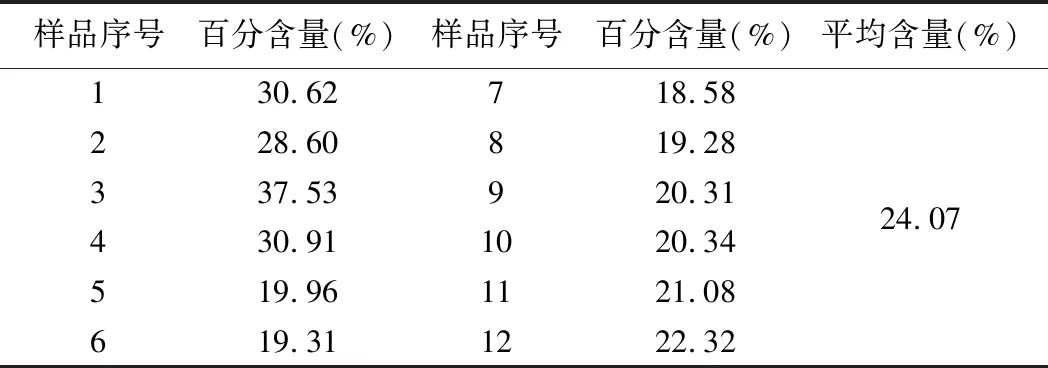
表7 多糖含量测定结果(n=3)
3 讨论
实验结果表明苯酚-硫酸法简便、灵敏且重现性好,显色物在6.5 h内稳定,能有效的应用于淡黄花百合中多糖的含量的测定。在提取条件的考察中,超声提取的最佳条件为50℃下超声提取60 min;回流提取最佳条件为沸腾后提取1.5 h。两者相比较,超声提取法成本较高、但快速简便,回流提取法操作简单,但耗时较长;回流提取法多糖得率较超声提取法更高,故选用回流提取法。本实验以黔产淡黄花百合为实验对象,对12个批次的样本中多糖的含量进行了测定,结果显示贵州不同产地的淡黄花百合的多糖含量存在差异,多糖的含量范围为18.58%~37.53%,平均含量为24.07%,其中产于花溪区的淡黄花百合多糖含量较高。淡黄花百合为多年生草本植物,所采集的样品均为野生品,由于生长环境和生长年限的不同,鳞茎大小不一,多糖含量的高低是否与其有关,还需做进一步研究。
