PRPS2在不同生精功能障碍睾丸组织中的表达以及对生精细胞凋亡和增殖的影响
2019-04-19董世桃杨智敏张明哲杨名慧王文华
董世桃,杨智敏,张明哲,杨名慧,王文华
(遵义医学院附属医院生殖中心,遵义 563003)
近几年,随着社会、工作压力逐渐增大,加之环境问题日益严峻,男性不育的发生率一直居高不下,尤其以无精子症为常见病因[1]。精子的产生是一个涉及多因素、多阶段的过程,任何一个环节出现障碍都会引起精子生成异常,无精子症一般分为梗阻性和非梗阻性两种,其中60%以上的患者为非梗阻性,是由于遗传因素、内分泌紊乱等导致睾丸生精功能障碍[2]。近些年,随着生殖医学的深入发展,大多数梗阻性患者通过睾丸取精术都可以受精成功,但是对于非梗阻性患者,目前临床上尚缺乏有效的治疗手段,经睾丸取精后受精成功率不到30%[3]。非梗阻性无精子症的发病因素复杂且多样化,临床大多采用经验式治疗,因此探索精子的发生机制具有重要的临床价值。近几年,大量研究发现,磷酸核糖焦磷酸合成酶2(PRPS2)在睾丸组织中呈高表达,与X染色体的失活密切相关[4]。但是尚没有研究证实PRPS2对精子发生的影响作用,因此我们基于上述理论,首先探讨PRPS2在生精功能不良的睾丸组织中的表达情况,并通过体外实验进一步研究PRPS2影响精子生成的作用机制,从而为寻找非梗阻性无精子症的候选诊断分子提供理论支持。
资料与方法
一、研究对象
1.临床资料:本项研究收集2015年7至2017年6月期间在我院病理科存档的石蜡包埋睾丸组织标本63例,纳入研究前由本院专业的病理科医师对组织切片进行复检,确定是睾丸组织标本,其中45例标本来自无精子症或严重少精子症患者,18例组织标本取自生精功能正常者,患者年龄为23~46岁,平均年龄为(30.15±4.46)岁。17例患者为轻度生精功能不良,14例患者为重度生精功能不良,14例患者为唯支持细胞综合征。本项研究获得遵义医学院附属医院伦理委员会的批准,并详细告知睾丸组织来源病例或病例家属其组织切片的用途,且确保病例资料不外泄。
2.受试细胞:小鼠精原细胞株GC1、小鼠精母细胞株GC2、小鼠支持细胞株TM4购自American Type Culture Collection公司。
二、实验试剂与方法
1.主要试剂:FBS胎牛血清、DMEM高糖培养基(GIBCO,美国);噻唑兰(MTT)(Sigma,美国);鼠单克隆PRPS2抗体(Abnova,美国)、辣根过氧化物酶标记的抗鼠IgG二抗(Abnova,美国);S-P免疫组化试剂盒(中杉金桥,北京);Trizol试剂、LipofectamineTM 2000、Opti-MEM(Invitrogen,美国);逆转录试剂盒和SYBR Green PCR Mix(Takara Bio,日本);cDNA合成试剂盒(OMEGA,美国);细胞凋亡试剂盒(OMEGA,美国)。PCR引物以及siRNA干扰靶序列来自NCBI数据库,并委托上海生工生物工程有限公司合成。
2.主要仪器:HERcell150i型CO2细胞培养箱(Thermo Scientific,美国);Eppendorf 5427 R台式高速冷冻离心机(Eppendorf,德国);实时定量PCR仪,iMake多功能酶标仪(Bio-Rad,美国);Amersham电泳仪(Bioscience,瑞典);FACSCalibur流式细胞仪(Becton Dickinson,美国)。
3.免疫组化:按照病理编号调出我院病理科存档石蜡包埋组织切片,脱蜡水化后,切片(1~2 μm),置于载玻片上,烘干48 h后待用;抗原热修复;灭活内源性过氧化物酶;封闭;加入PRPS2(1∶150稀释)一抗孵育;加入二抗孵育;滴加DAB试剂显色;苏木精复染。随机选择10个视野,置于倒置显微镜下,PRPS2呈胞核棕黄色染色。分别对染色强度和阳性染色细胞百分比进行客观评分:0分(阴性),1分(弱染色),2分(中度染色),3分(强染色)。阳性染色细胞的百分比:0分(0),1分(≤25%),2分(25%~≤50%),3分(50%~≤75%),4分(>75%)。染色指数(LI)=阳性细胞率×染色强度,LI<6分为低表达,LI≥6分为高表达。
4.构建PRPS2质粒以及细胞转染和细胞培养:基因沉默或过表达稳转细胞株:构建pGMLV-GFP RNAi慢病毒重组质粒并转染至感受态细胞DH5α中。根据质粒抽提试剂盒说明书提取质粒并转染至HEK293T细胞中。稳转前1 d接种细胞至6孔板中。按照脂质体转染说明书,在3个2 μl EP管中分别加入5 μl PRPS2、PRPS2 shRNA或对照溶液,以及250 μl无血清Opti-MEM培养基,按照LipofectamineTM 2000转染试剂盒说明书进行后续操作;将脂质体-质粒DNA 复合液滴加至孔板细胞表面,培养24~48 h后,提取细胞RNA,验证目的基因表达情况及转染效率。经嘌呤霉素筛选PRPS2基因沉默或过表达的稳定细胞系。随后将细胞培养在含有10% FBS和青霉素-链霉素双抗体的完全DMEM培养基中,将细胞置于37℃,5% CO2细胞培养箱中进行培养。24 h更换培养液,48 h(或待细胞融合率达到80%以上时)传代一次。
5.流式细胞术检测细胞凋亡:收集5×105个/ml细胞,洗涤3次后,加入500 μl Binding Buffer重悬,分别加入Annexin V 5 μl,避光孵育15 min,PE 5 μl避光孵育15 min;3 000 r/min离心5 min(离心半径8 cm),弃上清;加入300 μl结合缓冲液;采用流式细胞仪(EX=488 nm,Em=530 nm)检测细胞凋亡情况。
6.MTT法检测细胞增殖:将各组细胞(1×104个/孔)单层接种至96孔板中,每组设置8个复孔,置于37℃,5% CO2细胞培养箱中分别培养24 h、48 h、72 h、96 h后,加入20 μl MTT,37℃培养箱中继续孵育4 h,弃上清,加入200 μl/孔 DMSO,充分溶解紫色结晶物。置于iMake多功能酶标仪上,检测波长为450 nm处的吸光光度值(OD450 nm值),计算平均值。
7.实时荧光定量(qRT-PCR)法:收集饥饿处理24 h后的细胞1×1010个,加入1 ml预冷的Trizol,充分裂解5~10 min;按照试剂盒说明进行操作,提取细胞总RNA;将RNA充分干燥后加入20 μl DEPC水溶解,分装,置于-80℃保存备用。检测RNA浓度。根据RNA反转录试剂盒说明书操作将RNA逆转录为cDNA。以细胞cDNA为模板,以β-actin作为内参,制备20 μl反应体系进行PCR反应。
8.Western blot:提取蛋白样品,分装保存至-80℃备用;采用BCA法定量测定蛋白浓度;按照1∶1体积比加入2×SDS蛋白电泳缓冲液,置于100℃沸水中5 min,使蛋白充分变性;自然冷却后,置于-20℃备用。进行SDS-PAGE蛋白凝胶电泳,转膜,封闭;加入PRPS2一抗(1∶500稀释),4℃孵育过夜;采用PBST冲洗3次后,加入二抗(按照1∶5 000采用5% PBST牛奶稀释),室温孵育1 h;显影;采用FluorChem FC3凝胶成像数码分析系统对蛋白条带进行定量分析,以积分光密度(IOD)表示灰度值。
三、统计学分析
本研究采用SPSS 19.0统计学软件进行处理;两组间比较采用独立样本t检验,多样本均数比较采用单因素方差分析;P<0.05表示差异具有统计学意义。
结 果
一、不同睾丸组织中PRPS2的表达情况
免疫组织化学结果显示,生精功能正常的睾丸组织中PRPS2高表达率为72.22%,显著高于重度生精功能不良的睾丸组织以及唯支持细胞综合征睾丸组织(P<0.05);其中唯支持细胞综合征睾丸组织中PRPS2高表达率最低,显著低于轻度生精功能不良睾丸组织中PRPS2高表达率(P<0.05)(表1,图1)。
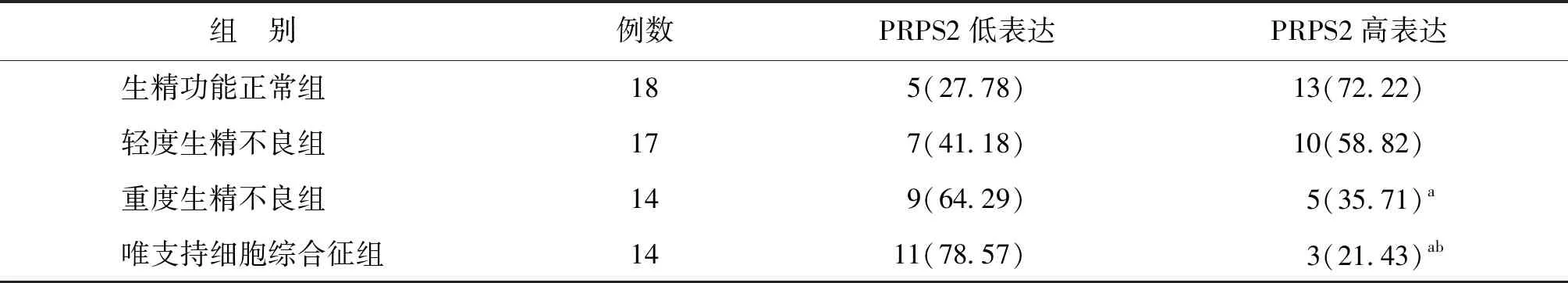
表1 不同类型睾丸组织中PRPS2的表达情况 [n(%)]
注:与生精功能正常组相比较,aP<0.05;与轻度生精不良组相比较,bP<0.05
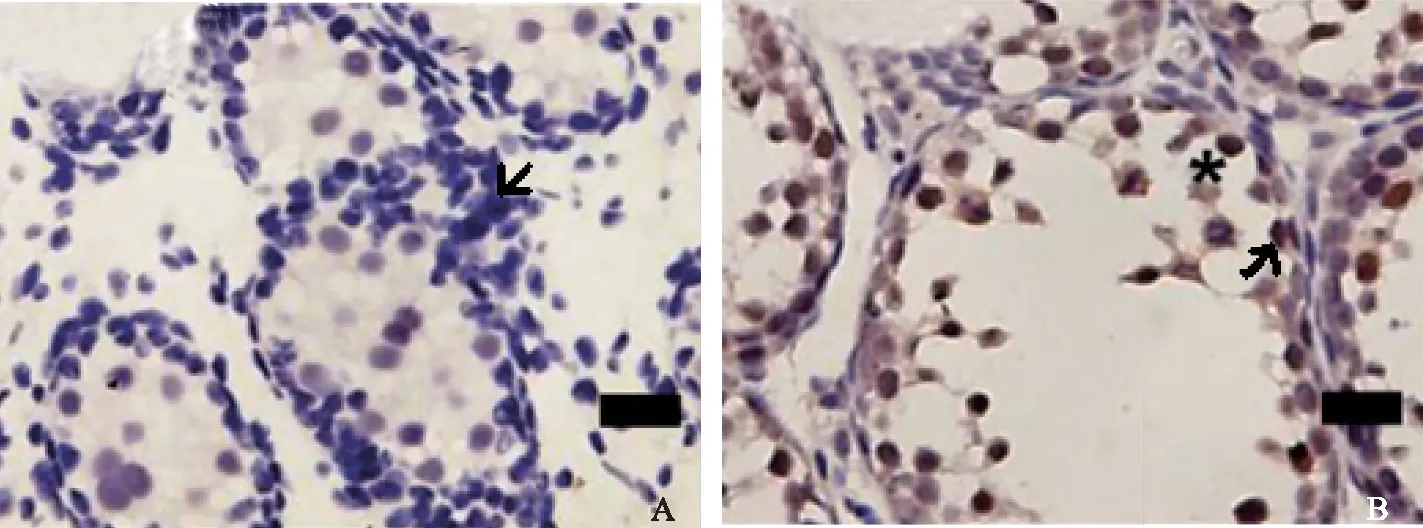
A:低表达;B:高表达;Scale bar=20 μm图1 免疫组化检测PRPS2在睾丸组织中的定位情况 ×400
二、PRPS2在GC1、GC2和TM4细胞株中的表达及定位
qRT-PCR结果显示,GC1细胞株中PRPS2表达量显著高于GC2和TM4细胞株(P<0.05)。经免疫荧光染色法检测,PRPS2主要定位于细胞核中,与睾丸组织免疫组织化学结果基本一致(图2,图3)。
三、PRPS2对生精细胞凋亡的影响
经流式细胞术检测,GC1细胞、GC2细胞和TM4细胞shPRPS2基因沉默后,与空白对照组(NC组)比较,细胞凋亡率显著增加(P<0.05)。而PRPS2基因表达上调后,GC1细胞、GC2细胞和TM4细胞凋亡率较空白对照组和shPRPS2组显著降低(P<0.05)(图4)。

与GC1细胞比较,aP<0.05图2 qRT-PCR法检测PRPS2在GC1、GC2和TM4细胞株中的表达情况
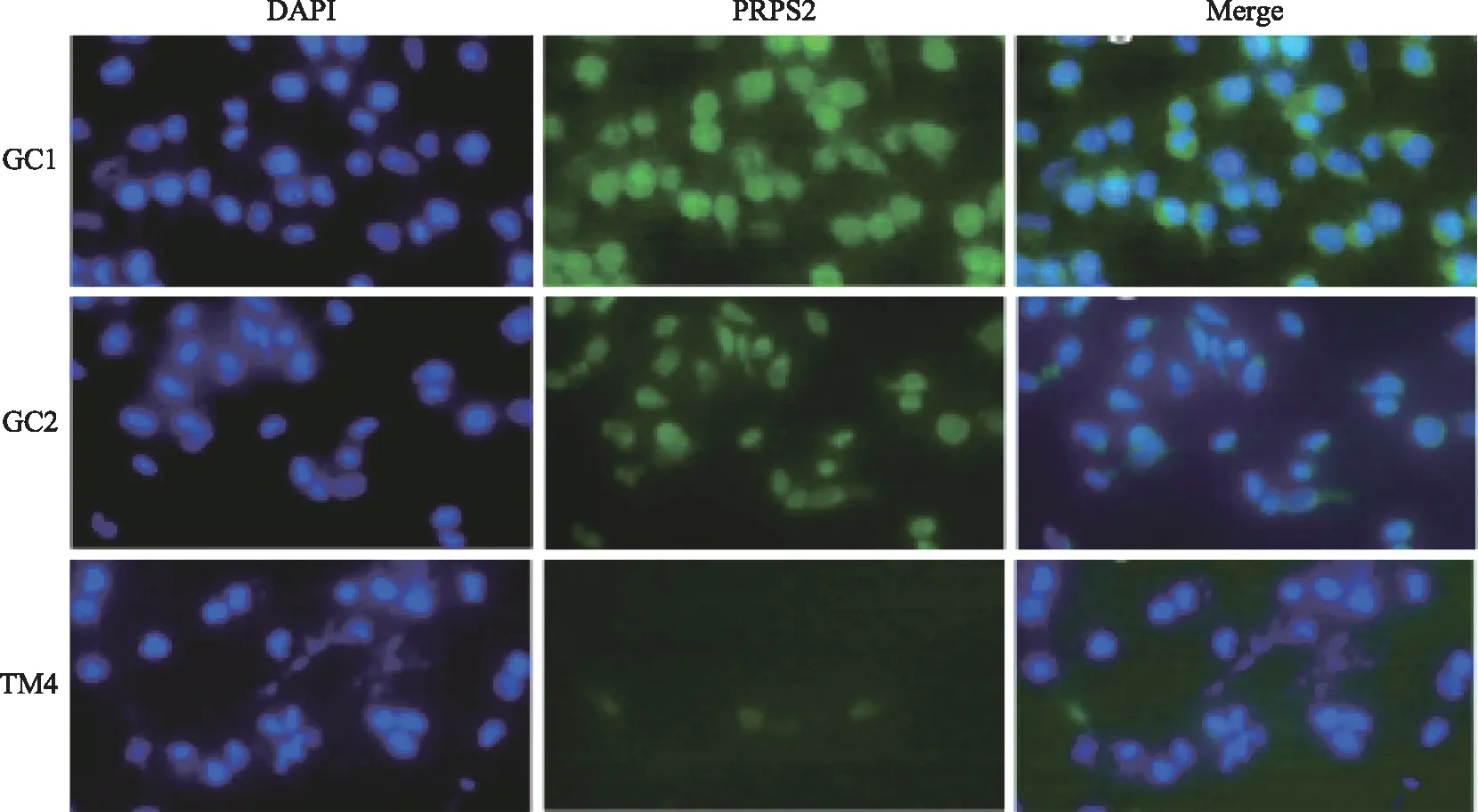
蓝色为DAPI染色,绿色为PRPS2阳性信号图3 免疫荧光染色法检测PRPS2在GC1、GC2和TM4细胞株中的定位情况 ×400
四、PRPS2对生精细胞增殖的影响
经MTT法检测,GC1细胞、GC2细胞和TM4细胞shPRPS2基因沉默后,与空白对照组(NC组)比较,细胞增殖活性显著增加(P<0.05)。而PRPS2基因表达上调后,GC1细胞、GC2细胞和TM4细胞凋亡率较空白对照组和shPRPS2细胞组显著降低(P<0.05)(图5)。
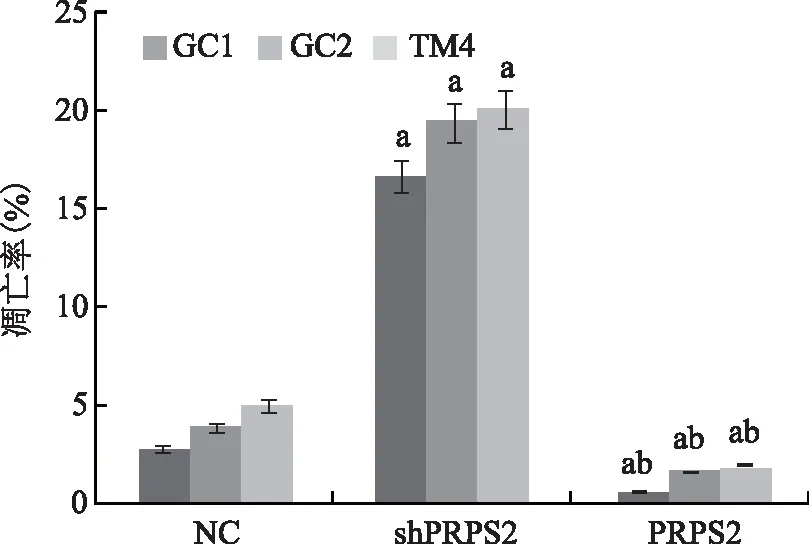
与NC组比较,aP<0.05;与转染shPRPS2组比较,bP<0.05图4 流式细胞术检测PRPS2对GC1细胞、GC2细胞和TM4细胞凋亡的影响
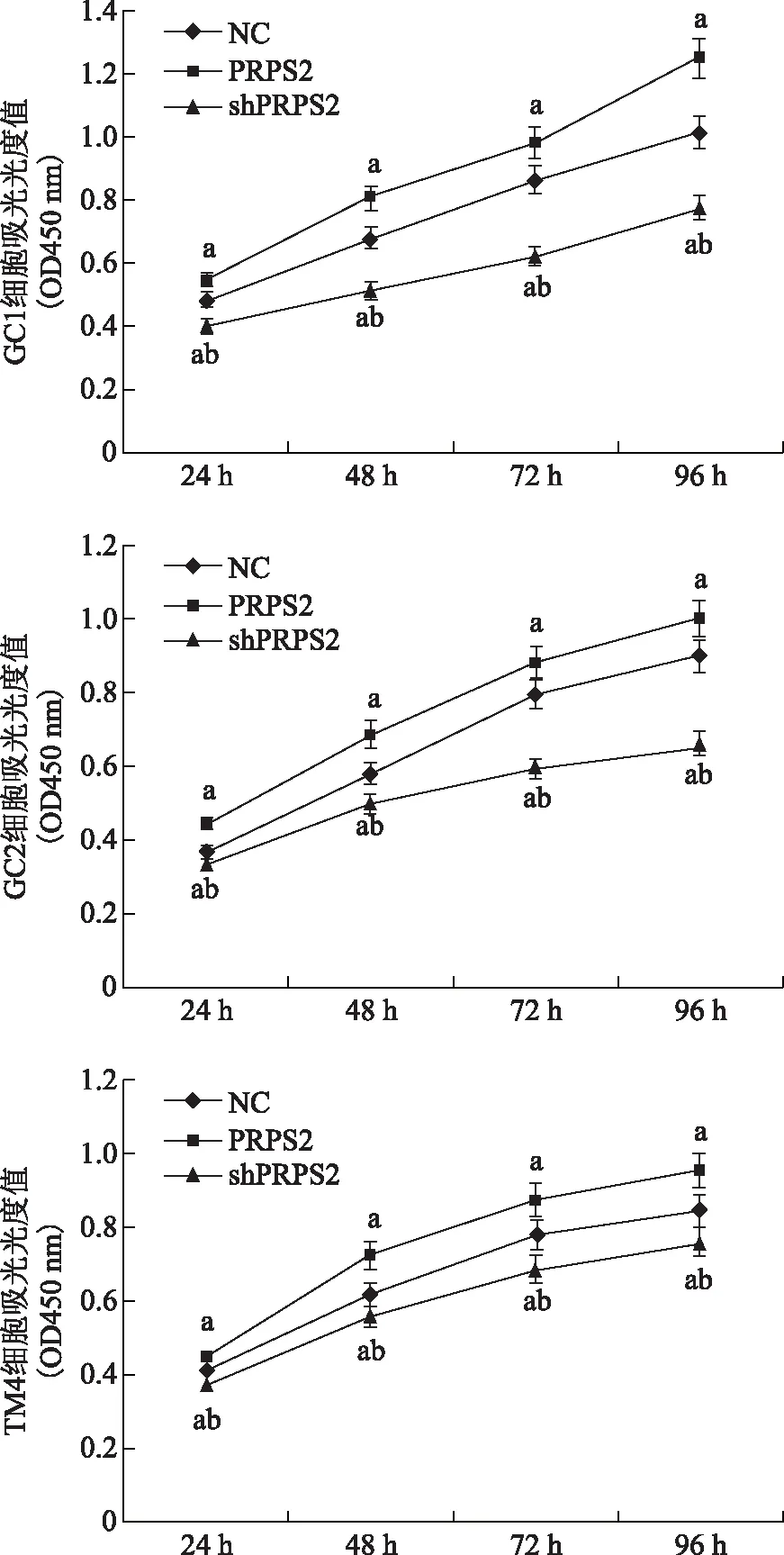
与NC组比较,aP<0.05;与转染shPRPS2组比较,bP<0.05图5 MTT法检测PRPS2对GC1细胞、GC2细胞和TM4细胞增殖的影响
五、PRPS2对下游靶基因E2F1的调控
通过qRT-PCR法和Western blot法证实,GC1细胞、GC2细胞和TM4细胞shPRPS2基因沉默后,与空白对照组(NC组)比较,E2F1 mRNA和蛋白相对表达量显著降低(P<0.05)。而PRPS2基因表达上调后,GC1细胞、GC2细胞和TM4细胞E2F1 mRNA和蛋白相对表达量较空白对照组和shPRPS2细胞组显著上调(P<0.05)(图6)。
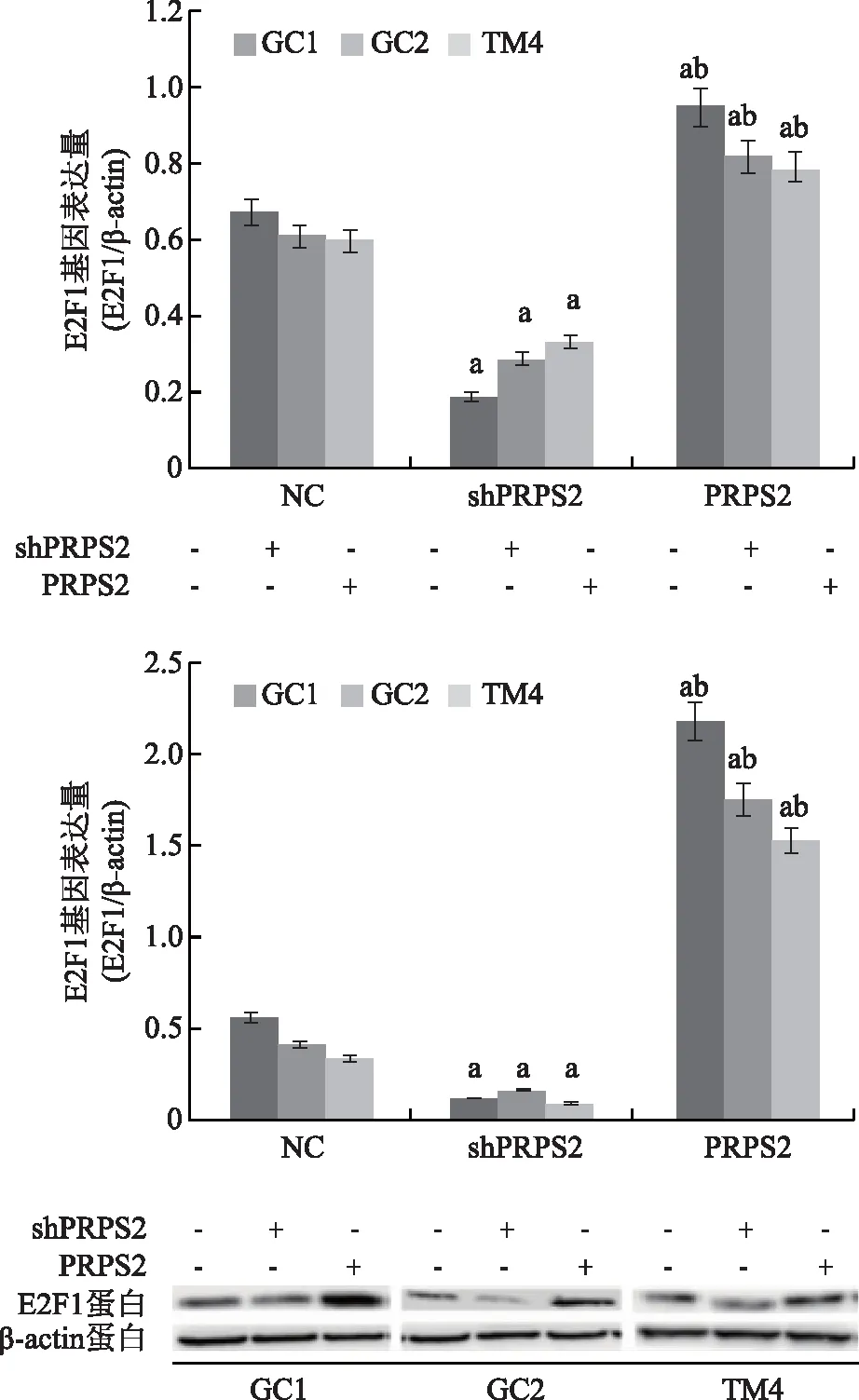
与NC组比较,aP<0.05;与转染shPRPS2组比较,bP<0.05图6 qRT-PCR方法和Western blot方法检测GC1、GC2和TM4细胞中E2F1的表达
讨 论
男性不育一直是生殖医学领域最棘手的难题之一,并且近几年出现逐渐上升趋势。男性不育的发生原因复杂且多样化,包括遗传因素、内分泌因素、环境因素、精索静脉曲张、生精管道阻塞等,但是无论何种因素,最终都会导致精子数量或活力下降。精子的生成极其复杂,涉及多阶段、多基因、多通路的共同参与。目前对于无精子症和重度少精子症患者,临床一般通过睾丸取精的方式获取精子,并注射至卵泡浆中进行受精[6]。近几年,随着生殖医学技术的深入发展,睾丸取精的成功率已经大大提高,尤其是对于梗阻性无精子症患者,受精成功率可达70%以上;但是对于非梗阻性无精子症患者,目前临床治疗一直不理想,通过睾丸取精进行受精的成功率尚不到30%[3],因此,寻找精子生成的相关基因和通路是生殖医学领域长期探讨的难题和热点。迄今为止,国内外关于睾丸组织蛋白组学和基因组学的研究较少[7],而且发现的大部分基因都是针对正常精子的生成过程[8],与男性不育密切相关的基因和蛋白并不多见。在前期研究中,我们通过高通量基因芯片技术筛选了与生精功能障碍密切相关的基因,其中生精功能严重障碍者精原细胞中PRPS2基因的表达量明显降低,本研究试图通过本项研究探讨PRPS2与精子发生的关系。
PRPS2是近几年重新关注的具有焦磷酸合酶活性的多糖基化蛋白,属于PRPP家族成员之一,通过调控嘌呤和嘧啶核苷的代谢,参与X染色体的失活[9]。本研究首先通过免疫组化方式显示PRPS2与睾丸生精功能的关系,结果表明,在生精功能障碍者的睾丸组织中,PRPS2高表达率明显低于生精功能正常者(P<0.05),并且主要定位于精原细胞、精母细胞、支持细胞的细胞核和细胞质中,而在精子细胞核成熟精子中并未见明显的PRPS2阳性表达。提示PRPS2可能参与正常精子的生成过程,并且与睾丸生精功能障碍严重程度可能呈负相关性。虽然初步研究得到了较为理想的结论,但是究竟是因为PRPS2基因表达下调导致精子生成障碍,还是其他因素引起睾丸生精功能不良导致PRPS2蛋白分泌量降低,目前尚未见直接的证据支持,尚需进一步从细胞学角度探讨PRPS2与精子生成的关系。
目前,大量研究证实,睾丸生精功能障碍与精原细胞、精母细胞和支持细胞的凋亡、增殖失衡有关[10]。正常男性精液中,精子凋亡率极低,生理条件下精子的凋亡只是消除过量或异常的生精细胞,以维持精子数量和活力在正常范围[8]。而在不育男性精液中,精子数量明显降低,甚至在高倍镜下观察不到精子的存在[11],因此笔者探讨PRPS2与睾丸生精功能的关系,首先从影响生精细胞增殖和凋亡着手,进一步分析PRPS2基因的生物学功能。结果显示,PRPS2基因敲除后,精原细胞、精母细胞和支持细胞凋亡率均明显增加,增殖活性受到明显抑制,而PRPS2基因过表达后,生精细胞的凋亡和增殖活性恰好相反,从而证实PRPS参与调控生精细胞的增殖和凋亡过程。另外,由于目前国内外关于PRPS2研究尚少,仅有的一些研究也只是停留在对嘌呤及嘧啶核苷酸代谢的影响方面[12],尚未见关于下游调控通路或蛋白的研究。既往,国外有研究显示,E2F1与精子生成密切相关[5]。而且雷斌等[13]通过高通量基因芯片筛选技术,认为E2F1可能是PRPS2下游靶基因。因此本研究通过qRT-PCR法和Western blot法初步证实了PRPS2对E2F1的调控影响,结果显示,GC1细胞、GC2细胞和TM4细胞shPRPS2基因沉默后,E2F1 mRNA和蛋白相对表达量明显降低,而PRPS2基因表达上调后,生精细胞E2F1 mRNA和蛋白相对表达量明显上调,提示PRPS2在转录水平可以直接调控E2F1的表达,进而影响生精细胞的凋亡及增殖。既往国外有研究已经证实E2F1基因缺失与睾丸生精功能障碍密切相关,通过影响生精细胞周期的正常进行,导致精原细胞增殖活性受到抑制,进而影响各级精子细胞的数量,最终导致无精子症或少精症[14]。
综上所述,睾丸组织PRPS2蛋白表达与小鼠精原细胞株GC1、小鼠精母细胞株GC2、小鼠支持细胞株TM4的凋亡和增殖有关,可能通过调控下游E2F1转录因子的表达,抑制生精细胞的增殖,促使其凋亡,最终导致无精子症或重度少精症的发生。但是由于实际临床中,睾丸组织样本获取难度较大,加上PRPS2生物学机制研究过于简单,但是无论如何,本项研究仍然为男子非阻塞性无精子症的诊断以及发病机制的探索提供了新的方向和理论基础。
