三种移植策略在反复种植失败患者冻融胚胎移植周期中的应用比较
2019-04-19金琪骆丽华黄玲莉吴莉王昊昱童先宏刘雨生
金琪,骆丽华,黄玲莉,吴莉,王昊昱,童先宏,刘雨生
(中国科学技术大学附属第一医院(安徽省立医院),合肥 230001)
在体外受精-胚胎移植中反复种植失败(RIF)的发生率达10%~15%[1]。造成RIF的原因中1/3是胚胎质量,2/3是子宫内膜容受性不良[2]。基于此,从筛选优质胚胎、改善内膜容受性以及促进子宫内膜与胚胎间相互作用这三个方面入手,寻求与之对应的移植策略可能会给RIF患者带来益处。囊胚移植可以挑选出更有发育潜能的胚胎,提高胚胎种植率及临床妊娠率,因此广泛应用于RIF[3]。越来越多的研究者将序贯移植和内膜机械性刺激应用于临床,试图从改善内膜容受性、促进胚胎发育及种植来提高RIF患者妊娠成功率。临床研究发现,与传统的移植方法相比,序贯移植和内膜机械刺激均可以明显提高RIF患者成功率[4-5]。但是这三种方法的优劣及临床如何决策,目前尚缺乏文献评价。本研究将临床上常用的三种移植策略应用于RIF患者冻融胚胎移植周期中,并对临床结果进行比较,旨在为临床选择RIF的干预策略提供参考。
资料与方法
一、研究对象及分组
回顾分析2016年6月至2017年12月在我院实施冻融胚胎移植的228例(228个周期)RIF患者的妊娠结局。
1.纳入标准:(1)RIF诊断标准:40岁以下女性在至少3个新鲜或冷冻周期中移植了4个以上优质胚胎后仍未实现临床妊娠者视为RIF;(2)本次移植前宫腔镜及阴道B超检查宫腔及子宫内膜符合以下条件:子宫内膜厚度>7 mm、无明显子宫内膜炎症、宫腔内膜息肉或轻度宫腔粘连经过处理宫腔形态属于正常;(3)FSH<10 U/L,BMI<30 kg/m2;(4)有冷冻的第3天卵裂期和/或第 5 天囊胚期的胚胎,本次移植胚胎中至少有1枚优质胚胎。
2.排除标准:(1)夫妇任何一方染色体异常;(2)合并内科疾病如糖尿病、甲状腺功能异常及自身免疫系统疾病;(3)中、重度宫腔粘连及子宫畸形;(4)血液高凝状态;(5)子宫腺肌病;(6)输卵管积水未行输卵管近端结扎或输卵管切除;(7)男方重度少弱精子症。
3.分组:将患者分为研究组和对照组,研究组按照移植方案不同分为三组:A组(序贯移植组):移植1枚卵裂期胚胎+1枚囊胚(40例);B组(内膜机械性刺激组):根据胚胎移植时间及数量的不同分为两个亚组,B1组:子宫内膜机械性刺激+1枚囊胚移植(52例);B2组:内膜机械性刺激+2枚卵裂期胚胎移植(47例);C组(囊胚移植组):移植1枚囊胚(40例)。对照组为移植2枚卵裂期胚胎(49例)。
二、研究方法
1.移植方案:内膜机械刺激方案:移植当月月经第3~5天采用小号刮匙轻柔搔扒宫腔一周,内膜条件适宜时移植卵裂期胚胎或囊胚;序贯移植方案:不进行内膜机械刺激,仅在同一个周期先移植卵裂期胚胎1枚,两天后再移植囊胚1枚;囊胚移植方案:移植1枚囊胚。
2.冻融胚胎移植(FET)的内膜准备:激素替代周期:月经第3天开始口服戊酸雌二醇(补佳乐,广州先灵药业)3 mg bid,10 d后B超监测子宫内膜厚度,酌情调整药物剂量。当子宫内膜厚度>8 mm时加用黄体酮(黄体酮注射液,浙江仙琚)40 mg qd+地屈孕酮(达芙通,雅培,荷兰)10 mg bid转化内膜。黄体酮转化内膜第4天行卵裂期冻胚移植,第6天行囊胚移植。促排卵周期:适用于激素替代周期子宫内膜生长不佳的患者。具体促排方案:月经第3天开始来曲唑(芙瑞,江苏恒瑞医药)2.5~5 mg/d,或他莫昔芬(三苯氧胺,扬子江药业)20 mg/d,5 d后B超监测内膜厚度及卵泡大小,酌情添加HMG 37.5~75 U/d。当卵泡直径>16 mm,根据血LH、E2和P水平适时予 HCG 6 000~8 000 U诱导排卵,HCG诱导后第5天行解冻卵裂期胚胎移植,第7天行解冻囊胚移植。HCG诱导后第2天予以黄体酮(黄体酮注射液,浙江仙琚)40 mg qd+地屈孕酮(达芙通,雅培,荷兰)10 mg bid转化内膜。
3.胚胎质量评估标准
(1)卵裂期胚胎评分标准:根据胚胎卵裂球大小、形态、数目、胞质及碎片将胚胎分为4级,Ⅰ级:胚胎卵裂球等大,形态规则,胞质均匀清晰,碎片无或<10%;Ⅱ级:胚胎卵裂球大小不等,形态欠规则,碎片在10.0%~25.0%;Ⅲ级:胚胎卵裂球大小不均,碎片在25.1%~50.0%;Ⅳ级:胚胎卵裂球大小不均,碎片>50.0%。Ⅰ、Ⅱ级胚胎为优质胚胎。
(2)囊胚评分标准:根据Gardner[6]提出的评价方法对第5天囊胚期胚胎根据囊胚腔的大小和是否孵化,将囊胚的发育分为6个时期。1期:早期有腔室囊胚,囊胚腔小于胚胎总体积的1/2;2期:囊胚腔体积大于或等于胚胎总体积的1/2;3期:完全扩张囊胚,囊胚腔完全占据了胚胎的总体积;4期:扩张囊胚,囊胚腔完全充满胚胎,胚胎总体积变大,透明带变薄;5期:正在孵出的囊胚,囊胚的一部分从透明带中逸出;6期:孵出的囊胚,囊胚全部从透明带中逸出。
(3)处于3至6期的囊胚,还需对其内细胞团和滋养层细胞进行质量分级。内细胞团分级:A级,细胞数目多,排列紧密;B级,细胞数目少,排列松散;C级,细胞数目很少。滋养层细胞分级:A级,上皮细胞层由较多的细胞组成,结构致密;B级,上皮细胞层由不多的细胞组成,结构松散;C级,上皮细胞层由稀疏的细胞组成。其中,评分在3BB以上为优质囊胚。
三、妊娠结局判断及观察指标
移植后14 d检测血清β-HCG水平,β-HCG阳性者于移植后30 d行阴道B超检查,见孕囊者判定为临床妊娠。
观察指标:临床妊娠率=B超见孕囊例数/总例数×100%,种植率=孕囊总数/总移植胚胎数×100%,早期流产率=流产例数/见孕囊例数×100%,多胎率=多胎例数/见孕囊例数×100%,异位妊娠率=异位妊娠例数/见孕囊例数×100%。
四、统计学分析
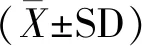
结 果
一、患者一般资料比较
三组患者年龄、不孕年限、体重指数及基础FSH均无统计学差异(P>0.05)(表1)。
二、临床结局比较
A组临床妊娠率、种植率显著高于对照组(P均<0.05);B1组种植率显著高于对照组(P<0.05)。多胎率、早期流产率、异位妊娠率各组间无统计学差异(P>0.05)(表2)。
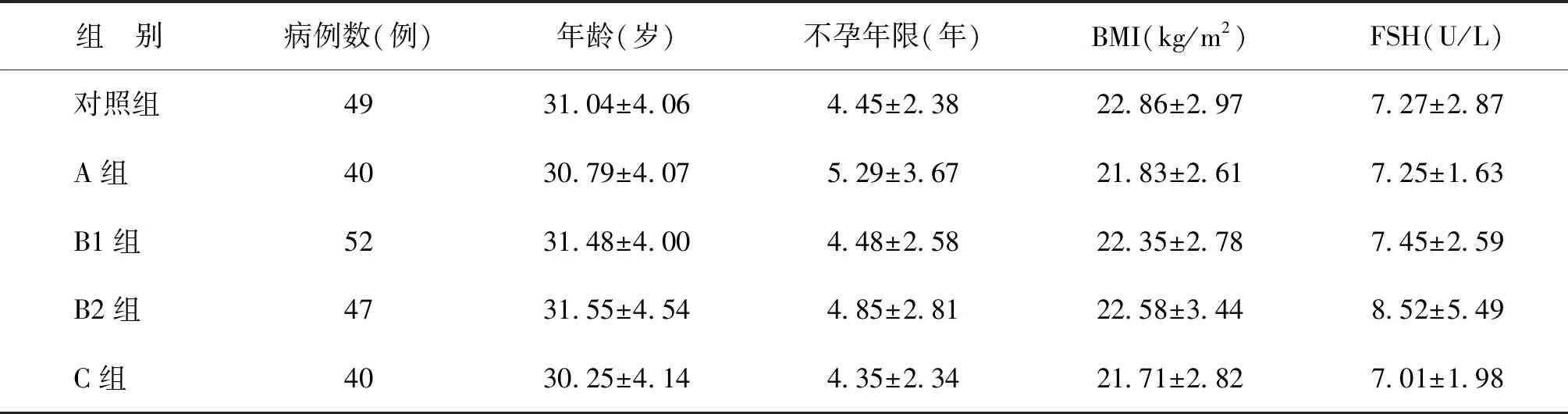
表1 各组基本资料
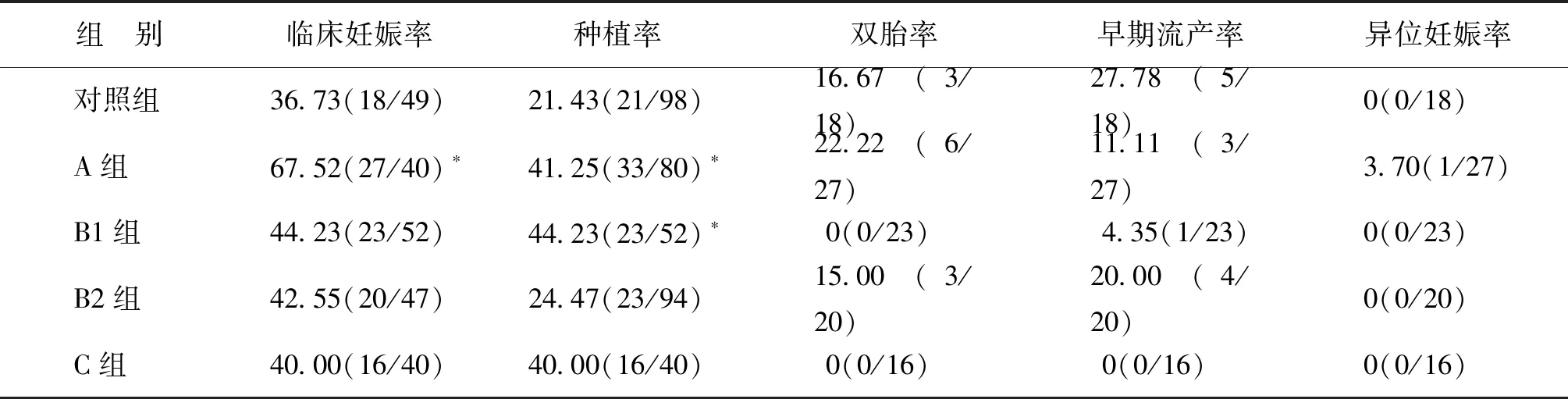
表2 各组临床结局比较 [%(n)]
注:与对照组比较,*P<0.05
讨 论
体外受精-胚胎移植的成功与胚胎发育潜能及子宫内膜容受性密切相关。子宫内膜容受性的建立,子宫内膜与胚胎之间相互作用并达到精确的同步化是胚胎成功植入的关键。子宫内膜容受性的建立主要受到雌、孕激素的调节。子宫内膜局部产生的多种促炎因子、抑炎因子及信号分子,如前列腺素、生长因子、细胞因子、趋化因子、整合素、白血病抑制因子、雌激素和孕激素受体等也参与调节雌、孕激素的功能,使子宫内膜达到良好的容受状态,为胚胎的生存、植入、分化提供一个适宜的微环境。胚胎在植入时需要足够的趋化因子和炎症细胞因子在母胎界面调节胚胎的侵入能力,保证胚胎成功着床[7-8]。另一方面,早期胚胎源性生长因子、细胞因子及信号分子可能对改善子宫内膜容受性、促进胚泡着床并维持妊娠有重要的作用。
Eyheremendy等[9]发现早期胚胎可以诱使内膜进入“ 种植窗 ” 状态,可能与胚胎能分泌一些生长因子有关,如IL-1、转化生长因子、表皮生长因子、粒细胞巨噬细胞刺激因子等,在促进胚胎发育的同时诱导子宫内膜容受性增加。Melnick等[10]比较了子宫内膜与胚胎共培养和单独培养的胚胎卵裂率和囊胚形成率,发现共培养组胚胎的生长情况和囊胚形成率明显优于单独培养组。Binder 等[11]发现,在体外子宫内膜与胚胎共培养可以改善子宫内膜容受性,有利于胚胎生长及着床。以上研究结论说明子宫内膜与胚胎之间的作用是互利的。体外受精与自然受孕不同之处在于胚胎要在体外培养3~5 d,子宫内膜缺乏胚源性因子的刺激,内膜容受性可能受到影响,特别是对某些本身内膜容受性不良的患者影响更大。子宫内膜容受性低下也会影响胚胎发育及胚胎与子宫内膜的同步化,从而降低胚胎成功植入的几率。研究发现,有30%不孕症患者存在子宫内膜种植窗改变,表现为种植窗提前、推后或缩短[12]。临床上部分患者RIF的原因可能是整倍体囊胚与植入窗口未同步化[13]。
囊胚移植作为临床上RIF患者移植策略之一已达成广泛共识,其与卵裂期胚胎相比有较大优势。国内外研究发现:囊胚移植的临床妊娠率和胚胎种植率明显高于卵裂期胚胎移植[3],早期流产率有降低的趋势[14],单囊胚移植是降低多胎妊娠风险的有效方法[14]。本研究发现,与卵裂期胚胎相比,单囊胚移植组临床妊娠率、种植率均有升高的趋势,而多胎率、早期流产率有降低的趋势,但差异均没有统计学意义(P>0.05)。
对于具有形态学“正常”的内膜及胚胎的RIF患者除了胚胎因素外,更多的原因可能在于子宫内膜微环境的不良,因此从改善子宫内膜容受性方面寻找对策成为临床治疗反复种植失败的重要突破点。临床发现,内膜机械性刺激可改善RIF患者的妊娠结局[15-17]。子宫内膜机械刺激作用的机制有以下三方面:(1)子宫内膜损伤可以促进子宫内膜干细胞生长及子宫内膜螺旋动脉生成,增加子宫内膜血流,促进子宫内膜腺体的发育并使基质细胞水肿和蜕膜化从而增加胚胎植入的可能性[18-19];(2)内膜机械性刺激引发内膜炎症反应,可以提高子宫内膜局部促炎因子的表达[20],而早期胚胎种植在着床部位需要促炎因子的作用,使胚胎易于粘附在子宫内膜上,并促进滋养层细胞对子宫内膜的侵入;(3)基因调控方面,有研究发现在RIF患者中子宫内膜miRNA表达异常,包括miR-145,miR-23b和miR-99a的过度表达以及3种miRNAs的低表达[21]。子宫内膜损伤可能调控子宫内膜基因的miRNA表达,从而利于胚胎植入[22]。子宫内膜机械刺激的主要优势在于改善子宫内膜容受性,本研究中内膜机械刺激组的不足之处有:(1)选择囊胚移植,由于胚胎移植过晚,子宫内膜缺乏早期胚胎产生的胚源性生长因子、细胞因子及信号分子的调节作用,对某些内膜容受性不良的患者可能是无益的;囊胚体外培养存在培养失败导致无胚胎移植的风险。(2)选择卵裂期胚胎移植,缺乏了通过囊胚移植来挑选胚胎的优势。
近年来研究发现:在RIF患者新鲜移植周期中,序贯移植组临床妊娠率明显高于卵裂期胚胎移植组[4];在RIF患者冻融胚胎移植周期中,序贯移植组的临床妊娠率和胚胎种植率均高于单纯囊胚移植组;在非RIF患者IVF/ICSI 新鲜周期中发现序贯移植组的胚胎种植率、临床妊娠率及活产率均高于卵裂期胚胎移植组,而流产率低于卵裂期胚胎移植组[10]。序贯移植的优势:(1)第一次移入宫腔的胚胎产生的胚源性因子有助于创造最佳的内膜容受性状态,促进胚胎的发育及种植,这是内膜机械性刺激无法完全替代的;(2)囊胚移植的优势是可以挑选更有发育潜能的胚胎,囊胚与子宫内膜同步性更好,有助于提高胚胎种植率。我们的临床研究初步显示,序贯移植组(A组)与内膜机械刺激组(B1、B2)相比,临床妊娠率有升高的趋势,但差异没有统计学意义(P>0.05);(3)序贯移植可以减少因囊胚培养失败无胚胎移植的风险,增加患者周期妊娠机会。Yazbeck等[23]研究显示,42%的患者在D5/D6未获得高质量囊胚,仅在D2/D3行单卵裂期胚胎移植,妊娠率为25.3%。本研究中拟序贯移植的患者中有12例囊胚培养失败,仅行单卵裂期冻融胚胎移植,其临床妊娠率为16.67%(2/12)。序贯移植的不足之处:(1)本研究结果显示,序贯移植组较其他各组相比,多胎率有升高的趋势,但差异无统计学意义(P>0.05)。Machtinger等[4]研究显示,序贯移植多胎率达到50%,与该研究移植胚胎数目过多有关(研究组移植1~2枚卵裂期胚胎+1~2枚囊胚)。我们的体会是实施序贯移植一定要严格控制移植胚胎的数目;对于子宫畸形或瘢痕子宫等特殊人群应慎重选择序贯移植。(2)序贯移植也存在囊胚培养失败的风险,应慎重选择。
综上所述,我们认为RIF患者再次移植需要采取更加积极的策略,需要综合每一种方法的作用机制及患者的具体情况进行决策。总体来说:选择序贯移植、内膜机械性刺激+囊胚移植及囊胚移植三种移植策略均有改善妊娠结局的趋势,三者中序贯移植与传统卵裂期胚胎移植相比,可显著提高临床妊娠率及种植率。另外,其可以降低因囊胚培养失败无胚胎移植的风险,但同时可能增加多胎妊娠的风险。临床应根据患者的具体情况及各种方法的利弊选择个体化移植策略,如薄型内膜采用内膜机械性刺激可以改善患者的子宫内膜容受性从而有助于改善妊娠结局;对于RIF中的特殊人群(如子宫畸形或瘢痕子宫、低反应、宫腔粘连分离术后患者等),由于序贯移植有可能增加多胎妊娠的风险,遂要慎重选择,可以选择有效性及安全性两方面均有兼顾的内膜机械刺激法结合单囊胚移植方案。
