Ni-Mo-C合金的电沉积行为及成核机制
2019-04-17齐海东温林洁李运刚杨海丽
齐海东,郭 昭,卢 帅,温林洁,李运刚,杨海丽
(华北理工大学冶金与能源学院 现代冶金技术教育部重点实验室,河北唐山 063210)
Ni-Mo合金因具有良好的析氢催化性能被广泛用作水电解阴极材料[1-3],但由于Mo存在溶出效应,使合金的电解稳定性较差,从而限制了其应用范围[4-5]。C元素可增大Ni基合金的稳定性并可进一步提高合金的析氢性能[6-8]。采用电沉积法可制备Ni-Mo-C合金电极材料[9],但目前有关Ni-Mo-C合金的电沉积行为及成核机制研究还未见有报道。试验采用循环伏安曲线、阴极极化曲线、旋转圆盘电极、电化学阻抗谱、计时电流法研究了Ni-Mo-C合金的电沉积行为及成核机制。
1 试验部分
1.1 电解液组成
单金属Ni电解液组成:0.50 mol/L NiSO4+0.60 mol/L柠檬酸铵;
Ni-Mo合金电解液组成:0.50 mol/L NiSO4+0.05 mol/L Na2MoO4+0.60 mol/L柠檬酸铵;
Ni-C合金电解液组成:0.50 mol/L NiSO4+8.8 g/L抗坏血酸+0.60 mol/L柠檬酸铵;
Ni-Mo-C合金电解液组成:0.50 mol/L NiSO4+0.05 mol/L Na2MoO4+8.80 g/L抗坏血酸+0.60 mol/L柠檬酸铵。
用质量分数为15%的稀硫酸和NaOH溶液调节上述3种电解液pH为3.0。
1.2 测试方法
用电化学工作站(德国ZAHNER公司,IM6eX型)研究Ni-Mo-C合金的沉积行为和成核机制。选用三电极体系:工作电极为玻碳旋转圆盘电极(美国BASi公司,RDE-2型,电极面积约7.07 mm2,转速1~10 000 r/min可调),参比电极为Ag/AgCl电极,对电极为铂丝电极。
循环伏安扫描速度为20、40、60、80、100 mV/s,扫描范围在0.3~-1.4 V之间;阴极极化曲线扫描速度为5 mV/s,扫描范围为-0.4~-1.5 V;旋转圆盘电极转速为100、400、1 600、3 600 r/min;电化学阻抗谱扰动信号振幅5 mV,频率范围0.1~100 kHz。
2 试验结果与讨论
2.1 循环伏安曲线分析
图1为Ni、Ni-Mo、Ni-C、Ni-Mo-C金属或合金沉积的循环伏安曲线,扫描速度60 mV/s,图2为不同扫描速度下的Ni-Mo-C合金的循环伏安曲线。

图1 Ni、Ni-Mo、Ni-C、Ni-Mo-C金属或合金电沉积循环伏安曲线

图2 不同扫描速率下,Ni-Mo-C合金沉积的循环伏安曲线和φp,c-lnv关系
图1(a)中:电位负向扫描至-0.6 V时,出现Ni的还原峰,此时玻碳电极表面出现银白色Ni;电位正向扫描时,在-0.2 V处出现Ni溶解对应氧化峰。
图1(b)中:电位负向扫描时,并没有出现明显还原峰,而在-0.7 V左右电流迅速增大,此时玻碳电极表面出现灰白色沉积层并伴有析氢反应发生,原因是Ni-Mo具有优异的析氢性能,大量氢气会伴随Ni-Mo合金在玻碳电极表面沉积,使电流迅速升高[10];电位正向扫描至-0.6 V时出现Ni-Mo合金溶解氧化峰。
图1(c)中:电位负向扫描至-1.1 V处时,电流迅速变大,玻碳电极表面出现具有金属光泽的浅棕色沉积层并伴有氢气产生,说明Ni-C合金具有良好的析氢性能;同时曲线上出现由阴、阳极电流交错形成的电流环,说明Ni-C合金的电沉积存在成核行为[11];电位正向扫描时,出现2个氧化峰,与图1(a)对比可知,图1(c)中-0.3 V为Ni的氧化峰电位,但负移了100 mV,电位继续正移,在0.1 V处出现C氧化峰。
图1(d)中:电位负移至-1.1 V处时,电流迅速变大,玻碳电极表面出现Ni-C沉积层特征;电位继续负向扫描至-1.2 V左右,电极反应速率改变,说明有新反应发生,此时玻碳电极表面出现暗灰色沉积层,发生Ni-Mo-C合金沉积;且循环伏安曲线上也出现电流环,说明Ni-Mo-C合金的沉积也存在成核行为;电位正向扫描时,出现3个氧化峰,与图1(a)~(c)对比可知,-0.42 V处的氧化峰对应Mo的溶解反应,-0.2 V处的氧化峰对应Ni的溶解反应,0.1 V处的氧化峰对应C的氧化反应。
由图2看出:随扫描速率提高,Ni-Mo-C合金还原峰电位负移,Ni、Mo、C对应的氧化峰正移。图2(d)是还原峰峰电位(φp,c)与扫描速率的对数(lnv)关系曲线,可以看出:峰电位与扫描速率呈良好的线性关系,说明Ni-Mo-C合金的沉积反应为不可逆过程[12]。
2.2 旋转圆盘电极分析
图3为不同圆盘转速条件下Ni-Mo-C合金沉积的阴极极化曲线。
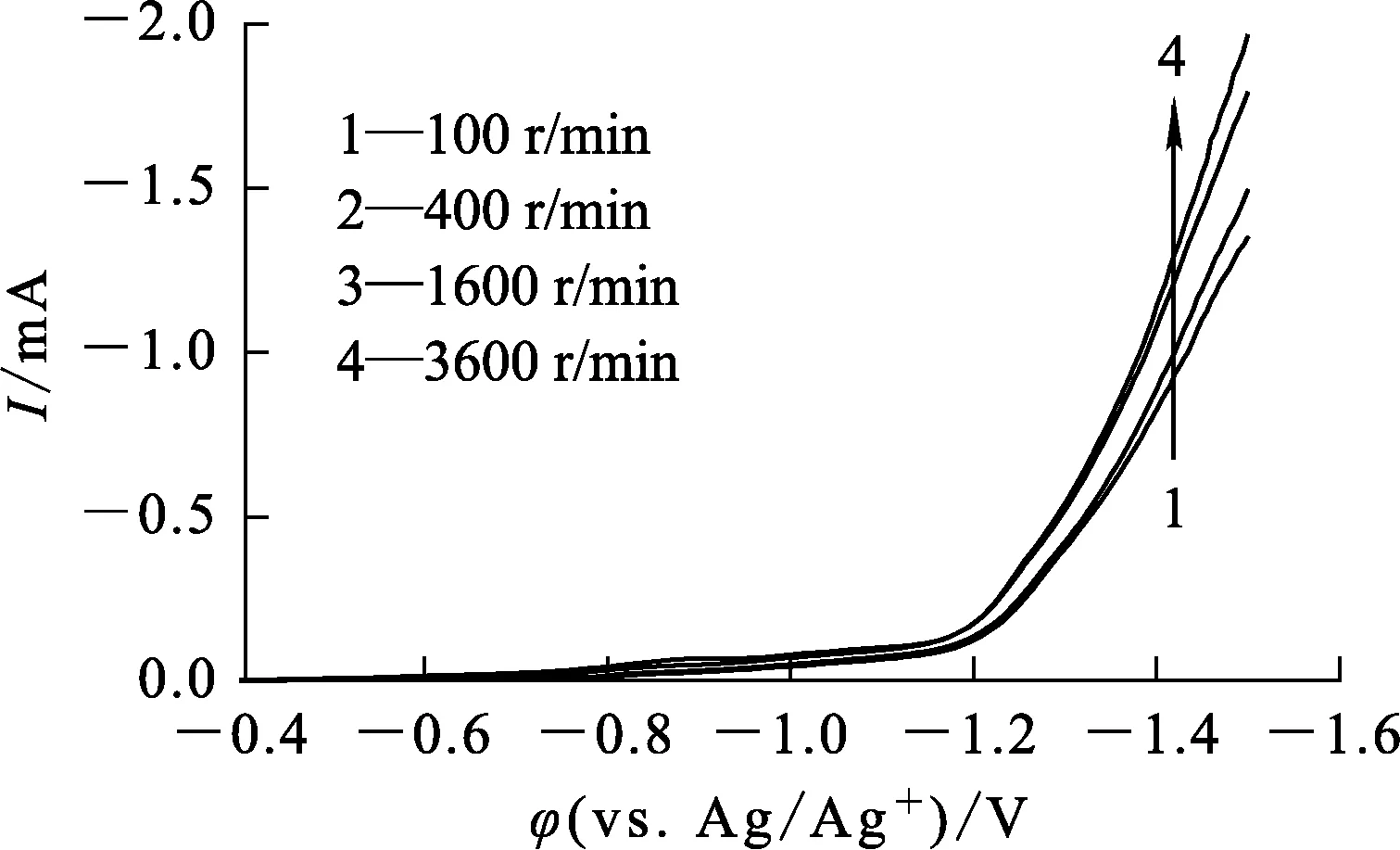
图3 不同圆盘转速下Ni-Mo-C合金沉积的阴极极化曲线
由图3看出,在沉积电位达-1.2 V之后,随转速增大,沉积电流变大。这是因为转速增大可减薄扩散层,使金属离子更易到达电极表面放电,从而使电极反应速率加快[13]。
若电化学反应完全由扩散传质过程控制,则满足Levich方程[14]:
(1)
式中:jl为反应的极限扩散电流密度,mA/cm2;n为反应转移的电子数;F为法拉第常数,96.485 C/mol;D为扩散系数,m2/s;υ为溶液黏度系数,m2/s;ω为旋转圆盘电极转速,r/min;c0为溶液本体浓度,mol/L。
根据公式(1),对于不可逆反应,在扩散和动力学混合控制区,总反应电流(I)应满足Koutecky-Levich关系[15]:
(2)
(3)
式中:jk为对应电位下反应完全由动力学过程控制所产生的电流密度,mA/cm2;B为Levich方程斜率。
不同电位条件下,I-1-ω-1/2的关系曲线如图4(a)所示。可以看出,不同电位下的I-1-ω-1/2呈良好的线性关系,满足公式(2)。说明电极电位为-1.3~-1.0 V时电极反应均受扩散和动力学混合控制[16]。
图4(b)是不同电位条件下的I-ω1/2关系曲线。可以看出,随电极电位增大,沉积电流受圆盘转速的影响增大。说明Ni-Mo-C合金的沉积受扩散控制程度增大[17]。

图4 不同电极电位条件下,及的关系曲线
2.3 电化学阻抗谱分析
图5为不同电极电位条件下Ni-Mo-C合金的电化学阻抗谱。
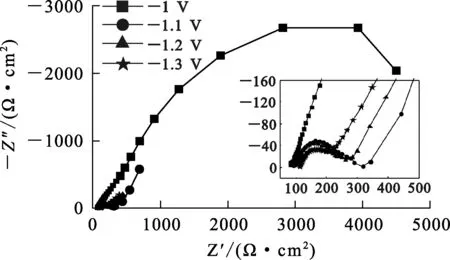
图5 不同电极电位条件下Ni-Mo-C合金沉积的电化学阻抗谱
由图5看出:不同电极电位下的电化学阻抗谱的形式大致有2种:当电极电位为-1.0 V时,阻抗谱为1个直径很大的容抗弧,通常认为高频端容抗弧是由双电层电容(Cdl)和电荷转移电阻(Rct)并联造成的[18],容抗弧直径约等于Rct,Rct值极大说明在该电极电位下沉积电流几乎为0,未发生金属还原;当电极电位为-1.1、-1.2、-1.3 V时,阻抗谱高频端同样是由Cdl和Rct并联造成的容抗弧,低频端是与复平面实轴成45°夹角的直线,这样的直线具有典型的Warburg扩散电阻特征[19]。随电极电位增大,电荷转移电阻Rct逐渐减小,电极反应速率逐渐加快;Warburg扩散电阻特征向高频区移动,说明电极反应更容易呈现扩散特征,反应受扩散控制程度变大。这与旋转圆盘电极的分析结果相一致。
2.4 计时电流分析
图6(a)是不同电极电位下Ni-Mo-C合金沉积的计时电流I-t曲线。可以看出:当电极电位为-1 V时,几乎无沉积电流产生,说明此时电极电位未达金属还原电位;当电位增大到-1.1、-1.2、-1.3 V时,迅速增大的电流对应晶粒的形核和长大;之后电流减小并趋于稳定。这是因为随金属形核和长大,本体溶液中的金属阳离子不断向电极表面扩散,使浓度梯度区向本体溶液逐渐延伸变厚,扩散阻力变大,电流随之减小,直至扩散层厚度达到稳态,电流趋于定值[20]。随电极电位增大,反应达到最大沉积电流(Im)所需的时间(tm)缩短,说明成核速率逐渐加快,这是因为电极电位增大会导致阴极极化加大,形核驱动力变大,合金形核率升高。
瞬时成核(式(4))和连续成核(式(5))模型常用以解释金属或合金的三维成核机制[21]:
(4)
(5)
不同电位下,Ni-Mo-C合金的成核机制可用不同电极电位下的合金沉积(I/Im)2-t/tm无因次曲线(图6(b))可以看出,随电极电位增大,合金成核逐步由连续成核转变为瞬时成核,成核速率也因此逐渐加快。成核速率加快会使电极附近金属离子消耗速率加快,导致双电层内部金属离子不能得到及时补充,使扩散层向溶液本体延伸变厚,扩散电阻进而增大,反应受扩散控制程度加大。这与旋转圆盘电极、电化学阻抗谱分析结果相一致。

图6 不同电位下的计时电流I-t曲线和(I/Im)2-t/tm无因次曲线
3 结论
Ni-Mo-C合金的电沉积过程存在成核行为,电极反应是一个不可逆过程。随电极电位增大,电极反应速率加快,合金成核机制从连续成核转变为瞬时成核,合金的沉积受扩散控制程度加大。
