血清叶酸化学发光免疫检测技术及试剂盒的研发
2019-04-17王世杰白仲虎杨艳坤
卢 菲, 王世杰, 陈 祥, 白仲虎, 杨艳坤
(1. 江南大学 粮食发酵工艺与技术国家工程实验室, 无锡 214122; 2. 江南大学 工业生物技术教育部重点实验室, 无锡 214122; 3. 江南大学 糖化学与生物技术教育部重点实验室, 无锡 214122)
叶酸是一种B族维生素,在人脑部发育过程中起重要作用,孕初期组织快速增长,大量补充叶酸,可有效预防新生儿神经管畸形等疾病[1-2]。叶酸可以辅助体内一碳单位的转移并维持同型半胱氨酸的平衡,已有研究明确表明叶酸能够医治高同型半胱氨酸败血症,从而降低了患者脑卒中的发病率[3]。在我国实施的叶酸干预重大研究,确定了预防神经管缺陷最佳的叶酸增补剂量,为全世界制定预防出生缺陷的公共卫生政策提供了科学依据。结合当前的形势要求,我们研究出更加简易、准确且易推广的叶酸检测技术。
目前在应用中的叶酸检测方法有微生物法、相关的仪器分析法以及免疫法。微生物法耗时长不稳定,仪器分析虽灵敏准确但仪器费用昂贵,样品前处理复杂污染大且需培训专业人员操作,局限性大[4-5]。其中化学发光免疫分析法因具有化学发光的高灵敏度、线性范围大和免疫分析的灵活的选择性,逐渐成为发展趋势[6-7]。
本试剂盒的研制旨在解决这些弊端并建立一种高效精准的叶酸检测方法,所以研究出了一种生物素-亲和素(Biotin-Avidin—System,BAS)反应体系[8],以生物素-链霉亲和素包被微孔板,使生物素化的叶酸结合蛋白能够结合到微孔板上,叶酸酶标辣根过氧化物酶(FA-HRP)与待测血清中的叶酸竞争结合到结合蛋白上,检测发光信号值。因为亲和素与生物素间结合专一效率高,能提高反应的灵敏度且缩短反应时间,同时本研究创新地研制出了新的样本处理试剂和方法,使血清叶酸在液体环境中能够充分快速地释放,简化了前期样本的处理工序。在本研究中,前期我们使用的多为进口叶酸结合蛋白,因为其很难通过基因表达得到,价格昂贵,所以在完成本试剂盒时也对叶酸结合蛋白进行了牛奶中的提取、纯化方面的创新以及对其亲和力进行了验证,叶酸结合蛋白与多种癌症的发生发展密切相关,对多药和耐药性的医药研究变革有着重大指导意义[9],后期我们自主提取和纯化后,得到了较高亲和力的叶酸结合蛋白,大大缩减了成本。
1 材料与方法
1.1 材料
研究所用化学发光板购于美国Costar公司。生物素化试剂盒和FA-HRP由江苏拜明生物技术有限公司提供。上海交通大学附属仁济医院和复旦大学附属金山医院进行临床实验时随机选取了200例临床血清样本及参比试剂检测值。叶酸质控品购自美国伯乐公司,实验前期叶酸结合蛋白购于美国scripps研究所。参比试剂盒为美国Beckman(贝克曼)公司生产的叶酸测定试剂盒(化学发光法)。
1.2 仪器
厦门天中达化学发光免疫分析仪,检测仪器型号为TZD-CL-200S。洗板机购于英国Anthos公司,型号为Fluido2。平板震荡仪购于上海汉林,型号为Mix-1500。电热恒温培养箱购于上海三发。Sorvall ST16R离心机和脱盐柱购于美国Thermo Fisher公司。
1.3 方法
1.3.1 包被板的制备
制备生物素化牛血清白蛋白(BSA-Biotin):称取BSA 10 mg,用pH 7.0的1 mL磷酸缓冲液溶解;用生物化试剂盒完成生物素化后用缓冲液连续洗脱,去除游离的生物素,得到包被所用的BSA-Biotin。
包被:制备好的BSA-Biotin溶于包被液中,混匀。移液200 μL连续加入每个板孔中,37℃恒温箱孵育2 h后,用含有Tween-20的PBSY洗液洗板4次。然后将链霉亲和素用包被液溶解以同样方式加入每孔中,最后加入封闭液进行37℃恒温箱孵育,30 min后拍板吹干,密封。
1.3.2 校准品的配制
首先复溶中检验的叶酸对照品(100248—201203),得到理论浓度为2.5、5、10和25 ng/mL的系列标准浓度点,用参比试剂盒贝克曼公司的叶酸检测试剂盒(化学发光法)进行参考和赋值,然后装瓶置于4℃保存。
1.3.3 最佳辣根过氧化物酶标叶酸(FA-HRP)、生物素化叶酸结合蛋白(FBP-Biotin)工作浓度的确定
因本研究采用竞争法即当FBP-Biotin或FA-HRP一方浓度相对过高或过低时都会对校准品曲线的形态造成影响,导致曲线梯度不分明,测值不准确等,所以要确定FA-HRP和FBP-Biotin的最佳动态浓度对需要从检测校准品和质控品两方面来入手。为减小非特异性吸附和底物等系统误差对实验信号值的影响,校准品最低信号值最好保持在50 000以上,经过预实验后,选择在浓度区间FA-HRP(0.1~0.3 μg/mL)、FBP-Biotin(0.2~0.6 μg/mL)筛选最佳工作浓度,对每一组浓度对作3组平行的校准品曲线和质控的测值,取校准品信号平均值作标准曲线用实测的质控信号代入标准曲线反算质控浓度,观察校准品信号值梯度和反算质控品的准确度来选取最佳浓度对。
1.3.4 叶酸结合蛋白(FBP)的提取纯化及亲和力验证
前期FBP来源主要为国外进口,成本较高,后期FBP主要来源为牛奶中提取纯化。牛奶中有较多的FBP,且对血液中叶酸的主要活性形式具有较高的亲和力,研究改良后的牛奶中FBP提取方法为:取HCl 调节新鲜牛奶至pH 3.0,4℃放置2 h;然后用NaOH调节至pH 4.8,40℃水浴30 min,纱布过滤后取稍浑浊的上清液,用离心机5000 r/min离心2 h,用0.22 μm滤膜过滤得澄清淡黄色溶液。期间可同时制备纯化所用的FBP亲和柱:取5 mL的EAH Sepharose 4B,用一定浓度的HCl和NaOH处理后,作为填料;取叶酸3 mg溶解于碳酸氢钠溶液中,加入填料中冲洗偶联并不断用盐酸调节pH值,至填料呈明黄色;向填料加入醋酸钠和碳酸氢钠溶液调节至pH 6,反应2 h后清洗填料,蛋白纯化仪AKTA装柱然后将处理后的牛奶溶液上柱纯化,收取完成。
FBP亲和力检测方法:选择进口FBP为对照组,纯化所得FBP为实验组,二者使用相同的包被工艺,工作浓度都为0.5 μg/mL包被于同一块空白发光板上,再每孔加入相同的过量FA-HRP,比较两组的发光信号值。 两组实验于同一块发光板,相当于每组重复实验48次。
1.3.5 样本前处理方法
通过查找文献确定强碱环境才能让血清中的叶酸小分子与其结合蛋白分开,本研究选择以硼酸为缓冲体系的强碱溶液作为变性剂[10-11],二硫苏糖醇(DTT)既具有变性作用还可以抗氧化,但在碱性条件下不稳定,所以需另配制成稳定剂,处理样本前将变性剂与稳定剂以1∶20的体积比混合制成样本提取剂。由于整个酶促反应体系在接近pH中性的环境中进行[12],因此在样本处理后需要用中和剂将样本pH调回中性,所以最后每离心管加入与样品等量中和剂,样品即处理完毕,待检。
2 结果
2.1 包被工作液浓度的确定
化学发光板(SAC板)上加入不同浓度(1~10 μg/mL)BSA-Biotin的包被液后,再加入过量的辣根过氧化物酶标记的链霉亲和素(SA-HRP),检测结果见图1。表明BSA-Biotin在6 μg/mL时在SAC板上的结合量已经达到饱和。后续实验即选用6 μg/mL作为BSA-Biotin的浓度。确定此浓度后,再加入不同浓度(2~14 μg/mL)的链霉亲和素(SA)制备成不同的锚定蛋白液,用高浓度生物素作为样本检测,结果见图2。表明SA包被浓度超过12 μg/mL后检测信号强度已达到饱和,因此理论上12 μg/mL为最佳包被浓度。
2.2 校准品的赋值及校准曲线的绘制
贝克曼公司的叶酸检测试剂盒赋值本研究校准品结果见表1。以实测值为准,定义叶酸校准品1~5的浓度分别为0、2.52、4.91、10.28和25.49 ng/mL。校准曲线以校准品浓度为X轴,所测信号值(RLU)为Y轴(见图3),校准曲线线性系数R2=0.9997。

表1 校准品赋值结果
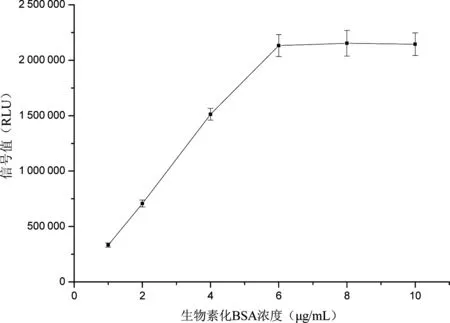
图1不同浓度包被BSA-Biotin对应检测信号(RLU)
Figure 1 The RLU of different BSA-Biotin concentrations
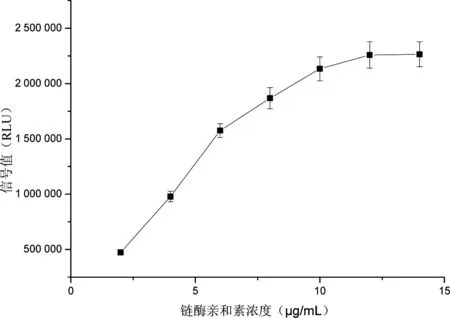
图2 不同浓度链酶亲和素对应检测信号

图3 叶酸(FA)校准品曲线
2.3 最佳FA-HRP、生物素化FBP工作浓度的确定
实验结果如表2所示,当生物素化FBP浓度为0.4 μg/mL,FA-HRP浓度为0.3 μg/mL时校准品信号值梯度适宜,测量质控品偏差小,均小于10%满足检测要求。

表2 浓度筛选结果
2.4 FBP亲和力实验结果
由来源为进口的FBP作为对照组,实验纯化所得的FBP作为实验组,相同条件下发光值(RLU)对比结果如表3所示。两组CV基本接近,说明包板误差小,结果可信。相同条件下实验组RLU平均值为6 996 210,对照组为4 189 347,两组比值约为1.67,可说明本研究实验纯化所得的FBP较进口FBP亲和能力高,可替代。

表3 质控品检测结果

表4 试剂盒准确度检测
2.5 试剂盒的性能验证
2.5.1 最低检出限
根据行业公认的最低检测限方法通过平行3次测定10孔0 ng/mL 叶酸校准品,得到直接数据相对发光强度(RLU),以及平均值(M)和标准差(SD)。利用剂量-反应曲线计算出(M-2SD)对应的浓度值为最低检出限[13]。本试剂盒线性测量范围为1.5~50 ng/mL,灵敏度为1 ng/mL,均居于国内领先。
2.5.2 准确度
根据精确度性能指标的相关方法,用标定浓度为2.5 ng/mL和15 ng/mL的伯乐质控品平行进行10次检测,其检测结果见表4,理论值与实测值的相对偏差均在±10%范围内,证明本试剂盒准确度符合行业标准。
2.5.3 精密度
对高中低浓度(15、7和2.5 ng/mL)的伯乐质控进行随机3个批次的平行10次检测实验,各质控检测的平均数、标准差及变异系数(CV%)结果如表5,批内精密度小于10%,批间精密度小于15%,试剂盒精密度已能充分满足检验要求。

表5 批内及批间精密度
2.5.4 热稳定性
将试剂盒各组分放置37℃下进行3、6和10 d的热加速实验,并与4℃冷藏条件下进行检测对比,校准品的RLU下降幅度低于10%,伯乐质控品结果均稳定,批内和批间精密度分别为2.1%~9.1%,8.2%~9.6%批内和批间精密度检测均小于10%,热加速稳定性测试指标合格,说明本试剂盒可在2℃~8℃存放有效期可达到16个月,结果见表6。

表6 热稳定性考察结果
2.5.5 试剂盒的临床应用
临床实验200份血清样本的检测结果如图4。本试剂盒与参比试剂盒检测结果的相关系数R2=0.9847,说明两者的测定一致性高,可以替代参比试剂盒。

图4 本试剂盒与参比试剂盒检测血清样本测定结果
3 讨论与结论
目前血清的叶酸前处理面临一个较大的困难,微生物法耗时较长且血清成分复杂,易产生不良代谢物影响实验结果,荧光免疫分析等对血清叶酸的损耗较大,实验误差大。目前市场上流通较多的为叶酸酶联免疫检测试剂盒,虽能大量检测样本但前处理样本时需借助涡轮仪等仪器,方法复杂且反应时间长,线性窄误差大,漏检现象频繁。同类型的化学发光试剂盒则样品处理时间长,多为40 min以上,且存在叶酸释放不充分、准确度不高等问题。本研究创新地采用了生物素-亲和素(BAS)反应体系,成功将传统的试剂与仪器处理相结合的复杂的样品前处理,自主研发为纯液体环境的试剂处理,并且快速充分地将叶酸小分子从血清样本中提取出来。通过变性剂、稳定剂和中和剂3种试剂的合理搭配,将前处理时间缩短到了20 min内,所用试剂安全、环保,使临床操作更加安全便捷。并且改良了叶酸结合蛋白的提纯方法,得到较高亲和力的实用型蛋白,降低了整体的成本。研制成品的试剂盒的各项性能指标经验证:最低检出限为1 ng/mL,热加速试验下变异系数仍可保持在10%以内,有效期可达16个月,各项指标均居于国内领先水平,同时临床实验结果证实本试剂盒与参比试剂盒(Beckman)的检测结果呈高度相关性。此研究为本试剂盒的临床应用提供了理论支持,适用于大批量检测,可替代国外同类试剂盒。
结合目前的市场发展,本研究可结合维生素B12、铁蛋白、维生素D的检测,研发相关仪器取代人工,完善孕妇的产前检测等相关项目。磁珠是一种新兴的反应载体和方式,它操作简单,用时更短,可以大幅度提高分析检测的灵敏度。本研究具有很大的进步空间,可以借助磁珠这一平台进一步研发,扩大检测量并缩短反应时间,提高检测的准确程度,更加贴合市场需求。
