晋南1号枣树花药培养再生株系的染色体型组分析
2019-04-17陈宗礼张乐元韩爱琴张枝婵齐向英
陈宗礼, 张乐元, 柏 勇, 杨 洋, 韩爱琴, 张枝婵, 齐向英
( 陕西省红枣重点实验室 延安大学生命科学学院, 延安 716000)
染色体组型分析是植物遗传育种和细胞学研究中非常重要的研究领域,近来在百合[1]、山核桃[2]、满天星[3]、野生铁线莲属[4]等植物中均有研究报道。枣属植物的染色体在2013年前有研究报道[5-11],但晋南1号枣树及其花药培养株系的染色体组分析未见报道。该枣树是陕西省红枣重点实验室于1999年由杨凌农博会引进的优良鲜熟枣品种(现种植于延安大学生物园),齐向英等2010年对该枣树花药开展了培养并于2012年获得了再生试管苗,现存于陕西省红枣重点实验室(延安大学),本研究对其进行了染色体组分析,旨在确定它的染色体组型及其特征,为其快繁与育种利用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试材料
晋南1号枣(Zizyphejujubemill Jinnan No. 1)花药培养的再生株系第6代继代培养试管苗。
1.1.2 主要仪器设备与药品试剂
Olympus公司产Olympus BX41荧光显微镜和PM 10全自动显微照相系统,Adobe公司产Adobe Photo-shop CS2分析软件。
国产分析纯药品试剂:对二氯苯,KCl,加拿大树胶,纤维素酶,果胶酶,改良苯酚品红染液。
1.2 方法
1.2.1 预处理
随机取其8瓶试管枣苗,在25℃~28℃、相对湿度为50%~70%的条件下暗培养7 d后,于早上10:00剪取其幼嫩叶片浸入饱和对二氯苯液在4℃处理4 h。
1.2.2 制染色体片
参照陈瑞阳等[12-13]的方法,采用改进的酶解去壁低渗-改良苯酚品红染色法制片。主要过程为:将预处理过的嫩叶置于纤维素酶与果胶酶(各0.25%,pH 4)的混合液,在45℃恒温离析5 h;再用0.075 mol/L KCl液于4℃低渗30 min,更换新液后再低渗40 min;将其滤干后浸入改良苯酚品红染色液在4℃染24 h。脱水、透明、封片参照权燕敏等[10]的方法进行。
1.2.3 染色体组观察与分析
将制好的染色体片经自然风干后镜检,选处于分裂中期良好的分裂相计数并拍照。随机选4张封片作为一次镜检重复,重复3次;用Microsoft Excel 对观察结果进行统计分析;择较好的图像用Adobe Photoshop CS2软件进行处理[14-15]并测量分析染色体的长度,计算其臂比指数、相对长度和核型不对称系数等指标;按Levan[16]和李懋学等[17-18]的核型标准进行组型分析。
2 结果与分析
2.1 染色体个数和组数
染色体分析结果见表1。从79个中期分裂相中检测到的染色体数目有11条、12条、13条和14条4种类型;其中,12条的占84.81%(76.90%~92.72%),而11、13和14条的分别占5.06%(0.23%~9.90%)。F检验表明,F数= 441.00>F0.01(6,3)= 9.78,各数目间差异极显著,进一步经SSR检验,具12条染色体的极显著地高于具11、13和14条的,而11、13和14条相互间无统计差异。
李懋学和陈瑞阳认为,分析物种的染色体数时,在30个以上的统计细胞中有85%以上的具恒定一致的染色体数,便可确定是该植物的染色体数目[17]。借此说明,供试材料的染色体个数是不配对的12条,属1个染色体组。
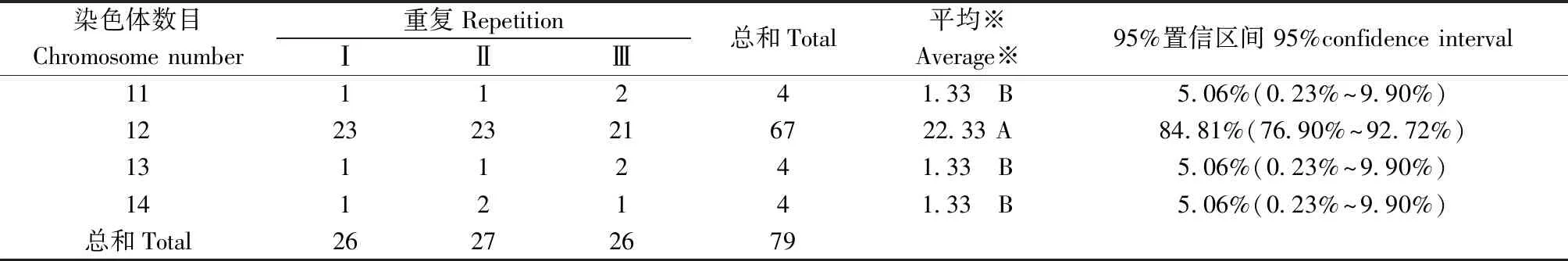
表1 晋南1号枣花药培养再生株的染色体数目
注:※大写字母不同者表示在0.01水平上染色体数目存在极显著差异
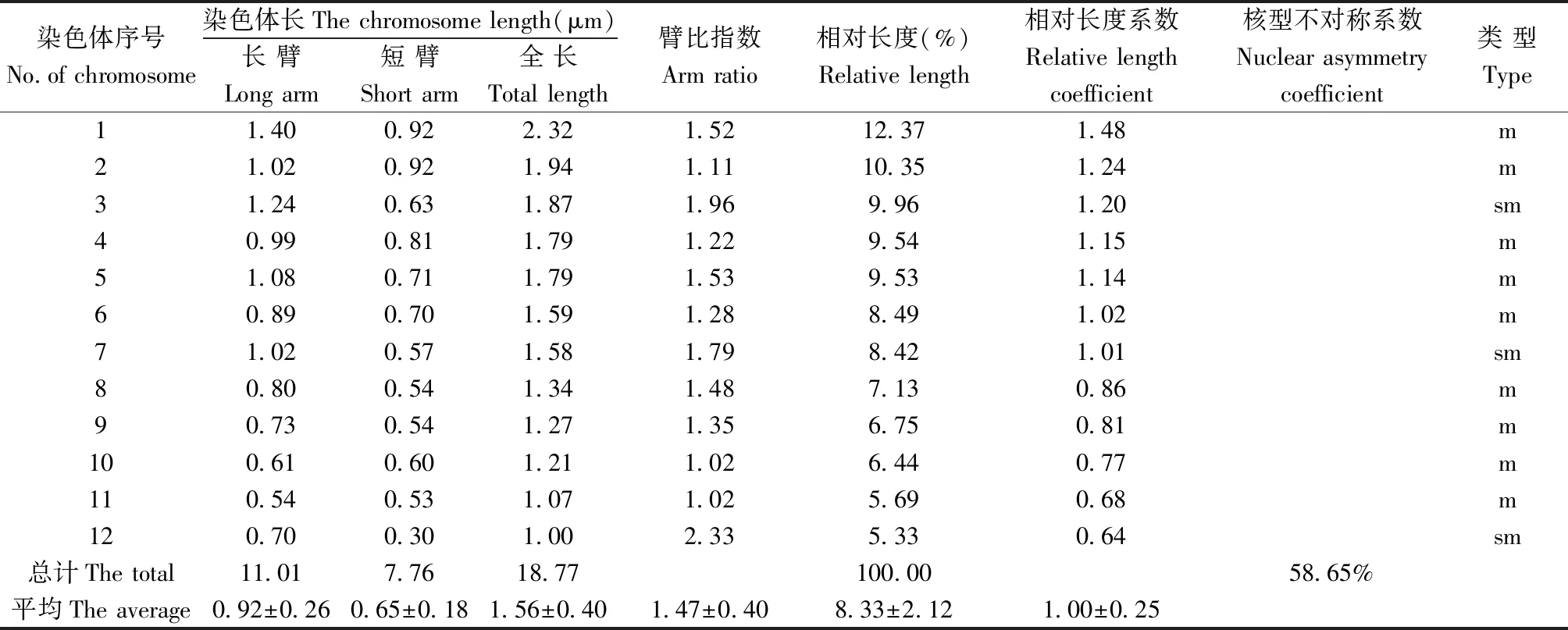
表2 晋南1号枣花药培养再生株染色体分析
注:染色体总长度 = 单细胞全部染色体长度之和;臂比指数 = 长臂(g)/短臂(p);相对长度(%)= (该染色体长度/总染色体长度)×100% ;相对长度系数 = 该染色体长度/全组染色体平均长度;着丝粒指数 = 短臂/该染色体全长×100; 核型不对称系数 (As.K%) = 全组染色体长臂总长/全组染色体总长。m:中着丝粒染色体;sm:近中部着丝粒染色体
2.2 染色体组型分析
供试材料12 条染色体的长度变化范围在1.00~2.32 μm (表2),全组染色体总长度为18.77 μm ,平均长度(1.56±0.40)μm;平均臂比指数1.47±0.40,变异范围1.02~2.33;依据李懋学等[17-18]的染色体分类标准,其第1、2、4、5、6、8、9、10和第11这9条染色体的臂比指数在1~1.7(1.02~1.53)范围内,故均为中部着丝粒染色体;第3、7和第12这3 条染色体的臂比指数在1.7~3(1.79~2.33)范围内,故均为近中部着丝粒染色体;染色体组的核型不对称系数为58.65%,说明其对称程度较高,其组型按tebbins[19]的核型不对称标准分析属2B型;组型公式依Levan 等[17]和Kuo等[20]的染色体分类标准分析为n=1X=12=9m+3sm。组型图及组型模式图见图1、图2和图3。

A: 压片得到的染色体图像;B; 将1A用Adobe Photoshop CS2软件处理得到的图像
图1晋南1号枣树花药培养再生株细胞分裂中期染色体(n=12)
Figure 1 The metaphase chromosome of the cell division of the regenerated plant of the jujube anther culture in jinnan No.1(n=12)

图2 晋南1号枣树花药培养再生株染色体组型图
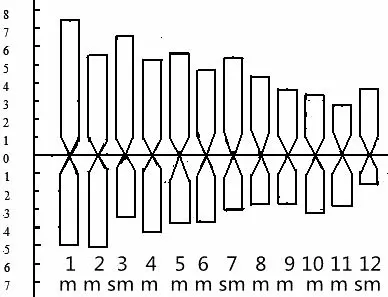
图3 晋南1号枣树花药培养再生株染色体组模式图
3 讨论
3.1 枣树染色体的大小与组型
栆属植物的染色体研究集中在国内,国外近期未见研究报道。国内相关研究中,彭建营等指出,枣树染色体属小染色体(长1~4 μm)[6-10];本研究显示,晋南1号枣树染色体长1.00~2.32 μm(表2),因此也属小染色体。齐向英等研究了狗头枣、晋枣[7-8],陈龙和彭建营研究了大荔龙枣、骏枣和冬枣[9],权燕敏等研究了京枣[10],指出这些枣树品种的组型均为2B型;晋南1号枣树的组型与上述枣树的组型研究结果相一致,说明这些枣树间的染色体组型是相对稳定的,而在染色体长度间存在不同差异;这种长度间的差异是否是由不同品种枣树间基因数量或基因的碱基数量差异,或是由于研究分析条件的不同所致,有待进一步研究。
Stebbins[19]认为,植物核型由对称向不对称发展是其进化的基本趋势。系统演化较原始的植物核型相对较对称,演化程度较高的植物其核型不对称的程度也较高。本研究表明,晋南1号枣的核型不对称系数为58.65%,与彭建营等[6]研究的河北省赞皇县赞皇大枣的3个品系(分别为62.32%、63.83%和62.22%),齐向英等[7]研究的陕西延川狗头枣(64.54%),陈龙等[9]研究的陕西大荔龙枣(59.42%)、山西交城骏枣(58.37%)、河北沧州冬枣(60.58%)的都很接近。从现有资料来看,它们的核型不对称系数均在58%以上,说明大枣属于较进化类型。但是从比较它们的核型不对称系数大小可以看出,它们的进化程度由低向高排序为骏枣—晋南1号枣—大荔龙枣—沧州冬枣—赞皇大枣—延川狗头枣。这是由于在长期的栽培过程中人为干预选择的结果。
3.2 染色体制片材料的解离
植物染色体制片中一般用酸解或酶解法解离材料。酸解法是在1 mol/L HCl中于 60℃恒温下将材料解离几至十几分钟[21];该法简单易学,应用广泛,但其所制压片的染色体大部分仍包在解离不完全的胞壁中而难以观察。酶解法是用果胶酶(1%~2%)与纤维素酶(1%~5%)的混合液在室温下将材料解离2~5 h[21],此法能较好地解离其胞壁和胞质,所制压片的染色体分散较好而便于观察和计数。因此,本研究经对比试验选用酶解法制片。至于混合酶液中果胶酶和纤维素酶的配比浓度,则以不同研究中制片材料所含果胶、纤维素以及蜡质的差异而不同。
3.3 染色体的组型分析
以往的组型分析,对染色体一般采用拍照、冲扩、剪切、排队等多个操作程序来进行,遇到有重叠的染色体时则多扩洗照片再剪切;该法费时费力,尤其是遇到小而数量较多的植物染色体,易产生较大误差而影响分析的正确性[15]。有一种全自动染色体分析系统被便利地用于组型分析中[22],但其价格昂贵难以在一般实验室应用;目前,国内多采用Photoshop软件辅助进行组型分析,借此可调整原照片的亮度与对比度,除掉制片中的划痕及斑点,并对重叠的染色体进行分离、修整等,使分析工作快捷而方便,准确性也得到提高[14-15,23-24]。因此本试验采用Photoshop软件辅助进行染色体组型分析。
4 结论
晋南1号枣树花药培养再生株系的染色体数目为12条,其平均长度为(1.56±0.40)μm,为小染色体;染色体组型属2B型,其组型公式为n =1X =12 =9m+3sm,为单倍体。可借此进一步开展快繁与单倍体育种等研究。
