铁皮石斛SERK基因的鉴定与表达分析
2019-04-17李良建马凌晖刘楚琪王万军
梁 易, 李良建, 马凌晖, 刘楚琪, 李 畅, 王万军
(西南交通大学 生命科学与工程学院,成都 610031)
体细胞胚发生相关类受体蛋白激酶(Somatic embryogenesis receptor-like kinase,SERK)广泛存在于植物中。1997年Schmidt等首先从胡萝卜(Daucuscarota)下胚轴发现第一个SERK基因,即DcSERK[1]。随后,研究人员在拟南芥(Arabidopsisthaliana)[2]、玉米(Zeamays)[3]、水稻(Oryzasativa)[4-5]、苜蓿(Medicagotruncatula)[6]、小麦(Triticumaestivum)[7]、大麦(Hordeumvulgare)[8]、鸭茅 (Dactylisglomerata)[9]、可可(Theobromacacao)[10]、文心兰(Cyrtochilumloxense)[11]和卡特兰(Cattleyamaxima)[12]等植物中分别发现了SERK基因。除了少数SERK基因的表达在体细胞胚内检测不到外,其他已经报道功能的SERK基因一般都参与了体细胞胚的发生[13]。
SERK蛋白属于富亮氨酸重复序列类受体蛋白激酶(Leucine-rich repeat receptor-like kinases, LRR-RLKs)的第二亚类,具有典型的胞外受体结合域、跨膜结构域和胞内激酶活性结构域;SPP基序(Ser-Pro-Pro,富脯氨酸结构域)是SERKs区别于其他LRR-RLKs蛋白的特征,也是鉴定SERK蛋白的依据[14]。SPP基序位于胞外受体结合域与跨膜结构域之间,可能起铰链作用使胞外信号接收更加灵活。SERK蛋白高度同源,特别是胞内激酶区;但胞外区的同源性稍低,不同的SERK蛋白可能接收不同的刺激信号,因而胞外受体结合域的序列变化更多。此外,SERK基因结构也很保守,一般含有11个外显子与10个内含子;外显子与编码蛋白功能域相对应。以拟南芥AtSERK1为例,信号肽(Signal peptide, SP)由外显子1编码,跨膜结构域(Transmembrane region, TM)由外显子8编码,外显子9~11编码胞内激酶活性结构域[2]。
Schmidt等发现DcSERK只在胡萝卜胚性细胞内表达且只表达到体细胞胚的球形期[1],蜜柑CiSERK也只在胚性细胞内检测到[15],拟南芥外植体中过量表达AtSERK1时能提高成胚率3~4倍[2],水稻表达OsSERK1也会诱导体细胞胚发生能力增强[5],金花茶(Camellianitidissima)体胚发生5个不同阶段都有SERK表达[16];这些事实都表明SERK基因在体细胞胚发生过程起重要作用。近年来的研究发现SERK基因的表达并不局限于体细胞胚发生过程,它在植物其它生理过程中也起作用。例如拟南芥SERKs蛋白与ERECTA、TMM组成受体复合体共同激活下游MAP激酶级联反应调控气孔发育[17];拟南芥serk1、bak1、bkk1三突变体只能长出非常短的根且分生组织非常少[18],促进植物生长的肽类激素Phytosulfokine (PSK)能在根中介导SERK蛋白与PSKR1的异源二聚化并启动信号转导[19-20]。SERKs作为共受体还参与包括油菜素内酯信号传导、花药绒毡层细胞分化和维管束发育及花器官脱落在内的诸多生长发育过程;还参与细胞死亡调控、植物对病原菌的先天免疫反应等过程[21]。
铁皮石斛种子萌发需形成原球茎结构,过程可分为8个时期,分别为种胚活化期、原球茎形成期、原分生组织形成期、顶端分生组织形成期、叶维管系统形成期、根形成期、原球茎退化期、苗形成期,记为P1~P8。本研究通过对铁皮石斛SERK基因的筛选鉴定,并利用荧光定量PCR方法研究基因在原球茎发育各时期和不同组织的表达情况,同时对基因进行生物信息学分析,为深入研究SERK基因的功能奠定了理论基础,也为研究铁皮石斛原球茎发育的分子机理奠定基础。
1 材料与方法
1.1 材料
铁皮石斛种子;RNA提取试剂盒购自成都biofite公司;PCR反应体系购自上海生工,引物由上海生工合成;荧光定量试剂盒与逆转录体系购自TaKaRa公司。
1.2 方法
1.2.1 原球茎发育各时期与各组织器官材料的获取
铁皮石斛种子接种于1/2 MS半固体培养基上,分别取种胚活化期 (P1,~5 d)、原球茎形成期(P2,~15 d)、原分生组织形成期 (P,~28 d)、顶端分生组织形成期 (P4,~37 d)、椭球形原球茎期 (P5,~45 d)、叶原基维管系统形成期 (P6,~60 d)、根端分生组织形成期 (P7,~80 d)、原球茎基部退化期 (P8,~100 d)与幼苗(P9,~120 d)材料。愈伤组织由茎段诱导,根、茎、叶、花等植物组织采集于成熟的铁皮石斛植株。原材料样品用液氮速冻后于-80℃保存备用。
1.2.2 铁皮石斛总RNA提取及逆转录
取上述冻存原材料,用植物RNA提取试剂盒(biofite公司)提取总RNA,DNaseⅠ膜上消化去除基因组污染。电泳检测到28 S与18 S两条带,测得OD260/280在1.8~2.1之间,总RNA -80℃保存备用。以上述总RNA为材料,使用逆转录酶Reverse Transcriptase M-MLV(RNase H-,TaKaRa)体系和引物Oligo(dT)18逆转录合成cDNA,-20℃保存备用。从每份cDNA取少量得混合cDNA,-20℃保存备用。
1.2.3 铁皮石斛SERK基因的筛选与鉴定
SERK基因的筛选主要通过同源比对方法,用到的数据库和工具包括铁皮石斛CDS与基因组数据库、NCBI、Blast、FGENESH+。首先从NCBI上下载其他物种已鉴定的SERK基因CDS序列,比对铁皮石斛CDS与基因组数据库得到目的片段;然后通过蛋白质结构、基因结构等多重特征确定目的片段是否为SERK基因。
采用3′RACE实验方法鉴定从数据库中筛选到的SERK基因。设计基因特异引物GSP为上游引物,下游使用通用引物3RNP。以混合cDNA为模板,PCR反应后回收目的片段,连接载体后转化感受态大肠杆菌DH5α(菌种购自上海生工),蓝白斑筛选挑取白斑单克隆,摇菌培养过夜后菌液PCR检测合格后测序,测序结果与原序列一致,则鉴定成功。
1.2.4 qRT-PCR
根据基因的CDS序列设计qRT-PCR上游引物DoSERK2-U与下游引物DoSERK2-D,见表1。引物验证合格后,使用SYBR Green I(购自TaKaRa)体系检测相对表达量。
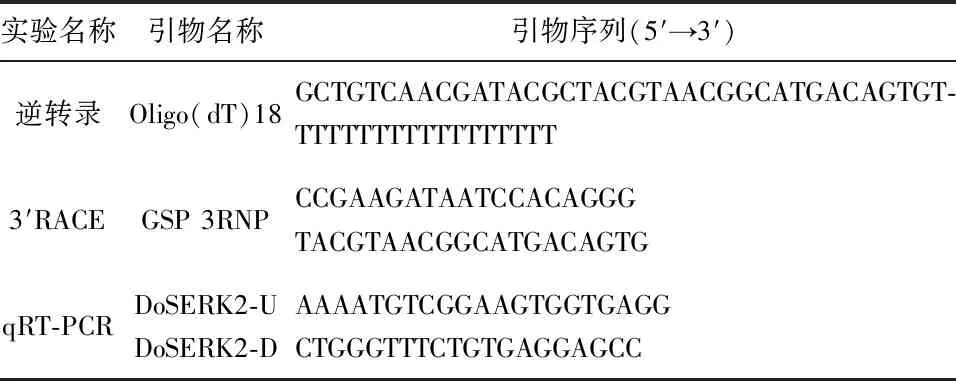
表1 研究中所用到的引物
2 结果与分析
2.1 铁皮石斛SERK基因筛选与克隆鉴定
利用同源比对方法从铁皮石斛CDS和基因组数据中获得5个片段,分别位于scaffold2481、4966、1126、7408、12 804上,通过FGENESH+在线工具预测得5个基因及其编码的蛋白质序列以及这5个基因的基因结构,将这5个基因记为gene1、gene2、gene3、gene4和gene5。基因结构图显示gene1、gene2、gene3和gene4含有11个外显子,而gene5则只有8个外显子且基因结构不全。
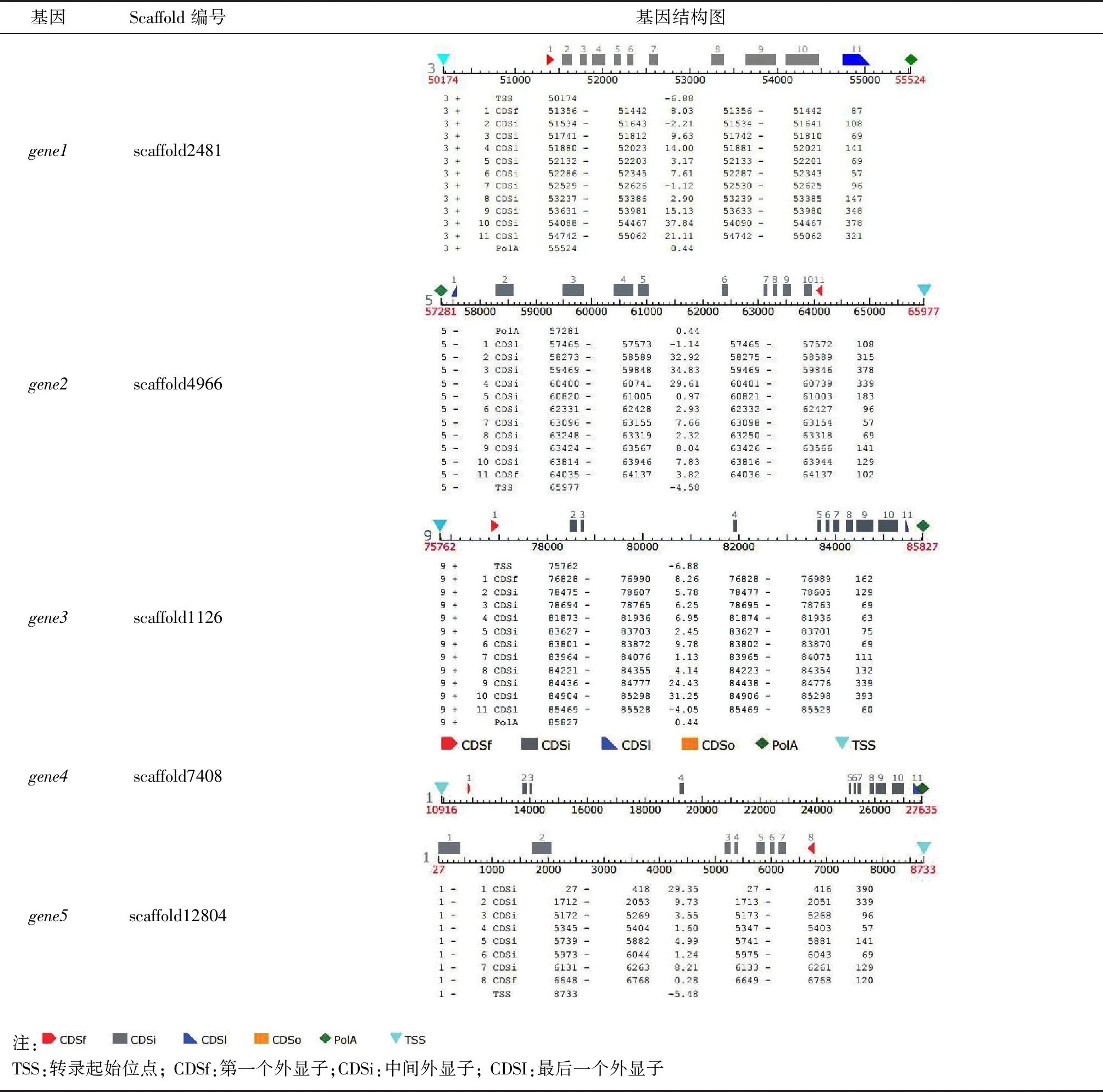
表2 基因结构
这5个基因编码的蛋白质分别由614aa、647aa、633aa、628aa与454aa组成。序列比对结果发现这些蛋白都具有激酶结构域,其中蛋白质1、2可归为一类,蛋白质3、4归为一类;gene3、gene4编码的蛋白与SERK蛋白的长度和功能域符合,且含有特征序列SPP基序(图1,红框)。最终,确定gene3和gene4为铁皮石斛SERK基因,分别命名为DoSERK1和DoSERK2。查阅文献发现DoSERK1已被王晓娟等研究报道过[22]。因此,接下来的研究以DoSERK2为对象,Blast比对发现其在NCBI上被注释为BAK-like基因(XM_020843144)。
设计3′RACE引物GSP,PCR产物电泳检测得到长度为750 bp左右的片段(图2),回收、克隆与测序后得到一条长790 bp的核酸序列,比对后该片段与DoSERK2的CDS 3′端一致,含CDS区612 bp,其余178 bp为3′-UTR区。
2.2 DoSERK2的表达分析
提取铁皮石斛种胚发育各时期和不同组织器官的总RNA,逆转录成cDNA;采用实时荧光定量PCR分析DoSERK2在各个时期和不同组织的相对表达量,结果显示DoSERK2在原球茎发育各时期和不同组织器官中广泛表达。原球茎发育过程中在P1时期(种胚活化期)表达量最高,P2~P9时期表达量低且差别不大(图3);在花中表达量最高,根、茎、叶和愈伤组织中表达量低且差别不大。

图1 gene1、gene2、gene3、gene4和gene5编码蛋白与DoSERK序列比对

图2 PCR产物凝胶电泳
2.3 DoSERK2生物信息学分析
2.3.1DoSERK2基因结构
DoSERK2基因全长15 724 bp,CDS长1877 bp,5′-UTR区长1285 bp,3′-UTR长1204 bp,其基因结构与AtSERK1基因相似,含11个外显子和10个内含子(表2,gene4)。各外显子与功能域基本对应(图4),外显子1编码信号肽(signal peptide, SP);外显子2编码锌指结构和LRR1;外显子4编码LRR2与LRR3;外显子5和6分别编码LRR4和LRR5;外显子7编码SPP基序,该基序是SERK蛋白的特征序列;外显子8编码跨膜结构域(transmembrane region, TM);外显子9~11编码胞内激酶活性结构域。
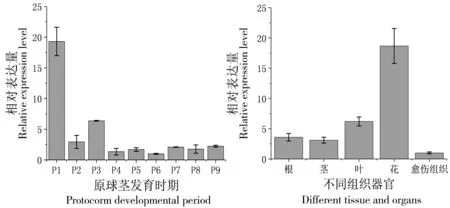
P1:种胚活化期;P2:原球茎形成期;P3:原分生组织形成期;P4:顶端分生组织形成期;P5:椭球形原球茎期;P6:叶原基维管系统形成期;P7:根端分生组织形成期;P8:原球茎基部退化期;P9:幼苗
图3原球茎发育各时期和不同组织器官中DoSERK2相对表达量
Figure 3 Expression ofDoSERK2 in the development of protocorm, and in different tissues and organs

SP信号肽;ZIP锌指结构;LRR富亮氨酸重复序列;SPP富脯氨酸基序;TM跨膜区;Kinase激酶区
图4DoSERK2各外显子对应的功能域
Figure 4 The functional domain corresponding to the exons ofDoSERK2
2.3.2DoSERK2调控元件分析
PlantCARE分析DoSERK2基因TSS上游1500 bp核苷酸序列,得调控元件分析表(表3)。TATA-Box位于TSS上游-35~30 bp,除含有TATA-box与CAAT-box基本元件外,还有4个元件涉及光响应,2个元件与茉莉酸甲酯(MeJA)应答有关,4个元件可能为MYB转录因子结合位点。
2.3.3 DoSERK2蛋白分析
DoSERK2基因CDS长1877 bp,编码628个氨基酸。DoSERK2蛋白分子量为69.4 ku,等电点pI为5.64,是一个亲水性蛋白;SignalP预测其1~28位氨基酸为信号肽,28~29位为切割位点;WoLFPSORT与TMHMM预测其为质膜蛋白,1~241位氨基酸位于细胞质膜外,242~264位氨基酸为跨膜螺旋区,265~628位氨基酸位于胞内。
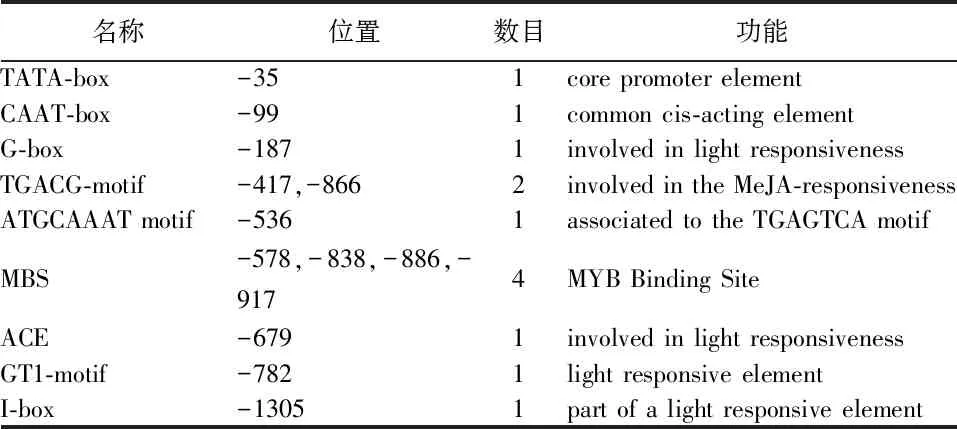
表3 DoSERK2 调控元件分析
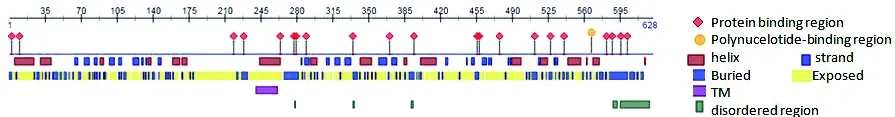
图5 PreditProtein预测DoSERK2蛋白二级结构
Figure 5 Predict Protein predicts the secondary structure of DoSERK2
1)二级结构。利用PreditProtein与SOPMA网站预测DoSERK2的二级结构(图5),DoSERK2蛋白具有 21个蛋白质结合位点,1个 DNA 结合位点,二级结构由40.61%α-螺旋、16.56%延伸链、7.48% β-转角和35.35%无规卷曲组成,第242~263个氨基酸为跨膜区域,无序区域较短。

图6 NCBI Conserved domains在线分析
2)三级结构与功能域。SWISS-MODEL预测DoSERK2胞内激酶区三级结构(图7),有一个明显的凹陷区(图7,白色箭头);NCBI Conserved domains在线分析结果(图6)显示了DoSERK2的功能域(图7),ATP结合位点、活性位点、多肽底物结合位点与活性环都位于胞内激酶区,将这些氨基酸在三维结构中标示出来,发现它们都位于凹陷区附近(图7-B,彩色)。
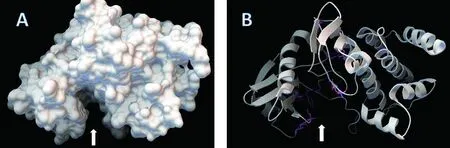
A:molecular surface; B:ribbon;sticks and balls显示位于ATP结合位点、活性位点、多肽底物结合位点与活性环的氨基酸
图7 SWISS-MODEL预测DoSERK2蛋白三级结构
Figure 7 SWISS-MODEL predicts the tertiary structure of DoSERK2

图中功能域分别为:信号肽(红色);LRR(亮氨酸重复序列,蓝色);SPP(富脯氨酸基序,橙色);TM(跨膜区,灰色);激酶(黄色)图8 序列比对Figure 8 Sequence alignment
2.3.4 DoSERK2蛋白序列比对与分析
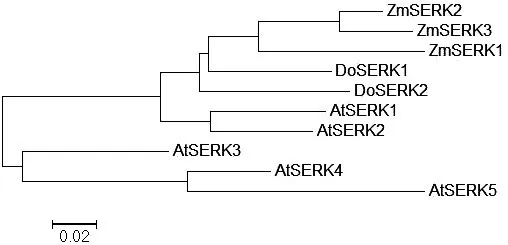
将DoSERK2与DoSERK1(AKN89445.1),玉米ZmSERK1(CAC37638.1)、ZmSERK2(CAC37639.1)、ZmSERK3(NP_001306698.1),拟南芥AtSERK1(ACN59271.1)、AtSERK2(CAF33246.1)、AtSERK3(AAK68074.1)、AtSERK4(NP_178999.2)和AtSERK5(NP_179000.3)共10条蛋白进行多序列比对,发现这些序列同源性达83.72%,都具有SERK蛋白特征功能域(图8)。采用MEGA5.0 UPGMA法构建系统发育树(图9),发现DoSERK2蛋白与DoSERK1同源性最高,玉米3个SERK蛋白最接近,拟南芥AtSERK1与AtSERK2最接近;而AtSERK3、AtSERK4和AtSERK5与其他SERK蛋白同源性较低,特别是富脯氨酸区域和C-端与其他7个蛋白差别较大。这说明SERK蛋白在同一植物中既有相似性又有差异性。
The ID of corresponding mRNA in NCBI: DoSERK1 (AKN89445.1), DoSERK2 (XM_020843144), ZmSERK1(CAC37638.1), ZmSERK2 (CAC37639.1), ZmSERK3 (NP_001306698.1), AtSERK1 (ACN59271.1), AtSERK2 (CAF33246.1), AtSERK3 (AAK68074.1), AtSERK4 (NP_178999.2), AtSERK5 (NP_179000.3)
图9系统发育树
Figure 9 Phylogenetic tree
3 讨论
SERK基因在植物中广泛存在且在同一植物基因组中往往具有多个成员,如拟南芥有5个SERK基因,分别为AtSERK1、AtSERK2、AtSERK3、AtSERK4和AtSERK5[2];玉米有3个,分别为ZmSERK1、ZmSERK2和ZmSERK3[3];大麦有3个,为HvSERK1、HvSERK2与HvSERK3[8]。通过对铁皮石斛基因组进行同源搜索后共发现5个目的片段,翻译成蛋白后鉴定含SPP基序的基因有2个且最终被确定为SERK基因,分别命名为DoSERK1与DoSERK2。DoSERK1即为DoSERK,已被王晓娟等研究报道过,编码633个氨基酸,其氨基酸序列与文心兰(Cyrtochilumloxense)和卡特兰(Cattleyamaxima)SERK亲缘关系最近[22]。DoSERK2是筛选鉴定的另一个铁皮石斛SERK基因,编码628个氨基酸,序列与小兰屿蝴蝶兰(Phalaenopsisequestris)BAK1-like蛋白(XP_020586612.1)、深圳拟兰(Apostasiashenzhenica)SERK蛋白(PKA59550.1)同源性最高,分别为96%和93%。DoSERK1信号肽比DoSERK2多5个氨基酸,DoSERK2的信号肽切割位点在28~29位而DoSERK1则在33~34位[22]。DoSERK1与DoSERK2都是亲水性蛋白,它们的分子量、等电点等理化特征与其他SERKs蛋白一致;功能域分析显示DoSERK1和DoSERK2都具有SERK蛋白特征功能域。
DoSERK1在铁皮石斛不同组织器官中均有表达,在幼嫩小苗根部表达量最高[22];说明它可能参与多种生长发育过程,但在根的发育过程中发挥重要作用。DoSERK2也在铁皮石斛中广泛表达,组织表达分析显示它在花中表达量最高,而原球茎发育各时期表达分析显示它在P1种胚活化期表达量最高。花是植物的生殖器官,其生物学功能是产生雌、雄配子体使之结合形成合子并最终发育成种子。这一进程包括雌蕊与雄蕊的发育、授粉作用、受精作用和合子的发育,可推测DoSERK2在铁皮石斛生殖过程中发挥重要作用,但具体在哪个步骤起作用尚不清楚。铁皮石斛胚胎发育为紫菀型,基细胞与顶细胞都参与胚的发育,种子成熟时胚胎发育停止在早期,这时种胚尚未分化,需经过原球茎这一中间结构才能形成植株。因此,原球茎发育是胚胎发育与种子萌发过程的整合,原球茎发育早期可视为胚胎发育,后期可视为种子萌发形成植株的过程。原球茎发育第一阶段属于铁皮石斛早期胚胎发育,可推测DoSERK2在铁皮石斛早期胚胎发育过程中起重要作用。
DoSERK1与DoSERK2作为受体跨膜激酶参与铁皮石斛生长发育过程,其作用机制还有待研究。一般来说,SERKs与其它LRR-RLKs相互作为共受体通过磷酸化与去磷酸化接收并传导信号,拟南芥AtSERK3与BRI1(Brassinosteroid-intensitive1)作为共受体识别芸苔素(Brassinosteroid, BR)信号并采用可逆的磷酸化途径引发下游基因表达,由此产生BR生理效应[23-27]。PlantCARE分析显示DoSERK2可能参与光响应过程,茉莉酸甲酯与MYB转录因子可能调控DoSERK2的表达。茉莉酸甲酯是一种与损伤相关的植物激素和信号分子,能够激发植物防御基因的表达,诱导植物的化学防御。植物MYB转录因子参与众多生物学过程,主要包括初生和次生代谢反应、细胞形态与模式建成、植物生长发育、对生物和非生物胁迫的应答等。这表明DoSERK2基因可能具有多重功能,参与多种生物学过程。
