三唑醇杀菌剂在雄性丽斑麻蜥体内的对映选择性降解、蓄积和肝毒性研究
2019-04-17胡晓李济彤常静郭宝元王会利
胡晓,李济彤,常静,郭宝元,王会利,*
1. 中国科学院生态环境研究中心,北京 100085 2. 中国科学院大学,北京 100049
三唑类杀菌剂被广泛应用于农业和人类真菌病防治领域,它们主要通过阻断真菌细胞壁的生成来抑制真菌的生长[1]。由三唑类杀菌剂的使用量巨大并且在环境中具有一定的持久性,它们在土壤、水和植物等环境介质中被不断检出,因此,三唑类杀菌剂引起的环境健康和生态毒理学问题逐渐成为人们关注的焦点[2]。已有的研究发现,环唑醇、氟环唑和丙环唑暴露于大鼠能引起肝细胞过度增殖、肝组织肥大等现象,具有明显的肝毒性[3]。此外,Lin等[4]发现,腈菌唑和三唑酮能够诱导斑马鱼体内CYP3A酶的活性并且刺激芳香烃受体(AhR)的表达量增加,导致子代数目减少、性腺重量增加。三唑醇(triadimenol, TN)是一种典型手性三唑类杀菌剂,它含有2个手性中心,4个手性单体,包括TN-A(A1(R,S)和A2(S,R)),TN-B(B1(R,R)和B2(S,S)),其中A1和A2对映体各约占35%,B1和B2对映体各约占15%。一般来说,手性对映体之间具有相同的物理、化学性质,但是在生物体内的手性环境中,不同对映体往往在吸收、分布和代谢等方面存在差异[5]。已有的研究表明,三唑醇4种对映体在土壤、植物、微生物和鱼体内的吸收、转化和降解都表现出明显的对映选择性,这说明4种对映体在生物体内的活性具有明显的差异[6-7]。
近年来,全球爬行动物的数量出现明显的下降,全球气候变化、栖息地减少和环境污染等被认为是导致爬行动物数量下降的主要原因[8]。而农药作为世界上应用最广泛、使用量最多、使用时间最长的化学品,是陆地环境中最主要污染物之一。但是目前关于农药对爬行动物的生态毒理学研究还很少,鸟类通常作为爬行动物生态毒理学研究的替代模型。然而有研究表明,爬行动物对一些化学品更为敏感,并且其暴露方式也和鸟类有一定的差异,以鸟类作为爬行动物的替代模型并不准确[9-10]。蜥蜴是爬行动物中种群数量最多的物种,它们生活在陆地生态系统中,可以通过呼吸、皮肤和饮食等方式直接暴露于农药。由于它们栖息地广泛、对环境污染物敏感,蜥蜴被认为是爬行动物生态毒理学评价的潜在模型。丽斑麻蜥是中国的本土生物,主要分布在长江北部。由于它们体型小,易于在实验室条件下喂养,近年来,丽斑麻蜥已经被一些研究用来评价环境污染物的生态毒理学效应[11-12]。
目前仍然缺乏三唑醇在爬行动物体内的毒性效应和对映选择性行为方面的研究,本实验分别以雄性丽斑麻蜥短期暴露和长期暴露于三唑醇,从对映体层面考察4种单体在丽斑麻蜥体内的代谢降解和生物蓄积规律,通过测定肝脏中代谢相关基因的表达量和组织病理学切片,评价三唑醇对丽斑麻蜥肝毒性效应,进而综合评价三唑醇对爬行动物的生态毒理学风险。
1 材料与方法(Materials and methods)
1.1 化学品和试剂
三唑醇外消旋体(纯度>98.9%)购自德国Dr. Ehrenstorfer公司,保存在甲醇(分析纯)中,外消旋体由35% A1、35% A2、15% B1和15% B2组成,4 ℃避光储存。所有的化学试剂,包括甲醇、乙腈、乙醇、异丙醇、三氯甲烷和正己烷(均为分析纯),购买自迪玛科技有限公司(北京)。
1.2 丽斑麻蜥的饲养
本实验室自2009年起即建立了完善的丽斑麻蜥饲养体系,蜥蜴生活在5 m×1.2 m×0.4 m的玻璃培养箱中,底部填有10 cm厚的细砂土。每个玻璃培养箱均配备6个紫外灯,控制光暗时间比为14 h∶10 h,玻璃箱的温度控制在25~30 ℃,湿度控制在30%~40%。蜥蜴每天喂食活的黄粉虫(Tenebriomolitor),每2天洒一次水,清理玻璃箱中的排泄物。本实验中,选择健康、体重相近(3~4 g)和性成熟的成年(2~3岁)雄性丽斑麻蜥,在实验开始前将所选蜥蜴转移至50 cm×50 cm×40 cm的塑料培养箱中,在相同条件下培养适应2周。
1.3 暴露实验
目前缺乏三唑醇对爬行动物的毒理学数据,而鸟类一般作为爬行动物风险评估的替代物种,Hao等[13]在腈菌唑的研究中发现,鸟类半致死剂量(LD50)的5%作为暴露浓度是丽斑麻蜥的敏感浓度,能够引起明显的生理反应。此外,Wang等[11]通过亚慢性暴露实验(14 d)发现,三唑酮对丽斑麻蜥的最高非致死剂量为200 mg·kg-1body weight,Li等[14]以丽斑麻蜥暴露于100 mg·kg-1bw三唑酮21 d,未出现明显的致病和致死效应。由于三唑醇是三唑酮在生物体内的主要代谢物,其毒性与三唑酮相近,因此本实验选择三唑醇对鸟类(LD50)的5%,即100 mg·kg-1bw作为实验剂量。
随机选择21只蜥蜴,用平口注射器一次经口暴露100 mg·kg-1bw三唑醇外消旋体,分别于暴露后1、2、4、6、12、24和48 h将蜥蜴于二氧化碳培养箱中安乐死,每个时间点随机选取3只蜥蜴,提取蜥蜴的各个组织,包括肝、大脑、性腺、肾、皮肤和尾,将组织称重后保存在-20 ℃冰箱中。
随机选取9只蜥蜴分为空白对照组和2个暴露组,每组3只,暴露组蜥蜴每2天经口暴露一次100 mg·kg-1bw三唑醇外消旋体,暴露28 d后提取暴露组蜥蜴的肝、大脑、性腺、肾、皮和尾,称重后保存于-20 ℃,用于测定组织残留;提取空白对照组和暴露组蜥蜴的肝组织,分别切下一小片保存在4%多聚甲醛中用于组织病理学分析,余下肝组织置于RNA保存液中,于-80 ℃保存用于相对基因表达量分析。
1.4 化学分析
将蜥蜴的各个组织用生理盐水冲洗干净,在-70 ℃冷冻干燥机中去除水分后转移到50 mL聚丙烯离心管中。加入10 mL乙腈作为提取剂,将组织破碎后涡旋2 min使其与乙腈充分混合。然后在离心机上离心(1 000 g、5 min)、静置后将上清液转移至分液漏斗中。重复上述提取步骤,合并上清液至分液漏斗中。然后向分液漏斗中加入20 mL正己烷用于液液萃取以去除大部分脂肪。收集分液漏斗下层液体至圆底烧瓶中,40 ℃下旋蒸至即将蒸干,然后采用氮吹仪将残留液体吹干。向圆底烧瓶中加入1 mL甲醇溶解残渣,充分震荡混匀后经过0.22 μm滤膜过滤后转移至进样小瓶中。
使用菲罗门Lux Cellulose-1手性柱(250 mm×4.6 mm,粒径5 μm)在TSQ QUANTUM ACCESS MAX高效液相色谱-质谱联用仪(赛默飞世尓科技公司,美国)上检测三唑醇4种对映体在样品中的含量,流动相为V(甲醇)∶V(水)=68∶32,流速为0.5 mL·min-1,进样量10 μL,柱温40 ℃,吹扫电压3 500 V,鞘气流量35 arb,毛细管温度320 ℃。质谱扫描模式为平行反应监测(PRM),三唑醇一级质谱特征离子质荷比(m/z)为296.10,二级质谱特征离子质荷比为43.60和70.04。
将0.1、1和10 mg·kg-1浓度的三唑醇加入到空白组织中,采用相同的提取、检测方法测定回收率,结果显示4种对映体的回收率都在81.5%~118.3%之间,回收率标准差(RSD)均小于5%,表明上述提取方法可行。
1.5 基因表达量测定
使用TRNzol A+试剂(北京天根生化科技有限公司)遵照操作规程提取性腺组织中的总RNA,利用Nano-drop-2000分光光度计测定所得RNA的浓度和纯度。使用Fastking RT试剂盒(含gDNase)(北京天根生化科技有限公司),依据操作手册对2 μg RNA进行反转录,反应体系为20 μL。
使用Talent qPCR PreMix (SYBR Green)(北京天根生化科技有限公司)试剂盒和MX3005P型荧光定量PCR仪(Stratagene, USA)对肝脏中代谢相关基因进行实时定量PCR,相关基因的引物序列均来源于美国国家生物技术信息中心(NCBI)数据库。根据Chang等[15]的研究,β-actin基因在蜥蜴各个组织中的表达量十分稳定,因此采用β-actin作为管家基因,对目标基因的表达量进行相对定量。采用两步法PCR反应程序进行反应,首先在95 ℃下预变性3 min,PCR反应阶段首先在95 ℃、5 s条件下变性,最后60 ℃、15 s条件下退火和延伸,反应经历40个循环后终止。对每个基因的扩增进行熔解曲线分析,保证基因的特异性扩增。采用2-△△Ct方法计算目标基因的相对表达量。
1.6 组织病理学分析
将肝组织样品放在固定液中固定,用乙醇进行脱水,然后使石蜡侵入组织中,将侵蜡后的组织置于融化的固体中包埋,将包埋后的组织切为6 mm后的切片,然后用苏木精和伊红(H&E)染色,具体程序为:脱蜡、复水、染色、脱水、透明和封固,最后在光学显微镜下观察组织病理学特征。
1.7 数据分析
采用Origin Pro 9.1软件进行数据分析,所有数据均以平均值±标准差的形式表示。采用独立样本T检验(independentT-test)方法分析暴露组和对照组之间的差异,*P<0.05表示具有统计学差异。
2 结果与讨论(Results and discussion)
2.1 三唑醇在丽斑麻蜥体内的对映选择性降解
雄性丽斑麻蜥一次经口暴露于三唑醇外消旋体(100 mg·kg-1bw)后,三唑醇被迅速吸收,并分布到体内的各个组织,但是在不同组织中达到最高浓度的时间不同。从图1可以看出,肝脏和尾巴中三唑醇浓度在暴露后1 h即达到最高浓度,大脑、肾和皮肤中的三唑醇在4 h达到最高浓度,而性腺中的三唑醇浓度在暴露后12 h达到最大值。总体来说,进入大脑和肾组织的三唑醇浓度明显低于其他组织,在暴露后48 h蜥蜴各个组织中的三唑醇基本被代谢完毕。三唑醇具有较强的亲脂性(logKow= 3.18),因此易于在各个组织中分配转移,同时实验结果显示,三唑醇能够穿过血脑屏障进入大脑中,而已有的研究表明,三唑醇能够抑制大鼠脑中多巴胺的吸收,引起小鼠行为异常,具有明显的神经毒性,因此,三唑醇也可能会对丽斑麻蜥的神经系统造成损伤[16]。
三唑醇外消旋体包含35% A1、35% A2、15% B1和15% B2,从图1中可以看出,B1和B2对映体在各个组织中具有相似的降解速率,各个时间点的浓度相近。但是,在暴露初始阶段(1 h),肝和尾中A1对映体的浓度明显高于A2,随着代谢时间的延长(1~24 h),各个组织中A1的浓度都显著高于A2,而在代谢后期(24~48 h),A1和A2的浓度又趋于相等。产生这种现象的原因一方面可能是由于A2在蜥蜴组织中的代谢速率高于A1,导致其浓度下降更快,另一方面可能是A2对映体在蜥蜴体内被转换为A1,导致2种对映体的浓度产生差异。以往的研究已经发现,三唑醇作为三唑酮在生物体内的主要代谢物,在蜥蜴中存在手性转换的可能性[12]。Gao等[17]针对苯霜灵(benalaxyl)的研究发现,黄粉虫(Tenebriomolitor)单独暴露于S-benalaxyl和R-benalaxyl后都会发生明显手性转换,并且在暴露初期2种对映体浓度差异增加,而在后期又趋于相等。对映体结构不稳定性主要与碳原子得失质子难易状态有关[18],三唑醇A1和A2对映体之间的转换与苯霜灵对映体转换相似,主要与2个手性碳上氢的脱除和增加有关,不涉及其他电负性强的基团,同时由于卤代苯环、羟基和甲基等存在(图1),手性碳附近电子云密度不均匀,可能会降低氢原子脱除和添加的难度,这些均有利于A1和A2之间的转换。此外,在暴露后12 h,肝、肾、皮肤和尾中A1对映体的浓度出现二次上升,而其他对映体的浓度仍在下降,这可能是由于经过一段时间的代谢以后体内循环以A1对映体为主,在肝肠循环作用下被二次吸收,导致其浓度出现明显上升,而其他对映体的浓度较低,没有受到肝肠循环作用的明显影响。
2.2 三唑醇在丽斑麻蜥不同组织中的蓄积
将三唑醇外消旋体(100 mg·kg-1bw)长期暴露(28 d)于丽斑麻蜥后,三唑醇在蜥蜴体内各个组织的蓄积状况如图2所示。可以看出,三唑醇在性腺中无残留,在肾中仅A1对映体有少量残留(<1 mg·kg-1),大脑中4种对映体的浓度均低于1 mg·kg-1,肝脏中A1对映体(2.6 mg·kg-1)和A2对映体(4.0 mg·kg-1)的浓度明显高于B1和B2对映体(<1 mg·kg-1)。皮肤和尾中三唑醇对映体的浓度(18~140 mg·kg-1)明显高于其他组织,这说明皮肤和尾是主要的蓄积器官。一般来说,蜥蜴具有稳定的蜕皮周期,这种特性能够不断将皮肤中的有毒物质排除。蜥蜴的尾巴主要负责机体的运功和协调功能,远离肝脏和心脏等重要器官,并且可以断尾再生。因此,三唑醇蓄积在皮肤和尾巴中可能会最大程度降低它对机体的影响。虽然三唑醇在不同组织中的浓度有差异,但是可以看出在各个组织中A1与A2对映体浓度相近,B1与B2对映体浓度相近,这表明,三唑醇在各个组织中仍然维持外消旋状态,这与其他手性物质的研究结果相似,即手性物质在体内趋向于以外消旋状态稳定存在。
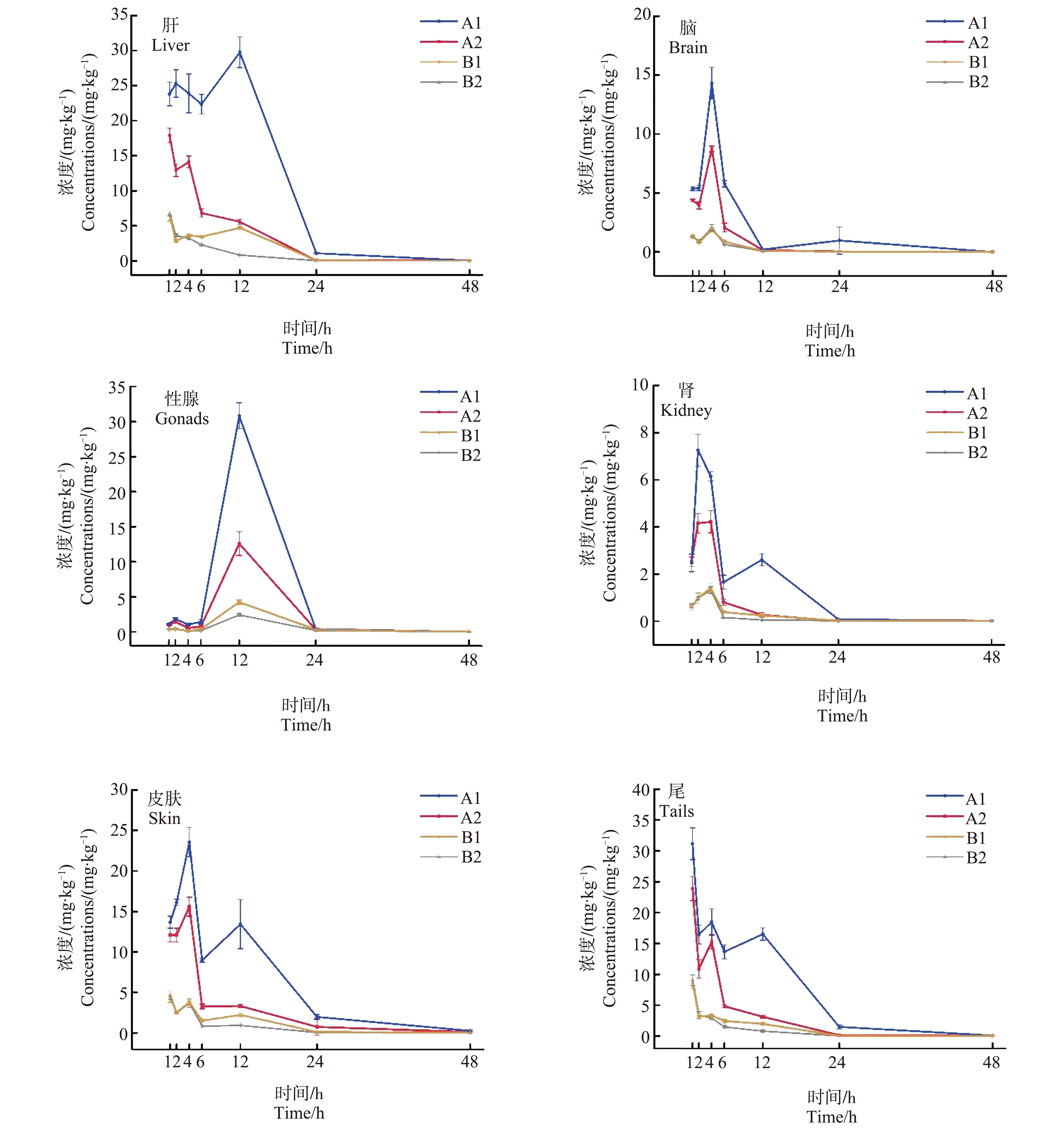
图1 三唑醇一次经口暴露(100 mg·kg-1 bw)后在雄性丽斑麻蜥各个组织内的代谢降解过程注:A1表示(R,S),A2表示(S,R),B1表示(R,R),B2表示(S,S)。Fig. 1 The degradation of triadimenol in different tissues of male Eremias argus after one-time exposure to 100 mg·kg-1·bw triadimenolNote: A1 represents (R,S); A2 represents (S,R); B1 represents (R,R); B2 represents (S,S).
2.3 三唑醇对丽斑麻蜥肝脏的影响
CYP450酶是肝中负责外源性物质代谢的最主要酶之一,其中,CYP1, 2和3家族参与了将近70%~80%外源性物质的代谢和转化[19]。AhR是一种重要的配体激活转录因子,可以介导多环芳烃类化合物的毒性反应,是二噁英类物质在体内的主要受体[20]。三唑类一般含有氯代苯环和三唑环,与二噁英类物质结构相似,研究发现,三唑酮和腈菌唑能刺激斑马鱼肝体内AhR受体的活性,说明三唑类物质可能与二噁英具有相似的毒性。
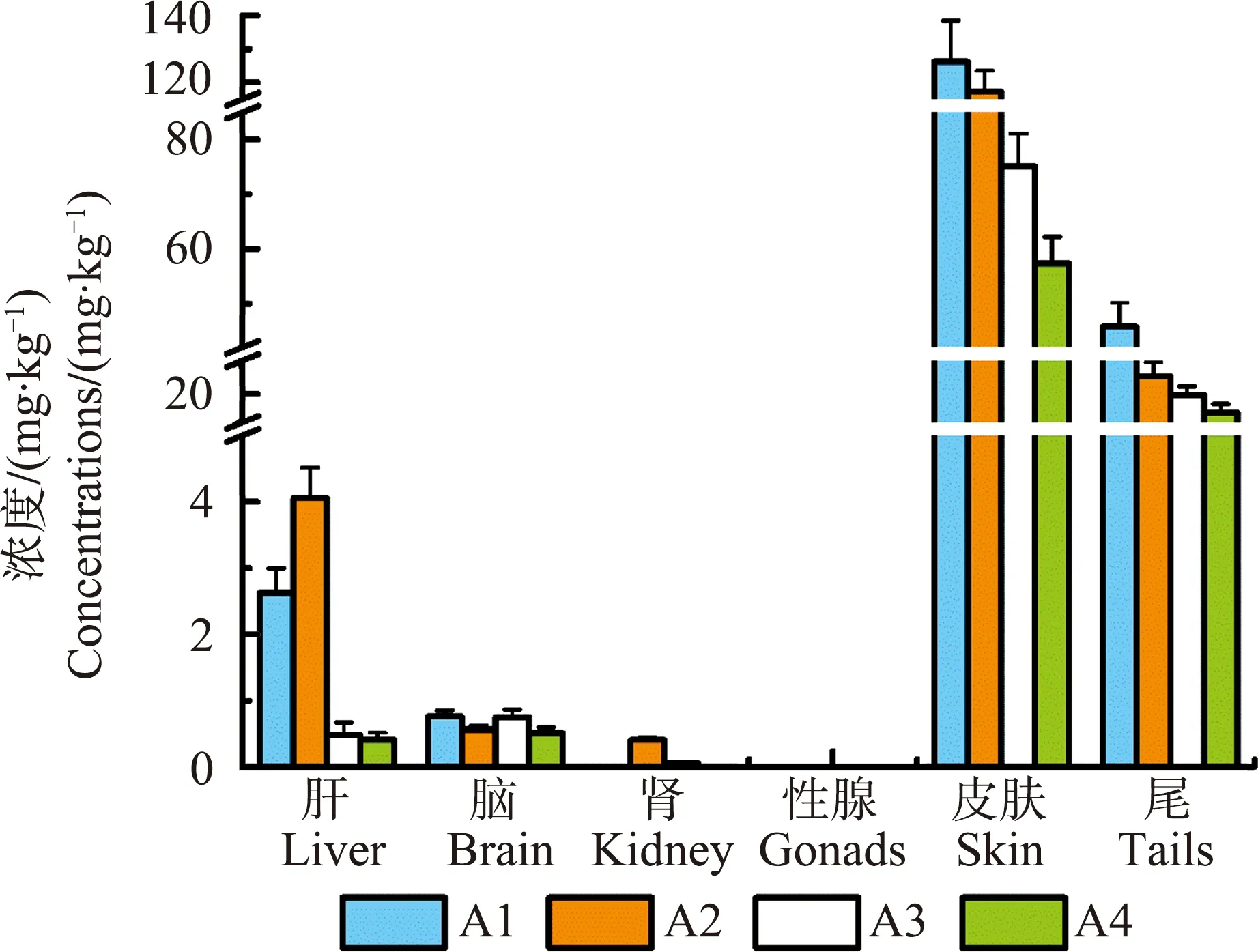
图2 三唑醇外消旋体(100 mg·kg-1 bw)暴露28 d后在雄性丽斑麻蜥体内的蓄积图Fig. 2 The bioaccumulation of triadimenol enantiomers in male Eremias argus after exposure to 100 mg·kg-1 bw triadimenol for 28 d
本实验中,如图3所示,雄性丽斑麻蜥暴露于三唑醇28 d后,肝中AhR基因的相对mRNA表达量无明显变化,说明三唑醇代谢不依赖AhR介导的信号通路,其在蜥蜴体内的代谢方式与二噁英类物质不同。三唑醇暴露后肝脏中cyp3a4和cyp2d3的表达量略有增加(分别为2.1倍和1.6倍),cyp1a1和cyp2b1的表达量显著增加(分别为4.8倍和6.0倍)。Sun等[21]将小鼠和大鼠暴露于氟康唑后发现了相似的结果,即肝脏中cyp2b和cyp2a家族基因的mRNA水平明显增高。Hester等[22]同样发现,将小鼠暴露于3种三唑类杀菌剂(环丙唑醇、氟环唑和丙环唑)30 d后,小鼠肝脏中多种CYP450酶和氧化应激相关基因表达量增加,并且出现肝细胞肥大、肝中维甲酸含量增加、血清中胆固醇含量减少等毒性效应。另外,CYP3A4酶主要负责将雄激素羟基化后失活,对维持体内雄激素稳定具有重要作用[23]。因此,三唑醇对肝脏中cyp3a4酶的诱导作用可能会导致体内雄激素的代谢速率增加,从而影响蜥蜴激素系统的稳定。Lv等[24]通过体外实验研究发现,5种常见的三唑类物质对CYP3A4的抑制作用与它们的抗雄激素活性具有明显的相关性。这些结果表明,三唑醇对肝中代谢酶基因的影响可能会导致肝功能异常,进而对机体产生一定的毒害作用。
肝组织病理学分析进一步揭示了三唑醇对肝组织的损伤,从图4可以看出,与空白对照组相比,三唑醇暴露组出现明显的组织空泡,并且在局部区域出现血窦阻塞现象(红圈内),这说明三唑醇对肝组织具有一定的毒性作用。综上所述,三唑醇在丽斑麻蜥体内的代谢降解和生物蓄积具有明显的对映选择性,能够诱导丽斑麻蜥肝中主要代谢酶的表达量增加,对肝组织具有一定的毒性作用。
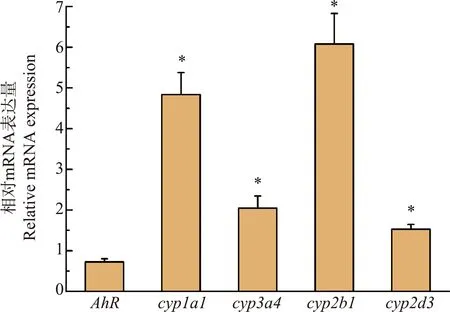
图3 三唑醇暴露(100 mg·kg-1 bw)28 d后雄性丽斑麻蜥肝脏中代谢相关基因的相对mRNA表达量注:*表示与对照组相比,具有显著性差异(P<0.05)。Fig. 3 The relative mRNA expression of metabolic genes in male Eremias argus liver after exposure to 100 mg·kg-1 bw triadimenol for 28 dNote: * indicate significant difference compared with control (P<0.05).
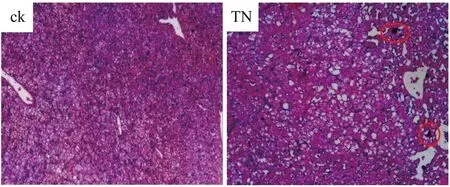
图4 三唑醇暴露(100 mg·kg-1 bw)28 d后雄性丽斑麻蜥肝组织病理学切片图(H&E染色)注:ck为空白对照组,TN为三唑醇暴露组。Fig. 4 The micrographs of male Eremias argus liver sections stained with H&E after exposure to 100 mg·kg-1 bw triadimenol for 28 dNote: ck, normal liver section from control group; TN, liver section from exposure group.
