氧化石墨烯遗传毒性的实验研究
2019-04-17韦慧吴超权夏星钟振国
韦慧,吴超权,夏星,钟振国,*
1. 广西中医药大学科学实验中心,南宁 530200 2. 广西食品药品检验所,南宁 530021
石墨烯(graphene)是由碳原子以sp2杂化方式形成的纳米晶体,是一种蜂窝状单层二维平面结构的新型纳米材料[1]。氧化石墨烯(graphene oxide, GO)是一种石墨烯的含氧衍生物,与石墨烯相比较,GO具有较大的表面积,良好的水分散性,更好的生物相容性,更强的表面活性[2]。GO独特的物理特性,使其在光电子[3]、太阳能电池[4]、水处理[5]、医学[6]、环境能源[7]及功能材料[8]等多个领域具有潜在的发展前景。GO能够广泛应用的重要前提是其具有可靠的生物安全性,而目前GO在生产、使用或废弃时进入自然环境后,是否存在生物安全性尚有争议。大多数研究者认为GO对细菌有毒性作用,但是在细胞和生物整体水平的毒性研究还存在分歧。GO与生物体之间的相互作用还不甚明确,如毒性、炎症反应、病理变化和体内清除等尚未有一致的结果[9]。GO的潜在致癌和致畸作用的评估,是对其安全性评价中极为重要的一环。已有研究发现,GO的遗传毒性指数表现为各种类型的染色体畸变,表现出剂量和时间依赖性,特别是在GO暴露时间长、剂量高时,染色体畸变显著增加[10]。但是目前对GO的遗传毒性的研究仍较为匮乏。笔者根据《纳米毒理学与安全性研究方法》[11],选用了Ames试验、体外CHL细胞染色体畸变试验和小鼠骨髓细胞染色体畸变试验进行GO的遗传毒性研究,考察其潜在的致突变作用,为GO的安全使用提供依据。
1 材料与方法(Materials and methods)
1.1 实验材料
氧化石墨烯(GO)棕黑色溶液,生产批号D160330C2A。由常州第六元素材料科技公司提供。取GO样品于121 ℃下高压灭菌30 min,无菌操作下加入超纯水稀释成相应浓度后超声2 h制备成稳定的水分散液,现配现用。
胰蛋白胨(批号:3206105)、琼脂粉(批号:3206098)均购自广东环凯微生物科技有限公司;D(+)-生物素(批号:20171123)、L-组氨酸(批号:20171013)和牛肉浸膏(批号:20171023)均购自国药集团化学试剂有限公司;冻干型S9混合液(批号:3480)购自Molecular Toxicology公司;1640培养基(批号:8118264)、胎牛血清(FBS)(批号:1620769)购自Gibco公司;Hank’s液(批号:20170623)、0.25%胰蛋白酶(批号:20170505)和吉姆萨染液(批号:20161229)均购自北京索莱宝科技有限公司;丝裂霉素(MMC)(批号:12/2017)、环磷酰胺(批号:12/2017)和秋水仙碱(批号:12/2017)均购自Roche公司;其他试剂为国产分析纯试剂。
1.2 实验仪器
HERAcell 150i型CO2培养箱(Thermo Scientific);DM500型倒置相差显微镜(LEICA);Infinite M200 PRO型酶标仪(瑞士帝肯);AC-4S1型生物安全柜(ESCO Class II BSC);HH-8型电热恒温水浴锅(国华电器有限公司);Neofuge23R型低温高速离心机(Heal Force)。
1.3 实验菌株
选用鼠伤寒沙门氏组氨酸缺陷型菌株TA-97a、TA-98、TA-100和TA-102进行试验。菌株均来源于中国典型培养物保藏中心,由广西食品药品检验所提供。按照试验要求,这些菌株经过组氨酸需求试验、结晶紫敏感试验、抗氨苄青霉素试验、抗四环素试验、紫外线敏感试验和自发回变试验鉴定,菌株基因型均符合试验要求。37 ℃震荡培养16 h,计数生长细菌不少于1×109cells·mL-1活菌方可使用。S9为体外代谢活化系统。
1.4 实验细胞
CHL细胞,来源于中国科学院昆明细胞库,由广西食品药品检验所提供。完全培养液为含10%小牛血清的1640,置37 ℃、5% CO2培养箱孵育。
1.5 实验动物
SPF级昆明雄性小鼠,体质量18~22 g,由广西食品药品检验所提供。实验动物许可证号:SYXK(桂) 2017-002。小鼠饲养于广西食品药品检验所SPF动物房,温度20~25 ℃,相对湿度55%±15%,换气次数10~20 次·h-1。
1.6 实验方法
1.6.1 Ames试验
将0.1 mL试验菌株增菌液、0.1 mL GO溶液和0.5 mL S9混合液(当需要代谢活化时)混合,混匀后倒入底层培养基平板上。设0.080、0.040、0.020、0.010和0.005 mg·mL-15个剂量组,同时设自发回复突变和阳性突变剂对照组,阳性对照药物如表1所示,每组3个平行皿,37 ℃培养48 h,计数各平板菌落数并算出均值,重复试验一次。
1.6.2 染色体畸变试验
根据前期用MTT法测GO对CHL的细胞毒性时发现,GO对细胞的半数抑制浓度,-S9组为0.415 mg·mL-1,+S9组为0.767 mg·mL-1。故+S9组加入1.000、0.500和0.250 mg·mL-1GO,而-S9组加入0.50、0.250和0.125 mg·mL-1GO,阴性对照(1640)和阳性对照(+S9:环磷酰胺0.020 mg·mL-1、-S9:丝裂霉素0.001 mg·mL-1)。置于CO2培养箱中培养24 h。终止培养前加入秋水仙碱(0.001 mg·mL-1)处理2 h。制片程序依次为:胰蛋白酶液消化;离心;低渗液低渗;固定液固定,离心;重复1次;滴片;干燥;10% Giemsa染色。各组观察100个中期分裂相细胞,计数其染色体畸变率。
1.6.3 小鼠骨髓细胞染色体畸变试验
将小鼠按体质量随机分为7组,每组10只。根据前期试验测得GO对小鼠的半数致死量(LD50)为6.364 mg·kg-1。分别设置为1.000、0.500、0.250和0.125 mg·kg-1GO共4个剂量组,同时设阴性对照和阳性对照组(环磷酰胺40 mg·kg-1),每周尾静脉注射(i.v.)一次,小鼠于28 d处死。各组动物处死前4 h腹腔注射秋水仙素(4 mg·kg-1)。处死后,取股骨,制备骨髓细胞染色体标本。每一处理组每只动物选择100个分散良好的中期分裂相细胞进行分析,分别记录各组染色体畸变类型和数目,计算畸变率。
1.7 统计学分析
采用SPSS 21.0软件进行统计学分析。统计描述采用x±s,多组间比较采用单因素方差分析,率间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果(Results)
2.1 GO的表征
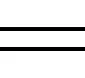
图1 氧化石墨烯(GO)的表征((a):TEM;(b):FTIR)Fig. 1 Characterization of graphene oxide (GO) ((a): TEM; (b): FTIR)
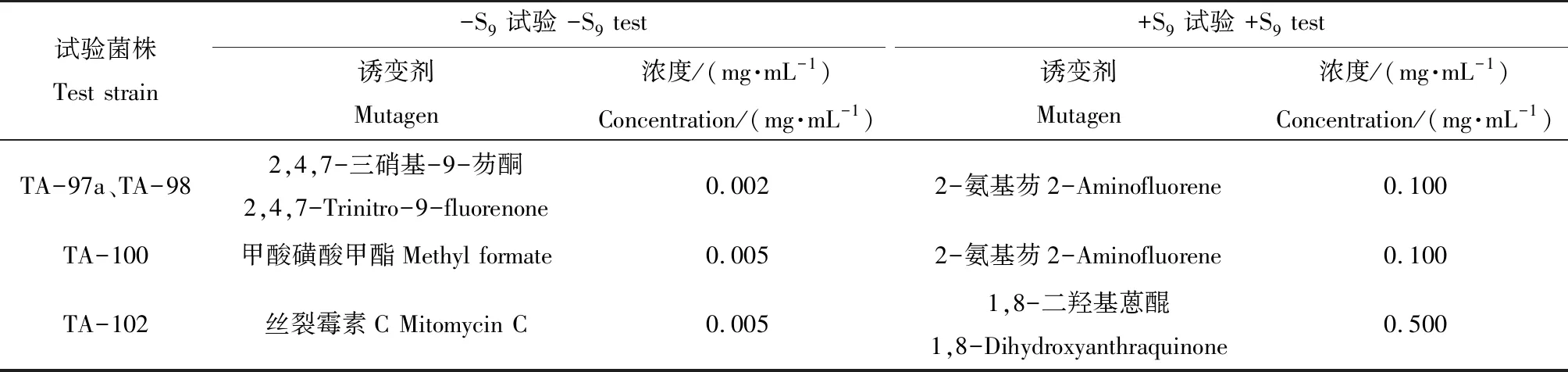
表1 Ames试验阳性对照药物Table 1 The positive control drug in Ames test
2.2 Ames试验检测GO的致突变作用
计算同一菌株同一剂量组的3个平行培养皿上的平均菌落数和标准差(表2),结果显示:无论是否添加S9活化体系,GO各剂量组对TA-97a、TA-98、TA-100和TA-102菌株的回变均无显著影响,各菌株回复突变菌落数均在正常范围内;各剂量组与阴性对照组的回复突变菌落数比较差异不显著(P>0.05),并且显著地低于阳性对照组的回复突变菌落数(P<0.01),Ames试验结果均呈阴性。
2.3 GO对CHL细胞的致突变作用
经S9活化体系处理(+S9)的GO染色体畸变结果如表3所示,通过卡方检验进行比较分析发现,随GO浓度的增加,CHL细胞染色体畸变率也升高,有明显的剂量-反应关系。其中,GO的+S9剂量组(1.000 mg·mL-1)与阴性对照组相比,畸变率显著升高(P<0.05)。
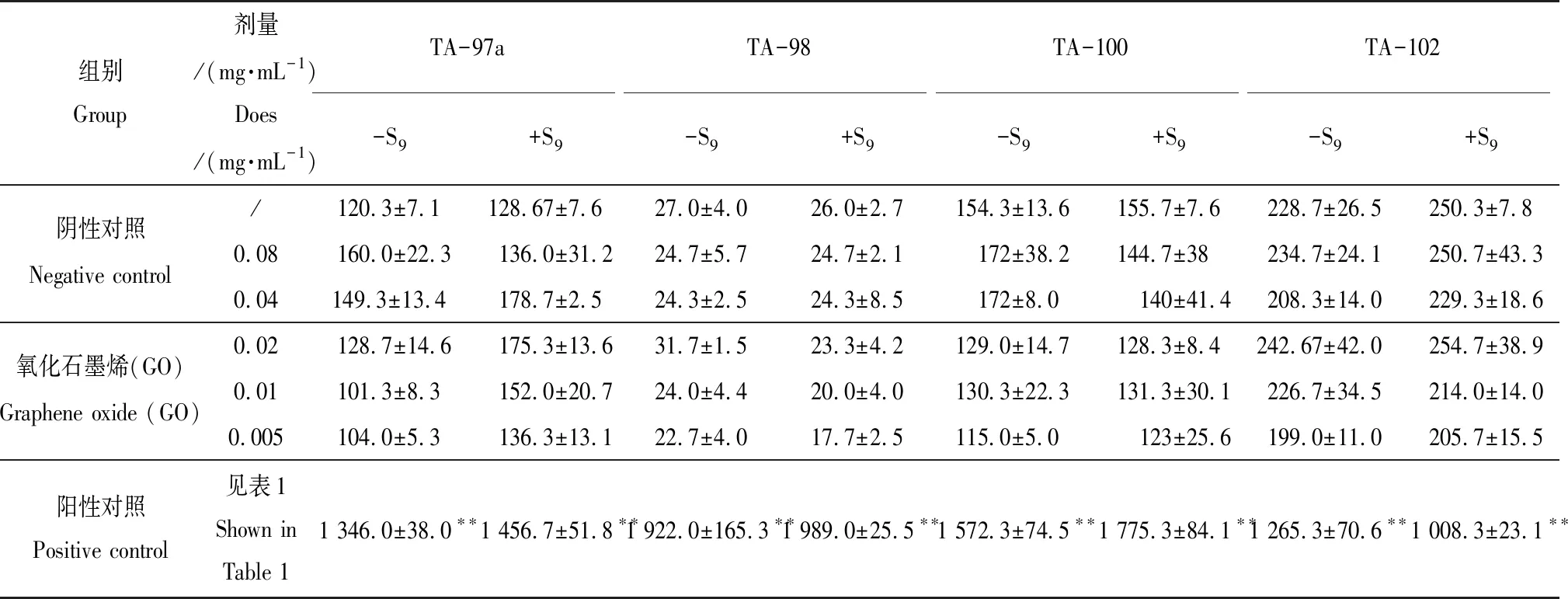
表2 GO的Ames试验结果Table 2 Ames test results of GO
注:-S9表示平皿中没有添加S9,+S9表示平皿中添加S9;与阴性对照组比较,**为差异显著(P<0.01)。
Note: -S9means S9was not added in the petri dish, and +S9means S9was added in the petri dish; compared with the negative control group, ** showed a significant difference (P<0.01).
注:与阴性对照组比较,*为差异显著(P<0.05)。
Note: Compared with the negative control group, *showed a significant difference (P<0.05).
未经S9活化体系处理(-S9)的GO染色体畸变结果如表4所示。随GO浓度的增加,CHL细胞染色体畸变率也升高,有明显的剂量-反应关系。其中,0.500 mg·mL-1剂量组与阴性对照组相比,畸变率显著升高(P<0.05)。
GO致CHL细胞染色体畸变类型如图2所示。染色体的断裂,可进一步造成染色体的缺失或各种重排,由此而产生的染色体结构异常称为染色体结构畸变。正常CHL细胞染色体未见明显突变(图2(a));1.000 mg·mL-1GO组出现染色体断裂(图2(b));0.500 mg·mL-1GO组出现染色体粉碎化(图2(c));0.125 mg·mL-1GO组出现染色体缺失(图2(d));阳性组出现染色体交换、多倍体及环状染色体(图2(e))。染色体结构畸变观察表明,GO引起的染色体畸变类型主要为断裂和缺失。
2.4 GO对小鼠骨髓细胞染色体的致畸变作用
骨髓细胞染色体畸变试验结果如表5所示。通过卡方检验进行比较分析发现,1.000 mg·kg-1剂量组细胞畸变率与阴性对照组相比,畸变率显著升高(P<0.01),0.500 mg·kg-1剂量组细胞畸变率显著高于阴性对照组(P<0.05)。0.250和0.125 mg·kg-1剂量组细胞畸变率均略高于阴性对照组,但与阴性对照组的差异不显著(P>0.05)。
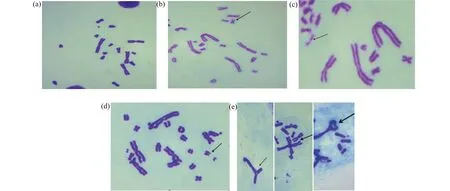
图2 GO致CHL细胞染色体畸变图注:(a). 阴性对照组CHL细胞染色体;(b). 1.000 mg·mL-1 GO组染色体断裂;(c). 0.500 mg·mL-1 GO组染色体粉碎化;(d). 0.125 mg·mL-1 GO组染色体缺失;(e). 阳性组染色体交换、多倍体、环状染色体;Giemsa染色,×100。Fig. 2 Chromosome aberration diagram of CHL cells induced by GONote: (a). normal CHL cell chromosome; (b). 1.000 mg·mL-1 GO group chromosome break; (c). 0.500 mg·mL-1 GO group chromosome pulverization; (d). 0.125 mg·mL-1 GO group chromosome deletion; (e). positive group chromosome exchange, polyploidy and circular chromosome; Giemsa staining, ×100.
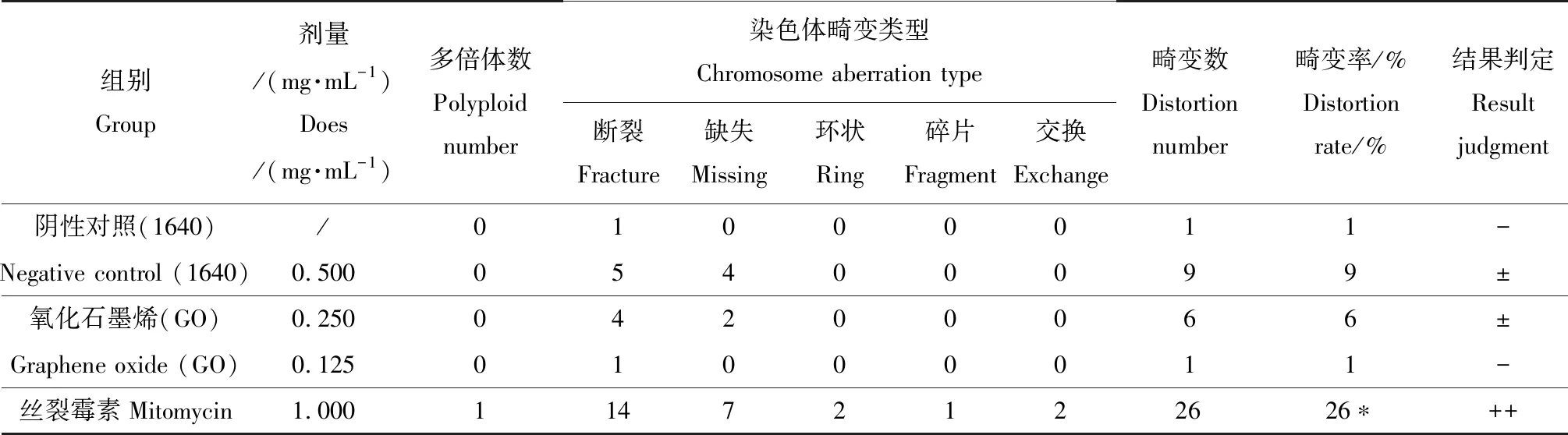
表4 GO对CHL细胞染色体畸变的影响(-S9,24 h)Table 4 Effect of GO on chromosomal aberrations in CHL cells (-S9, 24 h)
注:与阴性对照组比较,*为差异显著(P<0.05)。
Note: Compared with the negative control group, * showed a significant difference (P<0.05).
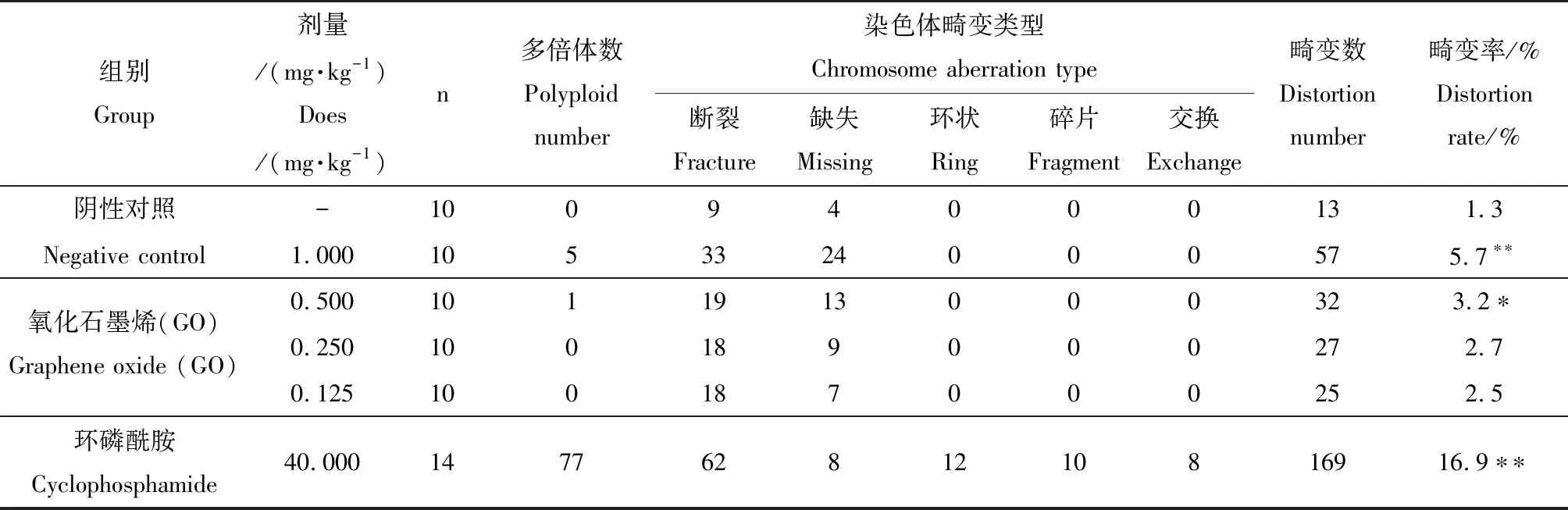
表5 GO对小鼠骨髓细胞染色体畸变率的影响Table 5 Effect of GO on chromosome aberration rate of mouse bone marrow cells
注:与阴性对照组比较,*为差异显著(P<0.05),**为差异显著(P<0.01)。
Note: Compared with the negative control group, *showed a significant difference (P<0.05); *showed a significant difference (P<0.01).
GO致小鼠骨髓细胞染色体畸变类型如图3所示。阴性对照组小鼠骨髓细胞染色体未见明显畸变发生(图3(a));1.000 mg·kg-1GO组出现染色体缺失(图3(b));0.500 mg·kg-1GO组出现染色体断裂(图3(c));环磷酰胺组出现染色体粉碎、交换和多倍体染色体(图3(d))。染色体结构畸变观察表明,GO所致染色体畸变类型以染色体断裂为主。
3 讨论(Discussion)
GO独特的理化性质及其与生物体相互作用特性为其提供了广泛的应用前景,它的安全性评价成为研究的热点[12]。目前,关于GO毒性的研究主要集中在其细胞毒性方面。大量体外研究发现,GO通过以下几种途径产生毒性:通过与细胞膜脂质双层的相互作用或由于生物分子的吸附而产生的间接毒性;产生活性氧物质或直接物理毒性,促进细胞毒性;由于疏水表面,石墨烯可以与细胞膜脂质显著相互作用,引起细胞毒性[13]。此外,GO的细胞毒性与其自身的物理化学性质(大小、形状和表面官能团等)、作用的细胞种类以及作用浓度等有着密不可分的关系[14]。Zhang等[15]通过放射性元素给GO做标记,并使用放射性示踪法研究小鼠体内的GO的代谢和分布。注射10 mgkg-1GO到小鼠后发现,其通过血液循环大量积聚在肺,其次分布在肝中,保留时间较长,同时观察到炎症细胞浸润,肉芽肿和肺水肿的形成[14]。遗传毒性试验主要用于致癌性预测,而目前在体外细胞水平上的GO遗传毒性研究少有报道。如Chng和Pumera[16]研究发现,GO能诱导人肺成纤维HLF细胞的氧化应激反应,细胞毒性呈现浓度依赖性,尾长和尾DNA百分比的增加揭示出GO具有遗传毒性。Stueckle等[17]的彗星试验结果表明,nano-GO诱导肺部细胞(A549)的DNA损伤有很大作用。Mohamed等[18]发现,GO可以引起DNA的迁移,引起DNA损伤,导致DNA片段化。Bengtson等[19]将单次气管内暴露于GO和还原氧化石墨烯(rGO)后,发现GO和rGO分别在不同时间点可诱导肺、肝DNA损伤。此外,非片层结构的石墨烯同样被发现有一定的遗传毒性,如Kim等[20]采用Ames试验、体外染色体畸变试验和小鼠骨髓微核试验对单臂碳纳米管(SWCNT)的遗传毒性进行检测。结果显示,Ames试验未发现细菌回变现象,微核试验结果为阴性,体外染色体畸变试验为阳性且额外观察到了细胞增殖抑制现象,故认为SWCNT的遗传毒性为弱阳性。可见GO及在其基础上进一步衍生化的石墨烯类材料的遗传毒性不容忽视。
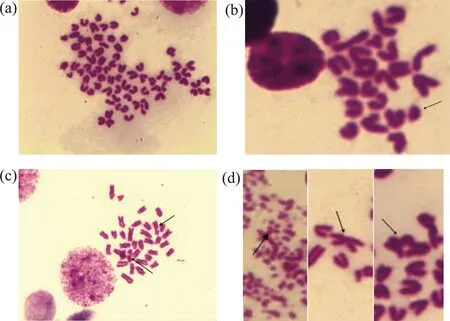
图3 GO致小鼠骨髓细胞染色体畸变图注:(a). 小鼠骨髓细胞正常染色体;(b). 1.000 mg·kg-1 GO组染色体断裂;(c). 0.500 mg·kg-1 GO组染色体缺失;(d). 环磷酰胺组染色体粉碎、交换、多倍体染色体;Giemsa染色,×100。Fig. 3 Chromosome aberrations of mouse bone marrow cells induced by GONote: (a). mouse bone marrow cells normal chromosome; (b). 1.000 mg·kg-1 GO group chromosome break; (c). 0.500 mg·kg-1 GO group chromosome deletion; (d). cyclophoshamide group chromosome smashing, chromosome exchange and ploidy chromosome; Giemsa staining, ×100.
Ames从基因水平上反映了遗传物质受损伤情况;染色体畸变的产生与染色体断裂及纺锤体受损有关。依据《纳米毒理学与安全性研究方法》[11],针对遗传物质作用终点的不同,并兼顾体外和体内试验的配套原则,笔者采用Ames试验、CHL细胞染色体畸变试验和小鼠骨髓细胞染色体试验,综合分析这3种试验的结果,以研究GO的致突变作用。本研究结果显示,不管是否加入活化系统(S9),GO各剂量组对TA-97a、TA-98、TA-100和TA-102这4种菌株回复突变菌落数的影响均在正常范围内,与阴性对照组相比无显著性差异,提示GO在体外Ames试验中无致突变作用。但是在细胞水平和体内水平的染色体畸变试验中,随着GO浓度的增加,染色体畸变率显著升高,有明显的剂量-反应关系,提示GO在体内外的染色体畸变试验中具有潜在的遗传毒性。已有研究发现,与啮齿类动物肿瘤相关度最高的传统Ames试验无法有效检出纳米粒子的潜在致突变性,而体外微核试验、染色体畸变试验及彗星试验却通常可以得到阳性结果[21]。这与本研究结果一致,即GO的Ames致突变性试验结果呈阴性,但染色体畸变试验结果却呈阳性。进一步分析导致Ames试验无法准确评价纳米粒子的致突变作用的原因可能在于:(1)传统的Ames试验使用固态培养基,培养基为碱性环境,固态且带大量负电荷的培养条件限制细菌与纳米粒子充分接触;(2)菌壁与哺乳动物细胞壁有差异,加之革兰氏阴性菌的菌壁较厚,可导致纳米材料不易穿透胞壁,与细菌接触不充分,限制纳米粒子被细胞摄取;(3)另外,有些纳米材料具有一定的灭菌作用[22]。
目前没有任何单一的试验方法可同时涵盖所有遗传终点。为全面考察GO的潜在遗传毒性风险,通常需开展一系列机制上互相补充的试验,对GO的遗传毒性及其作用机制,可进一步研究和探讨。
