TLR4介导小鼠小胶质细胞自噬在脑出血后炎症反应的作用机制研究
2019-04-17,,,,,,,,,
,,, ,,,,,,
脑出血是指非外伤性脑实质内血管破裂引起的出血,占全部脑卒中的20%~30%,急性期病死率为30%~40%,发生的原因主要与脑血管病变有关[1]。脑出血在我国的发病率逐年上升,其具有较高的伤残率,已严重影响病人的生活质量和生命健康。因此,深入研究脑出血的发病机制以及脑出血的新治疗靶点具有重要的临床意义。对于脑出血的机制研究,多数研究都是关注血管内皮细胞,对小胶质细胞的研究较少。目前有少量研究结果表明,小胶质细胞介导的自噬反应对脑出血后的炎症损伤起着非常重要的作用[2]。适当激活小胶质细胞时,可促进脑损伤的自动修复,但小胶质细胞过度活化时,将可能加重损伤[3]。小胶质细胞自噬的发生与脑出血炎症损伤息息相关。有少量研究表明,TLR4相关信号通路,即TLR4/ MyD88/核转录因子(NF-κB)信号通路参与调控小胶质细胞自噬、炎症损伤等多个方面[4]。但关于TLR4介导的小胶质细胞自噬在脑出血炎症损伤中作用的研究较少。因此,本研究探讨TLR4介导小胶质细胞自噬在脑出血后炎症反应的作用及机制。
1 材料与方法
1.1 试剂和仪器 C57BL/6J小鼠购于北京维通利华实验动物技术有限公司;二抗购自碧云天公司;肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)检测试剂盒购自南京建成生物工程研究所;Trizol试剂盒、逆转录试剂盒、PCR扩增试剂盒均购自坦克拉公司;质粒及配套转染配套试剂均购自广州RiboBio公司。TGL-16G-A型高速冷冻离心机(上海安亭科学仪器厂);流式细胞仪(美国BD公司);7300型实时荧光定量PC电子天平R仪(美国Applied Biosystems公司);基础电泳仪(美国Bio-Rad公司);EL204(上海特勒-托多利多仪器有限公司);凝胶成像仪(美国Bio-Rad公司);电泳仪(北京六一仪器厂)。
1.2 方法
1.2.1 原代小胶质细胞分离、培养、鉴定 C57BL/6小鼠饲养在SPF级动物实验室,12 h/12 h昼夜循环光照,温度为(22±2)℃。适应性喂养1周后,处死小鼠,迅速进行手术开脑,保留前脑组织,取C57BL/6小鼠前脑组织,研磨后提取分离原代小胶质细胞。加入含20%胎牛血清的DMEM高糖培养基37 ℃、5%CO2条件下培养,取对数生长期细胞用于后续实验。采用免疫组化鉴定,具体操作参考文献[5]。
1.2.2 实验分组
1.2.2.1 分组1 A组:小胶质细胞;B组:小胶质细胞+阴性siRNA转染;C组:小胶质细胞+TLR4-siRNA转染。Q-PCR和Western Blot检测分组1中TLR4的表达。
1.2.2.2 分组2 D组:小胶质细胞+等量的对照溶剂(0.9%NaCl);E组:小胶质细胞+自噬抑制剂(3-MA);F组:小胶质细胞+control-siRNA+自噬抑制剂(3-MA);G组:小胶质细胞+TLR4-siRNA+等量的对照溶剂(0.9%NaCl);H组:小胶质细胞+TLR4-siRNA+自噬抑制剂(3-MA)。Western Blot检测LC3-Ⅱ/Ⅰ比值、TLR4、MyD88和NF-κB蛋白表达。
1.2.3 转染及流式鉴定[6]参照GenBank数据库提供的TLR4基因序列,选择对TLR4基因编码区具有干扰效应的1个siRNA和阴性对照siRNA。TLR4-siRNA序列正义链:5′-UUCGAGACUGGACAAGCCA-3′;反义链:5′-UGGcuuGuCcAGucucGAAn-3′,阴性对照siRNA正义链:5′-UUCUCCGAACGUGuCACGUTT-3′;反义链:5′-ACGUGACACGUUCGGAGAATI-3′。对于siRNA在小胶质细胞中的转染效率,采用FAM荧光探针标记法检测。按说明书操作进行转染,转染24 h后,采用胰蛋白酶对细胞进行消化,1 000 r/min离心5 min,采用磷酸缓冲盐溶液(PBS)进行细胞洗涤2次,离心,弃上清液,再用PBS吹打细胞成单细胞悬液,稀释细胞密度为1×106个/mL,FAM表达阳性率的检测采用流式细胞仪,其FAM表达阳性率为(93±5)%。
1.2.4 Q-PCR检测分组1中TLR4的表达 根据Trizol试剂盒提取组织总RNA,采用核酸测定仪测定RNA纯度和浓度,取1 μg进行逆转录,生成cDNA。采用SYBR green染料法进行定量检测,TLR4及GAPDH(内参)扩增引物序列如下:TLR4上游引物5′-CTGCAGAGCATGGACTCGTC-3′,下游引物5′-CCGTTGAAGAGAGTGGAGTG-3′;GAPDH上游引物5′-CCTAGTTCGTCATGGGTGTGAACCA-3,下游引物5′-GCCAGTAGAGGCAGGGATGATGTTC-3,扩增条件及计算方法参考文献[7]。
1.2.5 Western Blot检测分组1中TLR4的表达[8]常规方法提取组织总蛋白,二喹啉甲酸(bicinchoninic acid,BCA)方法测定蛋白质含量后进行凝胶电泳,每孔上样20 μg,电转至聚偏氟乙烯薄膜(polyvinylidene fluoride,PVDF)上后,3%的脱脂奶封闭2 h,分别孵育TLR4(目的蛋白)和GAPDH(内参蛋白)一抗,4 ℃孵育过夜,TBST洗膜,孵育二抗后显影。采用Quantityone软件对条带亮度进行分析。
1.2.6 Western Blot检测分组2中LC3-Ⅱ/Ⅰ比值、TLR4、MyD88、TRIF和NF-κB蛋白表达 Western Blot操作步骤同1.2.5项,孵育LC3-Ⅱ/Ⅰ、TLR4、MyD88、TRIF和NF-κB(目的蛋白)和GAPDH(内参蛋白)一抗,4 ℃孵育过夜,TBST洗膜,孵育二抗后显影。采用Quantityone软件对条带亮度进行分析。
1.2.7 ELISA检测分组2中细胞因子TNF-α、IL-1β、IL-6水平 取对数生长期的小胶质细胞接种于96孔培养板中,24 h贴壁后进行实验。实验分组与给药方法参照分组2情况,继续培养24 h,取细胞上清液,采用ELISA试剂盒检测细胞因子TNF-α、IL-1β、IL-6水平。

2 结 果
2.1 Q-PCR和Western Blot检测分组1中TLR4的表达情况 A组和B组TLR4 mRNA和蛋白表达水平无明显变化,差异无统计学意义(P>0.05);与B组相比,C组TLR4 mRNA和蛋白表达水平下调,差异有统计学意义(P<0.05)。详见图1。

与B组相比,*P<0.05图1 Q-PCR和Western Blot检测分组1中TLR4的表达
2.2 Western Blot检测分组2中LC3-Ⅱ/Ⅰ比值、TLR4、MyD88和NF-κB p65蛋白水平 D组、E组和F组TLR4、MyD88和NF-κB p65蛋白水平无明显变化,差异无统计学意义(P>0.05);与D组相比,G组TLR4、MyD88和NF-κB p65蛋白水平下调,差异有统计学意义(P<0.05);H组与F组相比,TLR4、MyD88和NF-κB p65蛋白水平下调,差异有统计学意义(P<0.05)。E组和F组LC3-Ⅱ/Ⅰ比值无明显变化,差异无统计学意义(P>0.05);与F组、G组相比,H组LC3-Ⅱ/Ⅰ比值下降,差异有统计学意义(P<0.05)。详见图2。
2.3 ELISA检测分组2中TNF-α、IL-1β、IL-6情况 E组和F组TNF-α、IL-1β、IL-6表达水平无明显变化,差异无统计学意义(P>0.05);与F组相比,H组TNF-α、IL-1β、IL-6表达水平下调,差异有统计学意义(P<0.05);与G组相比,H组TNF-α、IL-1β、IL-6表达水平下调,差异有统计学意义(P<0.05)。详见表1。
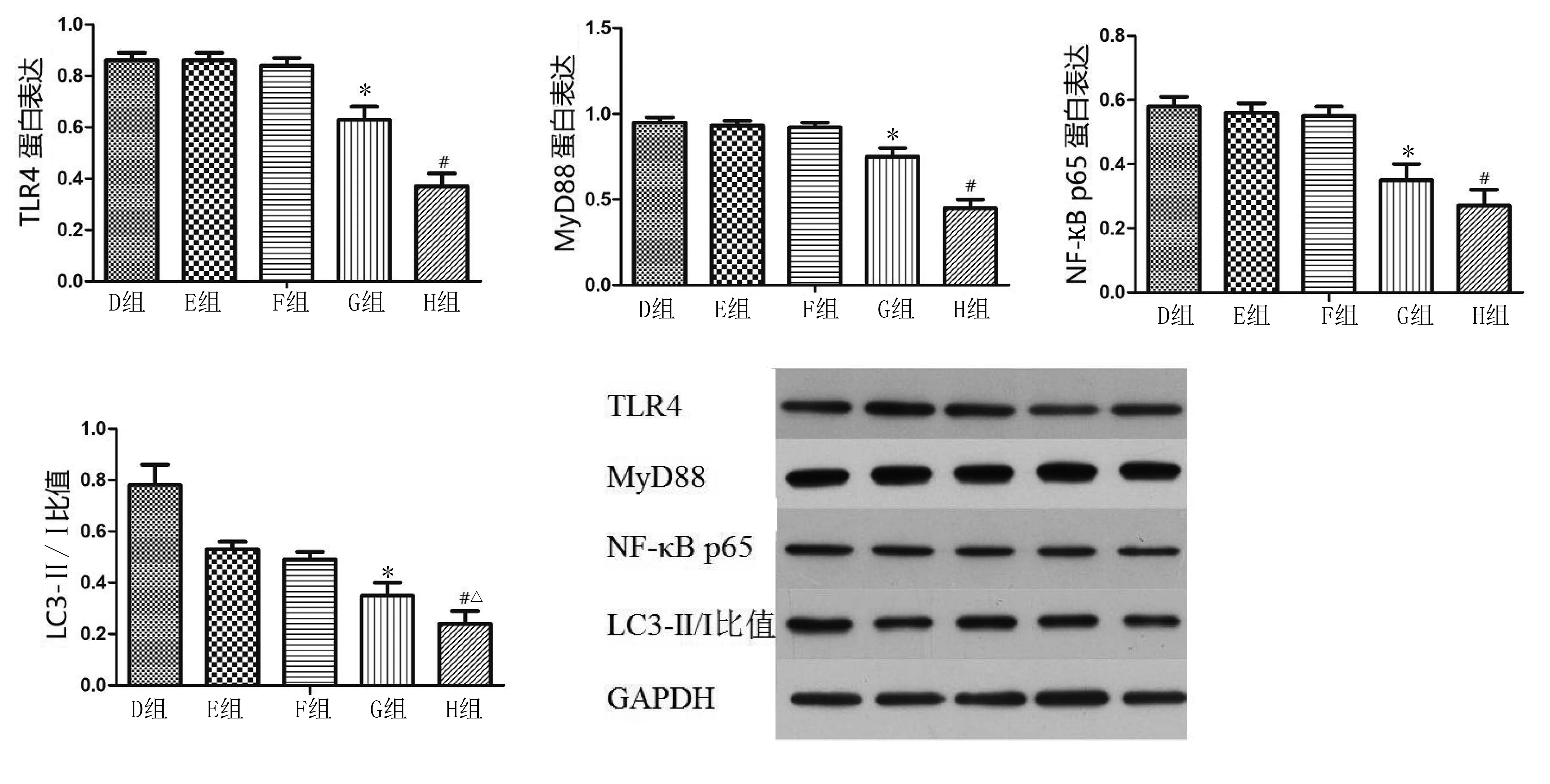
与D组相比,*P<0.05;与F组相比,#P<0.05;与G组相比,△P<0.05图2 Western Blot检测分组2中LC3-Ⅱ/Ⅰ比值、TLR4、MyD88和NF-κB p65蛋白水平

与F组相比,1)P<0.05;与G组相比,2)P<0.05
3 讨 论
脑出血在我国的发病率逐年上升,其具有较大的伤残率,已严重影响病人的生活质量和生命健康。因此,深入研究脑出血的发病机制以及研究脑出血的新治疗靶点具有重要的临床价值和科学意义。对于脑出血的机制研究,目前有少量研究结果表明,小胶质细胞介导的自噬反应对脑出血后的炎症损伤起着非常重要的作用[9-11]。适当激活小胶质细胞时,可促进脑损伤的自动修复,但小胶质细胞过度活化时,将可能加重损伤[12-13]。小胶质细胞自噬的发生与脑出血炎症损伤息息相关。有研究表明, TLR4与小胶质细胞自噬以及炎症反应密切相关[14-16]。TLR4是目前研究较多的 TLRs 家族成员。TLR4 在外源性或者内源性配体的刺激作用下,主要有两条信号通路,这两条信号通路分别是 MyD88 依赖途径和 MyD88 非依赖途径。在 MyD88 依赖途径中,活化的 TLR4 的胞内区与下游 MyD88 的羧基端结合,激活下游 NIK(NF-κB 诱导激酶),接着激活下游 IκB,最终激活NF-κB,而NF-κB p65是这条通路的重要蛋白,故 MyD88 依赖途径即 TLR4/ MyD88/NF-κB 信号通路参与调控小胶质细胞自噬、炎症损伤等多个方面[17-20]。但关于TLR4介导的小胶质细胞自噬在脑出血炎症损伤中的作用的研究较少。
本研究结果表明,TLR4受到抑制后,小胶质细胞内TLR4含量显著降低。给予小胶质细胞自噬抑剂(3-MA)处理后,细胞内TLR4及其下游MyD88、NF-κB p65含量并无明显变化,而给予TLR4-siRNA+3-MA处理小胶质细胞后,细胞内TLR4、MyD88、NF-κB p65及下游相关炎症因子TNF-α、IL-1β、IL-6水平均明显降低,说明抑制细胞内TLR4表达后,可有效阻止下游TLR4/ MyD88/NF-κB 信号通路的信号传递和表达,调节细胞相关的炎症损伤。同时,使用自噬抑制剂3-MA后,小胶质细胞自噬水平下降,LC3-Ⅱ/Ⅰ比值降低,细胞自噬相关信号通路表达被抑制,减弱细胞内炎性损伤,即细胞内炎症因子TNF-α、IL-1β、IL-6水平亦降低。
综上所述,TLR4-siRNA可抑制TLR4介导的小胶质细胞自噬,从而减轻自噬引起的脑出血炎症损伤。
