七氟醚预处理对高糖诱导的人脐静脉内皮细胞损伤的保护作用
2019-04-17,,
,,
近年来,糖尿病的发病率逐年增高,血管并发症是糖尿病致死致残的主要原因。而血管内皮功能损伤是糖尿病血管病变发生的始动因素和主要病理生理学基础,甚至在尚未出现慢性血管并发症的糖尿病病人已出现内皮功能明显降低。高血糖可以通过多种机制损伤血管内皮细胞功能,如氧化应激、炎症、蛋白质非酶糖基化、继发性脂代谢紊乱等[1]。近期研究发现新型麻醉药七氟醚有心血管保护作用。本研究对体外培养的人脐静脉内皮细胞(HUVECS)进行高浓度葡萄糖处理,模拟糖尿病体内环境,通过检测细胞凋亡率观察内皮细胞的损伤情况及七氟醚对受损内皮细胞的保护作用,并从细胞增殖、凋亡与抗凋亡以及内皮型一氧化氮合酶(eNOS)表达改变及超氧化物歧化酶(SOD)抗氧化等多个角度探讨其作用机制。
1 材料与方法
1.1 主要试剂 细胞培养试剂均购自Gibco公司,人脐静脉内皮细胞由山西医科大学第一医院提供,七氟醚免疫细胞化学试剂盒购自博士德公司。
1.2 原代人脐静脉内皮细胞鉴定 人脐静脉内皮细胞培养在含10%胎牛血清RPMI1640培养基中,37 ℃,5%CO2培养。人脐静脉内皮细胞密度达到70%左右时在倒置显微镜下摄片观察细胞形态,用兔抗人Ⅷ因子相关抗原(Ⅷ因子RAg)多克隆抗体进行。
1.3 实验分组 人脐静脉内皮细胞生长至70%~80%融合时,分为4组:正常糖浓度组(A组,5.5 mmol/L葡萄糖)、高葡萄糖组(B组,25 mmol/L葡萄糖)、甘露醇组(C组,5.5 mmol/L葡萄糖+19.5 mmol/L甘露醇)、高葡萄糖(25 mmol/L葡萄糖)+七氟醚组(D组)。处理72 h后用于后续实验。
1.4 MTT法检测各组细胞的存活率 以每孔100 μL(细胞数1×104)将细胞接种于 96孔板,每组12复孔。37 ℃,5%CO2培养48 h后,吸去培养液,每孔加0.1 mL磷酸缓冲盐溶液(PBS)和10 μL MTT溶液,37 ℃,5% CO2条件下培养4~6 h,每孔加0.1 mL二甲基亚砜(DMSO),酶联检测仪测定A570。实验重复3次。根据以下公式计算各实验组的存活率:存活率=(实验组OD-空白组OD)/(对照组OD-空白组OD)
1.5 流式细胞术碘化丙啶(PI)/Annexin双染法检测细胞凋亡 各组细胞胰蛋白酶消化后离心,弃上清,加入200 μL Binding Buffer并重悬细胞,然后加入10 μL Annexin V-FITC和5 μL PI,混匀,避光室温反应15 min。使用流式细胞仪检测细胞凋亡情况。实验重复3次。
1.6 RT-PCR测定细胞中eNOS mRNA的表达 取各组细胞5×106,Trizol一步法分别提取细胞总RNA,取2 μg总RNA用AMV逆转录酶进行逆转录,PCR扩增eNOS,设计eNOS基因特异引物为F:5′-CTCATGGGCACGGTGATG-3′;R:5′-ACCACGTCAACTCCCATACAC-3′;扩增DNA片段为152 bp,同时扩增人GAPDH作为内参照,GAPDH的基因特异引物为F:5′-AACAGCGACACCATCCTC-3′;R: 5′-CATACCAGGAAATGAGCTTGACAA-3′,扩增DNA片段为85 bp;循环条件:预变性 95 ℃2 min,变性94 ℃1 min,退火55 ℃2 min,延伸72 ℃90 s,循环35次。PCR产物经1.5%琼脂糖凝胶电泳分离,紫外灯下观察并拍照。BIO RAD Molecular Imager Gel Doc XR 170-8171型紫外凝胶图像成像分析系统成像,应用Quantity One软件进行积分吸光度测定及半定量分析,目的基因mRNA 的相对表达水平用IA/ IAβ - actin值来表示。
1.7 ELIAS检测SOD含量 取细胞各5×104接种于12孔板,每24 h收集培养上清(-70 ℃冻存),更换新鲜培养液,连续7 d,用SOD SELISA试剂盒检测培养上清SOD中的活性。具体过程操作步骤按试剂盒说明书进行,比色时测定管的吸光度值低于对照管的吸光度值,通过公式计算可求出被测样品中的SOD 活力。
1.8 蛋白免疫印迹 各组细胞分别提取蛋白,BCA定量分别得出样品蛋白浓度。配制分离胶和浓缩胶,调整蛋白上样浓度一致,100 V,2 h电泳,随后按照1.5 A/cm2选择恒流转膜1.5~2.0 h。将聚偏二氟乙烯膜(PVDF)浸泡在含5%脱脂奶粉的TBST中,室温封闭1 h,一抗4 ℃孵育过夜,隔天按照说明书比例室温孵育二抗1~2 h,随后用凝胶成像仪进行发光并记录灰度值。
2 结 果
2.1 光镜下形态学观察 B组、C组、D组处理72 h后细胞形态均发生不同程度变化,长轴变长,呈梭形者增多。详见图1。

图1 各组内皮细胞光镜下形态(×400)
2.2 细胞存活率检测 B组内皮细胞存活率显著低于A组(P<0.05),D组细胞存活率较B组显著增加(P<0.01),C组与A组比较差异无统计学意义(P>0.05)。详见图2。
2.3 流式细胞术检测细胞凋亡率 A组:常规培养的人脐静脉内皮细胞早期凋亡率为5.54%,晚期凋亡率为11.01%,细胞死亡率为16.55%。B组:早期凋亡率为6.16%,晚期凋亡率为15.06%,细胞死亡率为21.26%。C组早期凋亡率为12.02%,晚期凋亡率为24.83%,细胞死亡率为36.85%。D组:早期凋亡率为10.68%,晚期凋亡率为36.18%,细胞死亡率为46.86%。B组和D组细胞凋亡率较与A组均有所增加(P<0.05)。详见图3。
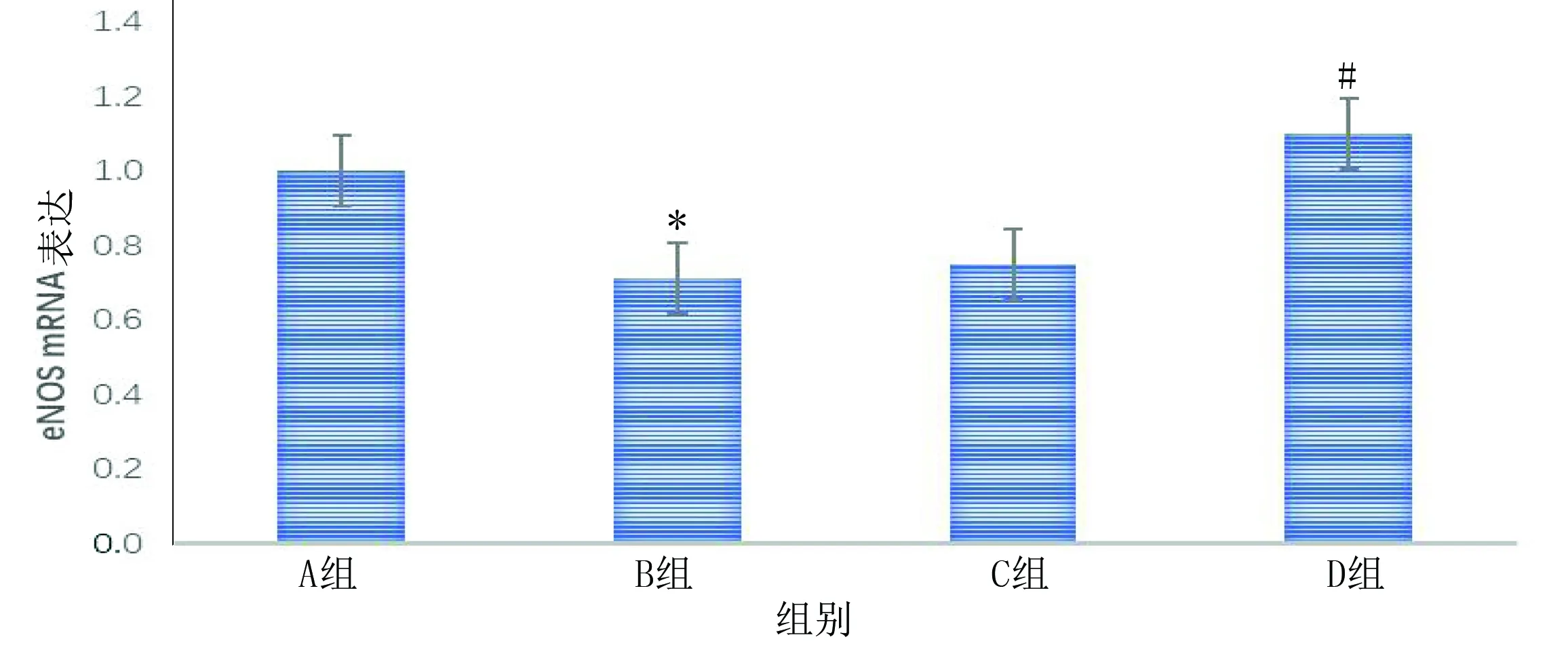
2.4 RT-PCR测定细胞中eNOS mRNA的表达 灰度分析表明,B组高葡萄糖浓度处理72 h后eNOSmRNA表达量明显降低,与A组比较差异有统计学意义(P<0.05);D组eNOSmRNA表达量高于B组(P<0.05)。详见图4。
2.5 SOD活性检测 A组、B组、C组、D组细胞的SOD活性分别为(223.95±4.67) U/mgprot、(229.67±4.56)U/mgprot、(147.12±2.64)U/mgprot、(183.97±4.67)U/mgprot。与B组比较,C组SOD活性明显降低(P<0.05),七氟醚处理后SOD有回升趋势(P<0.05)。详见图5。
2.6 Western Blot结果 与A组相比,B组、C组、D组细胞蛋白表达Bax明显增高,D组是A组的1.3倍,两组比较差异有统计学意义(P<0.05),B组是A组的1.5倍,两组比较差异有统计学意义(P<0.05)。D组Bcl-2的表达量较其他组明显降低,是A组的1.8倍,差异有统计学意义(P<0.05)。详见图6。
3 讨 论
在糖尿病病理进程中,血管内皮细胞是高血糖首先破坏的靶点。研究表明,糖尿病病人的血管生理机能、亚细胞结构、生物化学、细胞分子和分子生物学方面的异常都与高血糖导致的血管内皮细胞损伤有关。高血糖导致血管内皮细胞损伤与凋亡,内皮细胞功能失调,血管内皮完整性和血管功能遭到破坏,从而直接引起血管病变的发生。

与A组比较,*P<0.05;与B组比较,#P<0.01
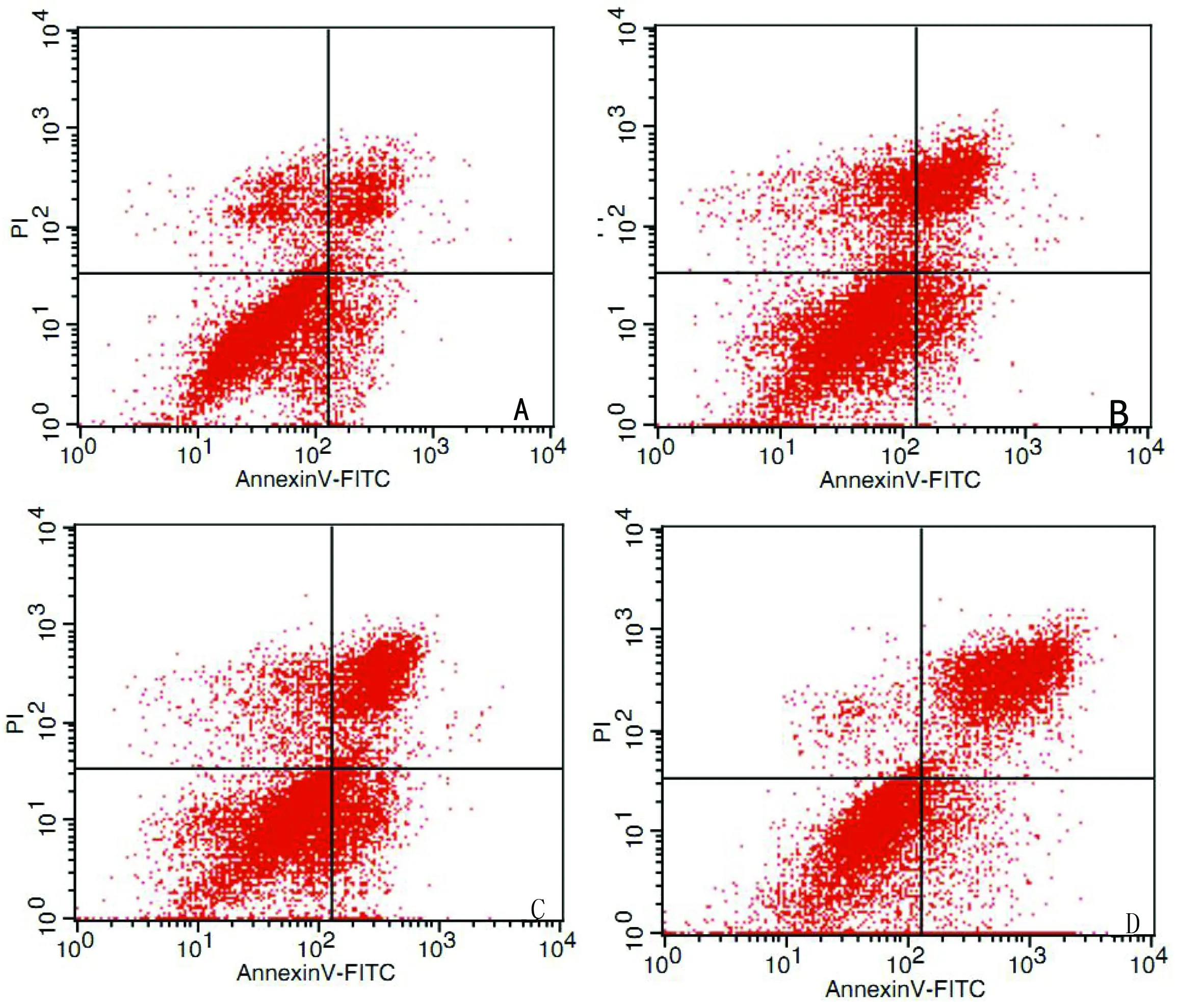
图3 流式细胞术检测各组细胞凋亡率
与A组比较,*P<0.05;与B组比较,#P<0.05

与B组比较,*P<0.01
本研究证实高葡萄糖浓度处理使内皮细胞基因bax转录水平提高,使内皮细胞受损伤后尽早启动凋亡机制,从而引发内皮细胞凋亡。抑制基因bcl-2转录水平表达及蛋白表达,使内皮细胞受损伤后抗凋亡能力降低,而易发生损伤后凋亡。而七氟醚通过抑制bax表达,增加bcl-2表达起到抗凋亡作用,保护内皮细胞。这与高糖可导致氧化应激暴发、恶化线粒体功能紊乱并改变膜的特性,线粒体外膜的损伤伴随着 Bcl-2 蛋白激活导致线粒体外膜通透性改变、释放细胞色素 C、Caspase 活化和细胞凋亡的报道相一致[2]。高糖可造成细胞内氧化应激增加,过多的氧自由基可以激活p21(ras)-MAPK-NFkB通路,使NF-κB入核,然后造成细胞内调节炎症因子的表达,促使白细胞穿越和黏附在血管内皮细胞上,造成血管壁的炎症反应;还可以通过P38MAPK途径抑制NO的生成,使血管的舒张功能受到影响。有研究观察了高糖对人脐静脉内皮细胞凋亡的影响,发现在细胞培养基中加入含有糖基化终末产物(AGEs)的胎牛血清,然后培养6~48 h可使人脐静脉内皮细胞明显凋亡。
源自糖尿病病人静脉内皮细胞中线粒体动力学发生改变,与健康对照相比,糖尿病病人静脉内皮细胞 Fis1 表达增加,线粒体碎片增多;当培养的人主动脉内皮细胞暴露于 30 mmol 的葡萄糖时也发现类似改变,线粒体网络减少,Fis1 和 Drp1 表达增加。线粒体动力学的改变与线粒体活性氧簇(ROS)的产生增加、激活内eNOS与环磷酸鸟苷(cGMP)的显著受损相关;使用 siRNA 沉默 Fis1 和 Drp1,减少了高糖诱导的线粒体网络改变、ROS 产生、eNOS活化与 cGMP产生。
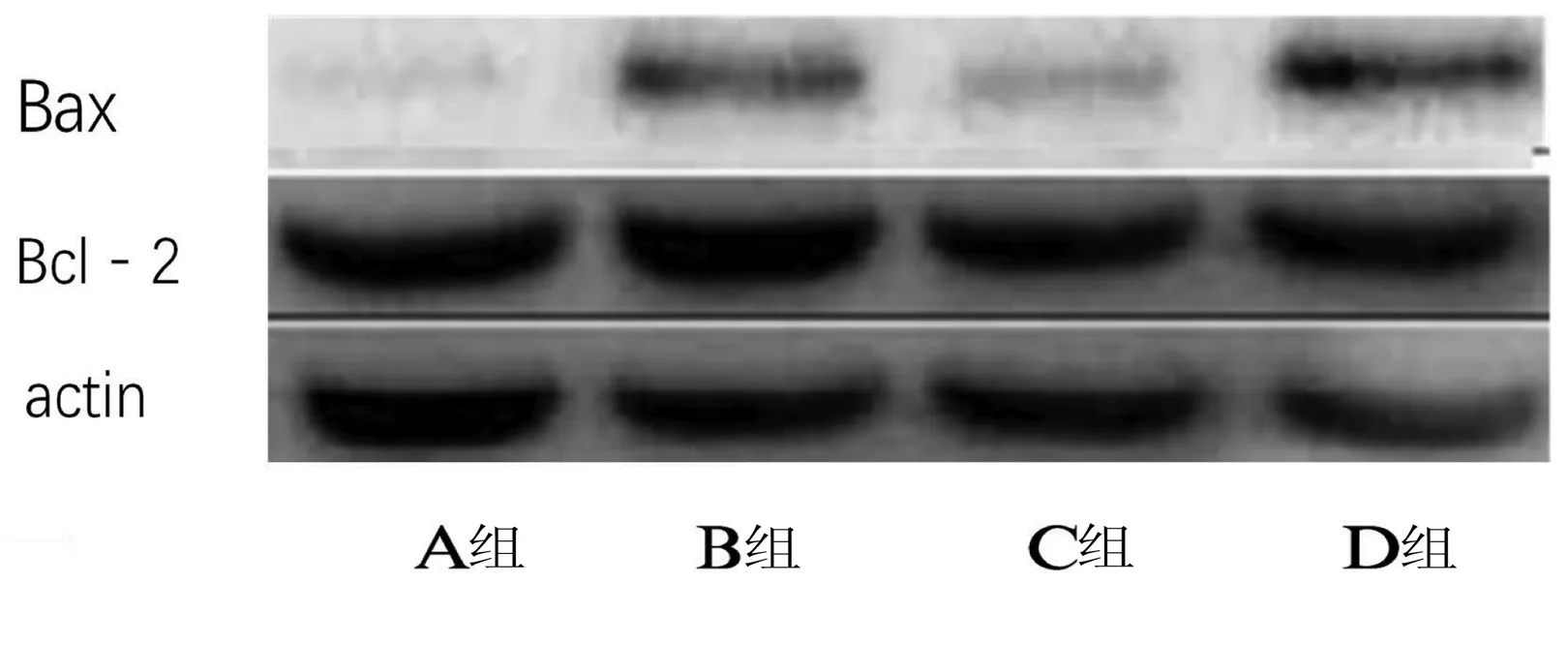
图6 Western Blot结果
以上结论表明,线粒体分裂增加参与了糖尿病内皮细胞功能障碍的发生与发展。而高糖可导致细胞的氧化应激,细胞中自由基的特异性清除酶如SOD及过氧化氢酶(POD)是保护机体免受损伤的关键酶,本实验研究表明,七氟醚可提高内皮细胞SOD活性,可能通过SOD的活性增高起到抑制脂质过氧化物的产生,进而保护生物膜的作用。
血管内皮细胞的功能紊乱与内皮细胞的凋亡是糖尿病血管并发症的重要发病原因,生理条件下 PI3K-AKt 通路与内皮功能活性密切相关:PI3K-AKt 通路可通过磷酸化 Akt 的 Thr308 和 Ser473 两个位点促进内皮细胞增殖,通过抑制caspase-9 减少内皮细胞凋亡,还可以磷酸化 eNOS 的 Ser1177 位点来促进NO生成[3]。本实验证实外源性地给予七氟醚处理可以增强pAkt的表达,提示可通过促进PI3K/Akt途径调节内皮细胞的功能活动。
七氟醚作为继乙醚、氟烷之后的第三代麻醉吸入药,有着复杂的药理学效应和病理生理机制,比如:七氟醚自身是促进炎症还是抑制炎症;是促凋亡还是抗凋亡;以及是否能改善术后细胞损伤,尤其是围术期的副作用都有待进一步实验研究。
