胃癌组织中趋化因子及其受体相关变化及作用分析
2019-04-17王鹏飞金劲激胡畅远陈文静朱冠保程骏
王鹏飞,金劲激,胡畅远,陈文静,朱冠保,程骏
(温州医科大学附属第一医院 胃肠外科,浙江 温州 325015)
胃恶性肿瘤在全球遍发,肿瘤微环境中的细胞因子对肿瘤的发生发展起着重要作用。趋化因子可调控癌症的发生发展[1]。每一种趋化因子的功能作用均有不同,CXC族趋化因子配基17(CXC chemokine ligand 17,CXCL17)是一个与黏膜相关的内环境稳定趋化因子[2-3],在某些胃癌中也发现CXCL17的表达[4-5],但在其发生发展中的作用及机制少见报道。本课题组检测胃癌微环境中趋化因子的差异表达情况,并通过生物信息学分析其相关作用,从中挑选出CXCL17在mRNA水平及蛋白水平分别进行验证,并结合临床病理数据分析其临床相关性,为胃癌的综合防治策略提供新的思路。
1 材料和方法
1.1 材料和标本 趋化因子及其受体基因表达谱PCR芯片由江苏楚天生物科技有限公司定制。TRIzol试剂购自美国Invitrogen公司,ReverTra Ace反转录试剂盒和SYBR Master Mix荧光定量PCR试剂盒购自上海Toyobo公司,小鼠抗人CXCL17蛋白抗体购自美国R&D公司,HRP标记羊抗小鼠 II抗、羊血清和DAB显色剂购自北京中杉金桥生物公司,引物由华大基因科技股份有限公司合成。30例胃癌及相应癌旁正常组织均取自温州医科大学附属第一医院的胃癌术后标本,均经病理组织检查证实。组织新鲜标本在手术切除后30 min内在液氮中保存,以备RNA提取,石蜡标本经4%中性甲醛固定,石蜡包埋,用于免疫组织化学检测。本研究经温州医科大学附属第一医院伦理委员会批准。
1.2 方法
1.2.1 RNA抽提和PCR基因芯片检测:提自液氮保存的胃癌及其相应癌旁正常组织(距肿瘤病灶大于5 cm)3对,分别剪碎并混合,参照TRIzol试剂说明书抽提总RNA并进行纯化、质检,应用趋化因子及其受体PCR芯片进行qRT-PCR检测胃癌组织及癌旁正常组织中基因表达差异情况。cDNA按照Rever-Tra Ace反转录试剂盒说明书进行反转录。以15 μL反应体系进行定量PCR,PCR芯片中每孔已固定有特异性引物,反应体系包括1 μL反转录产物、2×SYBR Green I Master Mix。步骤为:94 ℃ 5 min,94 ℃30 s,56 ℃ 30 s,72 ℃ 30 s,循环40次(BIO-RAD,CFX96),采用相对定量法,以2-ΔΔCt表示标本中各基因相对表达量。
1.2.2 癌症基因组图谱(the cancer genome atlas,TCGA)数据资料收集与分析:从TCGA数据库中(https∶//cancergenome.nih.gov/)下载并预处理胃癌数据集(STAD)的mRNA表达数据,共有32个正常样本及376个肿瘤样本。利用R语言对数据集进行差异基因分析,从中找出CXCL17基因的表达情况,明确其在肿瘤与正常组织中的表达差异情况。
1.2.3 免疫组织化学染色:胃癌及癌旁配对正常组织石蜡切片分别经二甲苯脱蜡、梯度乙醇水化、3%H2O2阻断内源性过氧化氢酶。经过微波修复,冷却至室温后,羊血清封闭1 h。甩去血清后滴加CXCL17特异性抗体,4 ℃冰箱孵育过夜。次日,室温下复温30 min后滴加羊抗鼠二抗,37 ℃孵育30 min。PBS清洗后进行DAB显色、苏木素复染、中性树胶封片。以已知免疫组织化学染色阳性的切片作为阳性对照,以PBS代替一抗作为阴性对照。平均吸光度值由Image-Pro Plus 6.0软件检测所得。
1.3 统计学处理方法 采用SPSS 21.0软件进行统计分析。计量资料采用±s表示,对免疫组织化学结果与各临床病理特征进行t检验或单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 胃癌微环境中趋化因子及其受体差异表达情况 提取胃癌组织及配对的癌旁正常组织中细胞总RNA,利用趋化因子表达谱PCR芯片,测量胃癌中肿瘤组织及癌旁正常组织中趋化因子及其受体的差异表达情况。芯片中取溶解曲线为单一尖峰的测量孔作为有效数据,同时取比值大于2.0或小于0.5的数据点为存在显著表达差异的基因点,3对组织样本结果共测得差异表达基因49个,其中上调基因11个,下调基因38个,CXCL17差异量最大,见图1。
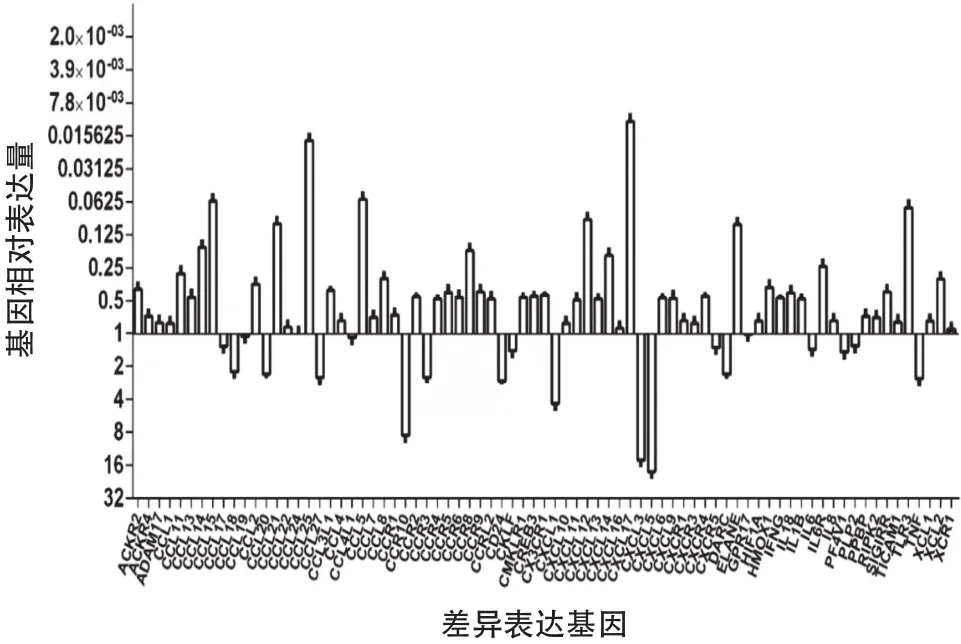
图1 胃癌组织相对癌旁正常组织中趋化因子及其受体差异表达情况
2.2 基因芯片结果分析 与癌旁正常组织相比,胃癌组织中相关趋化因子及其受体存在明显差异表达情况,按照基因GO的功能分析,这些差异表达的基因功能主要表现在免疫应答、炎症反应及趋化因子调节信号通路等,见图2。
2.3 TCGA数据库中CXCL17 mRNA表达差异 通过基因芯片结果可见胃癌肿瘤组织中CXCL17 mRNA表达量明显降低,而CXCL17作为芯片结果中差异显著的基因,我们挑选其对芯片结果进行进一步的验证。在TCGA数据库中,我们利用R语言对32个正常组织及376个胃癌组织进行差异表达基因分析,发现CXCL17在胃癌组织中表达量明显低于正常组织(P<0.01),其结果与基因芯片结果一致。见图3。

图2 差异基因生物信息学功能分类情况
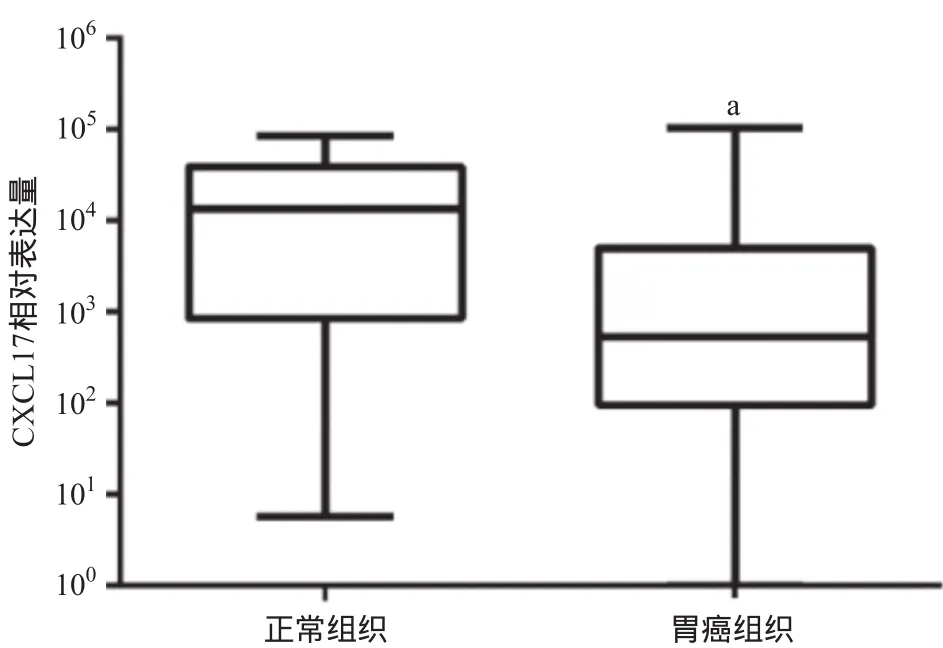
图3 TCGA数据库中CXCL17在胃癌组织中mRNA表达量明显降低
2.4 CXCL17在胃癌组织中表达降低 免疫组织化学实验结果示胃癌组织中CXCL17蛋白表达量与正常组织比明显降低,差异有统计学意义(P<0.01),结果与基因芯片结果相一致,进一步验证了基因芯片结果的真实性与可靠性。见图4。
2.5 CXCL17蛋白表达与胃癌病理特征分析 对30例胃癌组织中CXCL17表达情况及其病理特征进行分析,结果显示CXCL17与胃癌分化程度密切相关,主要表现为肿瘤分化程度越低,CXCL17蛋白表达越低,低分化组织几乎不表达CXCL17蛋白,表达水平差异有统计学意义(P<0.01),见图4D。
3 讨论
本研究通过表达谱PCR基因芯片成功筛选出胃癌相关差异表达的趋化因子及其受体,并通过生物信息学分析差异基因的功能主要在于免疫应答、炎症反应及趋化因子调节信号通路等方面。在肿瘤微环境中,多种肿瘤细胞和基质细胞可以分泌趋化因子。趋化因子及其受体的定向结合直接影响着肿瘤发展和肿瘤细胞转移。机体的免疫系统可以识别肿瘤抗原,进而对肿瘤细胞产生免疫效应。随着肿瘤演进,最初的免疫监视作用往往被诱导形成免疫耐受,趋化因子在这一过程中发挥重要作用。大量研究证实了趋化因子及其受体在胃癌中起重要作用,而CCL19/CCL21-CCR7及CXCL12-CXCR4轴的作用尤为突出[6],CCL19/CCL21-CCR7在胃癌淋巴结转移过程中起着突出作用,CCR7可能成为特异性评价胃癌淋巴结转移潜能的分子标志物[7],而CXCL12-CXCR4轴在胃癌腹膜转移过程中起着关键作用[8],阻断CXCL12-CXCR4轴有助于推动胃癌腹膜转移治疗策略的进一步发展。
而我们从差异表达基因中挑选出了CXCL17做进一步的研究与验证,TCGA数据分析及免疫组织化学结果分别提示CXCL17在胃癌组织中表达量明显降低,且与胃癌分化程度相关。而CXCL17是趋化因子CXC家族最新发现的一员,有研究指出,在胰腺癌中,CXCL17的表达随着肿瘤恶性程度的提升而降低,而在肝癌、乳腺癌、结肠癌中,CXCL17在肿瘤中表达量上升[9-10]。针对CXCL17在不同肿瘤组织中呈现的不同表现,WEINSTEIN等[11]认为CXCL17能够诱导VEGF相关因子表达从而间接促进肿瘤血管生成,加速肿瘤生长;HIRAOKA等[12]则认为,CXCL17可介导T细胞的免疫应答,募集树突状细胞浸润肿瘤组织,从而产生抗肿瘤免疫作用。基于上述研究,我们推测CXCL17在胃癌中的表达下调,可能在胃癌中作为一个抑癌角色参与胃癌的发生发展。
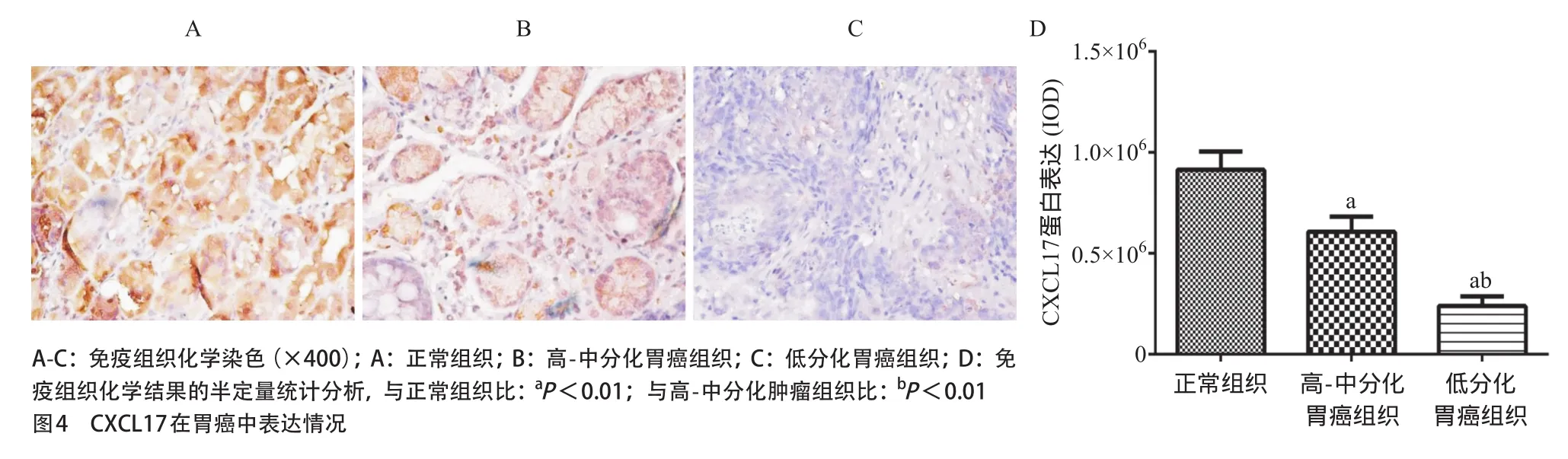
图4 CXCL17在胃癌中表达情况
综上所述,本研究利用基因芯片测量胃癌微环境中趋化因子相关改变,进一步验证了趋化因子及其受体在胃癌的发生发展中的重要作用。另外,本研究进一步完善胃癌中CXCL17的背景资料,并为胃癌的特异性治疗提供有力的实验基础和理论依据。但趋化因子及其受体在免疫反应及胃癌发生发展中存在极其复杂的联系,尚需在今后的研究中进一步进行探究。
