ERCC1的表达水平与鼻咽癌临床病理特征关系的meta分析
2019-04-15杨春李吴伟莉金风张芒赵洪韬
杨春李,吴伟莉,金风,张芒,赵洪韬
550001贵阳,贵州医科大学(杨春李、吴伟莉、张芒、赵洪韬);550004贵阳,贵州医科大学附属医院,贵州省肿瘤医院 头颈部肿瘤科(金风)
2012年全球有86 700例新发鼻咽癌患者,50 800例患者死于鼻咽癌,鼻咽癌在东南亚地区的发病率最高,特别是中国的广东、香港等南方地区[1]。早期鼻咽癌患者首选根治性放疗,同步放化疗是中晚期鼻咽癌患者标准的治疗方式[2-3],尽管鼻咽癌放疗敏感性高,但是晚期患者的局部复发、转移仍是常见的治疗失败原因[4],因此寻找预测鼻咽癌患者在放化疗中的疗效及生存预后的标记物非常重要。
核苷酸切除修复交叉互补基因1(excision repair cross-complementing 1,ERCC1)编码的蛋白是DNA修复的主要蛋白,其主要功能是对损伤DNA进行切除修复,保持DNA结构的完整性[5]。ERCC1维护着机体正常的发育,保持基因组的稳定性,与肿瘤的发生发展及耐药密切相关,研究已表明ERCC1的异常表达与鼻咽癌的局部浸润、复发、转移及临床结局等临床病理特征有关系[6-11],但结论存在争议。临床病理特征是确定患者治疗方案、预测疗效、评估生存预后的重要基础,为明确ERCC1表达量对鼻咽癌患者疗效及临床结局的预测效果,本研究组系统分析了ERCC1表达水平与鼻咽癌患者临床病理特征的关系。
1 方 法
1.1 文献筛选
检索中国知网、万方数据库、PubMed、Web of science、Medline数据库中涉及鼻咽癌和ERCC1的相关中英文文献,截止至2017年9月30日;关键词包括“鼻咽癌”“核苷酸切除修复交叉互补基因-1”“病理特征”“pathological characteristics”“nasopharyngeal carcinoma”“nasopharyngeal cancer”“pharyngeal cancer”“excision repair cross-complementation group 1”“ERCC1”。 采用纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale,NOS)评估文献质量。纳入标准:(1)已发表的中英文全文;(2)临床研究;(3)病理明确诊断为鼻咽癌;(4)ERCC1与鼻咽癌临床病理特征的研究。排除标准:(1)细胞或动物实验研究;(2)读者来信、综述;(3)缺乏或不能有效提取关键数据的研究。
1.2 数据提取
提取数据如下:第一作者姓名,期刊发表年份,国家,地区,种族,肿瘤分期,检测ERCC1表达的方法,样本量,ERCC1高低表达患者数,ERCC1阳性、阴性表达患者数,不同年龄、性别、病理分型、TNM分期中ERCC1高低表达患者数及阴阳性表达患者数,无病生存期(disease-free survival,DFS)、无进展生存期(progression-free survival,PFS)、总生存期(overall survival,OS)不同临床结局的风险比(hazard ratio,HR)及其95%可信区间,单变量或多变量COX回归模型,未提供HR及95%可信区间具体数据的文献,可通过engauge digitizer 4.1软件提取Kaplan-Meier曲线数据。
1.3 统计分析
采用Stata 12.0软件分析所有提取数据,合并相对危险度(relative risk,RR)、HR及其95%可信区间,P<0.05表示两组间比较有统计学意义;计算I2检验研究间异质性,I2<50%表明研究间无明显异质性,采用固定效应模型分析;I2≥50%说明研究间异质性显著,采用随机效应模型分析数据。
2 结 果
2.1 检索结果
文献筛选流程如图1,最终纳入18项研究[6-23],包含2 209例鼻咽癌患者;其中8项研究对比了ERCC1阳性、阴性表达与鼻咽癌患者临床病理特征的关系,另外10项研究将ERCC1分成高低表达两类比较其与鼻咽癌患者临床病理特征的关系;纳入文献基本特征详见表1,纳入的研究主要集中在2009年至2017年,一项研究2005年发表,Chen Shaojun等作者采用qRT-PCR方法检测ERCC1表达,余研究全采用IHC检测ERCC1水平,绝大多数研究(14篇文献)中鼻咽癌患者的治疗方式以顺铂为基础的联合放化疗。
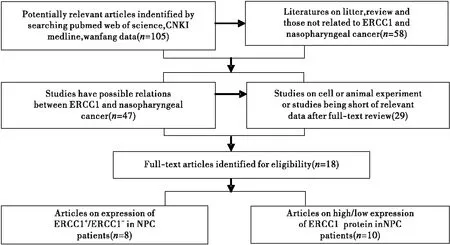
图1文献筛选流程图
Figure1.DiagramaboutProcessofArticlesIdentified
表1纳入研究的基本特征
Table1.BasicInformationofEligibleStudies
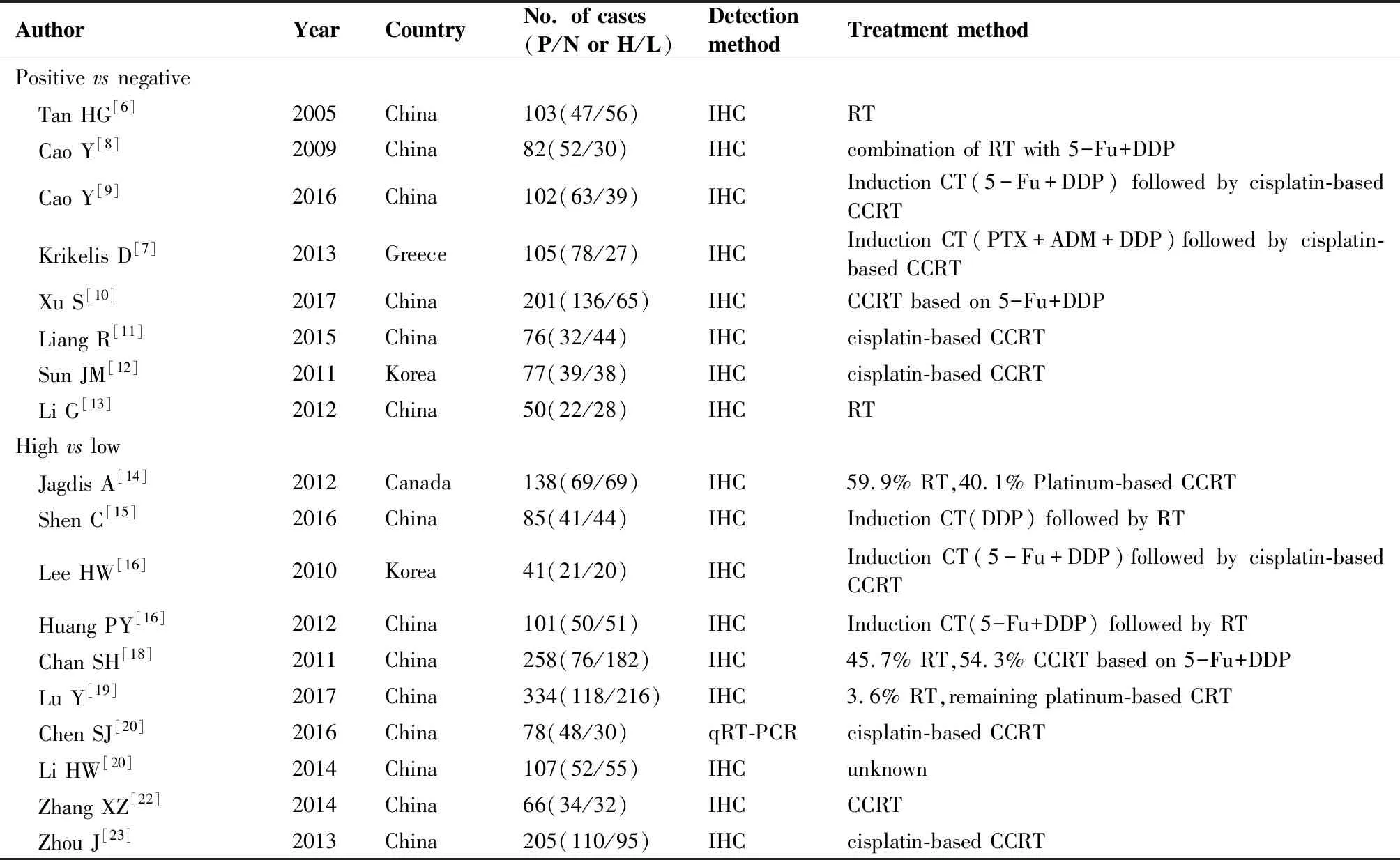
AuthorYearCountryNo. of cases(P/N or H/L)DetectionmethodTreatment methodPositive vs negative Tan HG[6]2005China103(47/56)IHCRT Cao Y[8]2009China82(52/30)IHCcombination of RT with 5-Fu+DDP Cao Y[9]2016China102(63/39)IHCInduction CT(5-Fu+DDP) followed by cisplatin-based CCRT Krikelis D[7]2013Greece105(78/27)IHCInduction CT(PTX+ADM+DDP)followed by cisplatin-based CCRT Xu S[10]2017China201(136/65)IHCCCRT based on 5-Fu+DDP Liang R[11]2015China76(32/44)IHCcisplatin-based CCRT Sun JM[12]2011Korea77(39/38)IHCcisplatin-based CCRT Li G[13]2012China50(22/28)IHCRTHigh vs low Jagdis A[14]2012Canada138(69/69)IHC59.9% RT,40.1% Platinum-based CCRT Shen C[15]2016China85(41/44)IHCInduction CT(DDP) followed by RT Lee HW[16]2010Korea41(21/20)IHCInduction CT(5-Fu+DDP)followed by cisplatin-based CCRT Huang PY[16]2012China101(50/51)IHCInduction CT(5-Fu+DDP) followed by RT Chan SH[18]2011China258(76/182)IHC45.7% RT,54.3% CCRT based on 5-Fu+DDP Lu Y[19]2017China334(118/216)IHC3.6% RT,remaining platinum-based CRT Chen SJ[20]2016China78(48/30)qRT-PCRcisplatin-based CCRT Li HW[20]2014China107(52/55)IHCunknown Zhang XZ[22]2014China66(34/32)IHCCCRT Zhou J[23]2013China205(110/95)IHCcisplatin-based CCRT
P/N: ERCC1+/ERCC1-; H/L: high/low expression level of ERCC1; IHC: immunohistochemistry; RT: radiotherapy; CT: chemotherapy; PTX: paclitaxel; ADM: doxorubicin; 5-Fu: 5-fluorouracil; DDP: cisplatin; CCRT: concurrent radiochemotherapy
2.2 ERCC1阳性率与鼻咽癌临床病理特征的关系
共纳入8个研究,涉及796例鼻咽癌患者,ERCC1蛋白阳性表达率为58.92%(469/796),ERCC1阳性表达率与鼻咽癌的直接浸润[(T1+T2)vs(T3+T4)]、淋巴结转移[(N0+N1)vs(N2+N3)]、性别(MalevsFemale)、TNM分期(IIIvsIV)、年龄(≥60vs<60)、治疗缓解率(CR, PR, ER)的关系差异无统计学意义;ERCC1蛋白阳性的鼻咽癌患者比阴性患者的总生存率低(PositivevsNegative,HR=2.618,95%CI:1.657~4.136,P=0.000),4个研究间未发现异质性(P=0.753,I2=0.0%),采用固定效应模型合并数据;2个研究合并的结果提示ERCC1蛋白在角化型鼻咽癌中的阳性表达率比非角化型鼻咽癌中的低(keratinizingvsnon-keratinizing,RR=0.616,95%CI: 0.363~1.046),但是差异无统计学意义(P=0.073),meta分析合并结果详见表2;基于现有研究分析,结果表明ERCC1蛋白阳性率与鼻咽癌的局部浸润、淋巴结转移、性别、TNM分期、年龄、治疗缓解率关系不明确,而ERCC1蛋白阳性鼻咽癌患者的总生存率比阴性患者差;提示ERCC1蛋白表达程度可能与鼻咽癌患者病理分化程度有关。
表2ERCC1表达与鼻咽癌患者临床病理特征关系的meta分析结果
Table2.Meta-analysisResultsaboutERCC1ExpressionandClinicopathologicalCharacteristicsofPatientswithNasopharyngealCancer
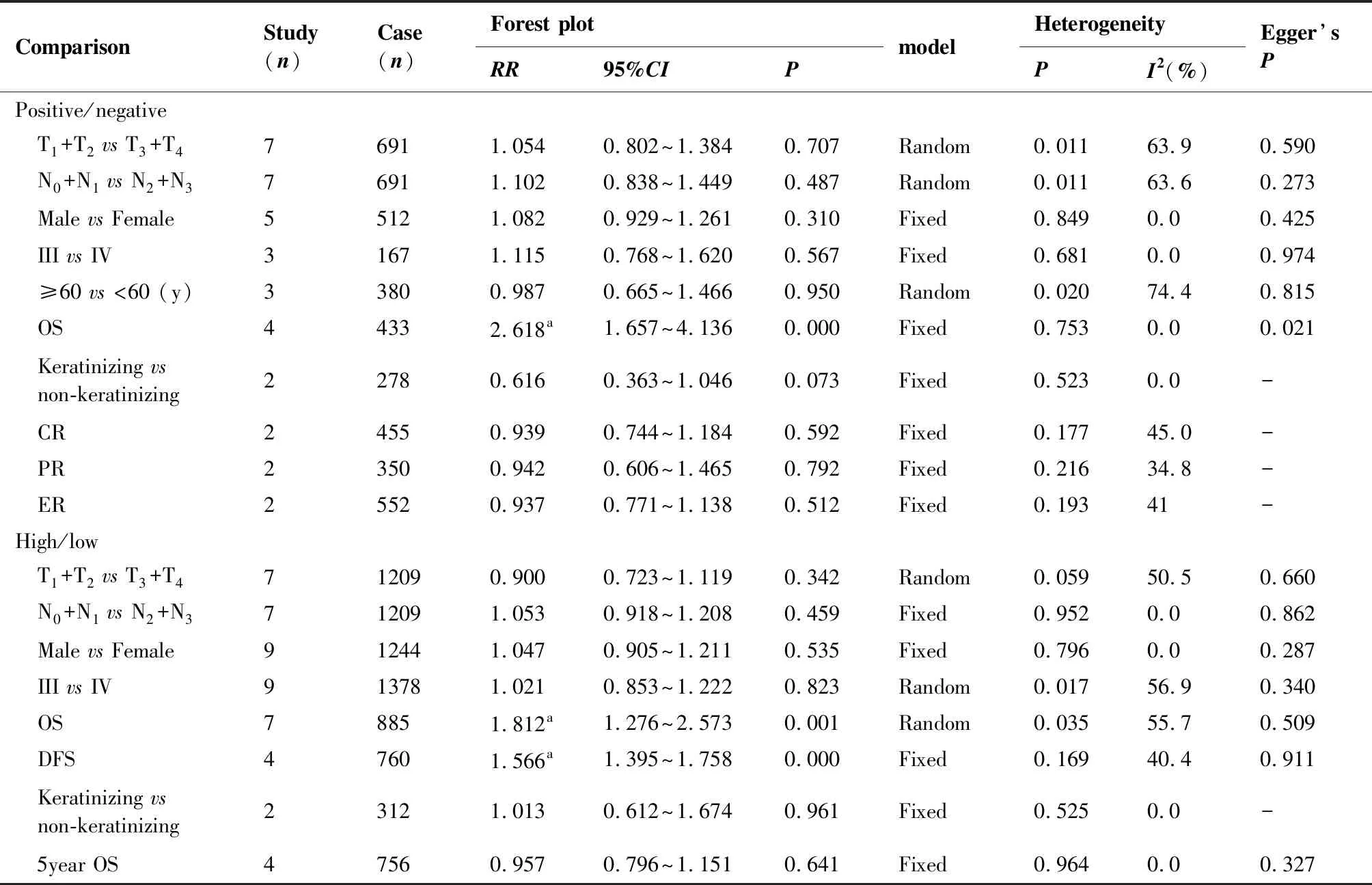
ComparisonStudy(n)Case(n)Forest plotRR95%CIPmodelHeterogeneityPI2(%)Egger’sPPositive/negative T1+T2 vs T3+T476911.0540.802~1.384 0.707Random0.01163.90.590 N0+N1 vs N2+N376911.1020.838~1.4490.487Random0.01163.60.273 Male vs Female55121.0820.929~1.2610.310Fixed0.8490.00.425 III vs IV31671.1150.768~1.6200.567Fixed0.6810.00.974 ≥60 vs <60 (y)33800.9870.665~1.4660.950Random0.02074.40.815 OS44332.618a1.657~4.136 0.000Fixed0.7530.00.021 Keratinizing vsnon-keratinizing22780.6160.363~1.046 0.073Fixed0.5230.0- CR24550.9390.744~1.184 0.592Fixed0.17745.0- PR23500.9420.606~1.465 0.792Fixed0.21634.8- ER25520.9370.771~1.1380.512Fixed0.19341-High/low T1+T2 vs T3+T4712090.9000.723~1.119 0.342Random0.05950.50.660 N0+N1 vs N2+N3712091.0530.918~1.2080.459Fixed0.9520.00.862 Male vs Female912441.0470.905~1.2110.535Fixed0.7960.00.287 III vs IV913781.0210.853~1.222 0.823Random0.01756.90.340 OS78851.812a1.276~2.5730.001Random0.03555.70.509 DFS47601.566a1.395~1.758 0.000Fixed0.16940.40.911 Keratinizing vs non-keratinizing23121.0130.612~1.6740.961Fixed0.5250.0- 5year OS47560.9570.796~1.1510.641Fixed0.9640.00.327
OS: overall survival; DFS: disease free survival;a: the value of HR considered as pooled effect size; CR: complete remission; PR: partial remission; ER: effective rate
2.3 ERCC1高低表达与鼻咽癌临床病理特征的关系
共纳入10个研究,包括1 413例鼻咽癌患者,ERCC1基因高表达率为44.09%(623/1 413),ERCC1基因表达水平高低与鼻咽癌的直接浸润[(T1+T2)vs(T3+T4)]、淋巴结转移[(N0+N1)vs(N2+N3)]、性别(malevsfemale)、TNM分期(IIIvsIV)、病理分型(keratinizingvsnon-keratinizing)、5年OS的关系无统计学意义;包含885例鼻咽癌的7个研究比较了ERCC1高低表达与鼻咽癌患者OS的关系,合并结果显示ERCC1相对高表达组鼻咽癌患者比低表达组低(HighvsLow,HR=1.812,95%CI: 1.276~2.573,P=0.001),各研究间异质性较大(P=0.035,I2=55.7%),采用随机效应模型分析数据;涉及760例患者的4个研究分析了ERCC1表达水平高低与鼻咽癌患者DFS的关系,分析结果显示ERCC1高表达鼻咽癌患者组的DFS比低表达患者组低(HighvsLow,HR=1.566,95%CI: 1.395~1.758,P=0.000),合并的研究间异质性较小(P=0.169,I2=40.4%),采用固定效应模型合并数据,结果详见表2。结果表明ERCC1的异常表达没有改变鼻咽癌局部浸润、淋巴结转移的风险,与晚期鼻咽癌的TNM分期、病理分化程度、5年OS无切确关系;ERCC1高表达的鼻咽癌患者OS、DFS比低表达患者差,提示ERCC1高表达是鼻咽癌患者的不良预后因子。见图2。
2.4 发表偏倚
Begg’s检验未见明显发表偏倚,表2统计Egger’s检验结果P值无统计学意义,未发现发表偏倚,研究数量较少发表偏倚检验效能降低,无实际意义,表2中无检验结果。
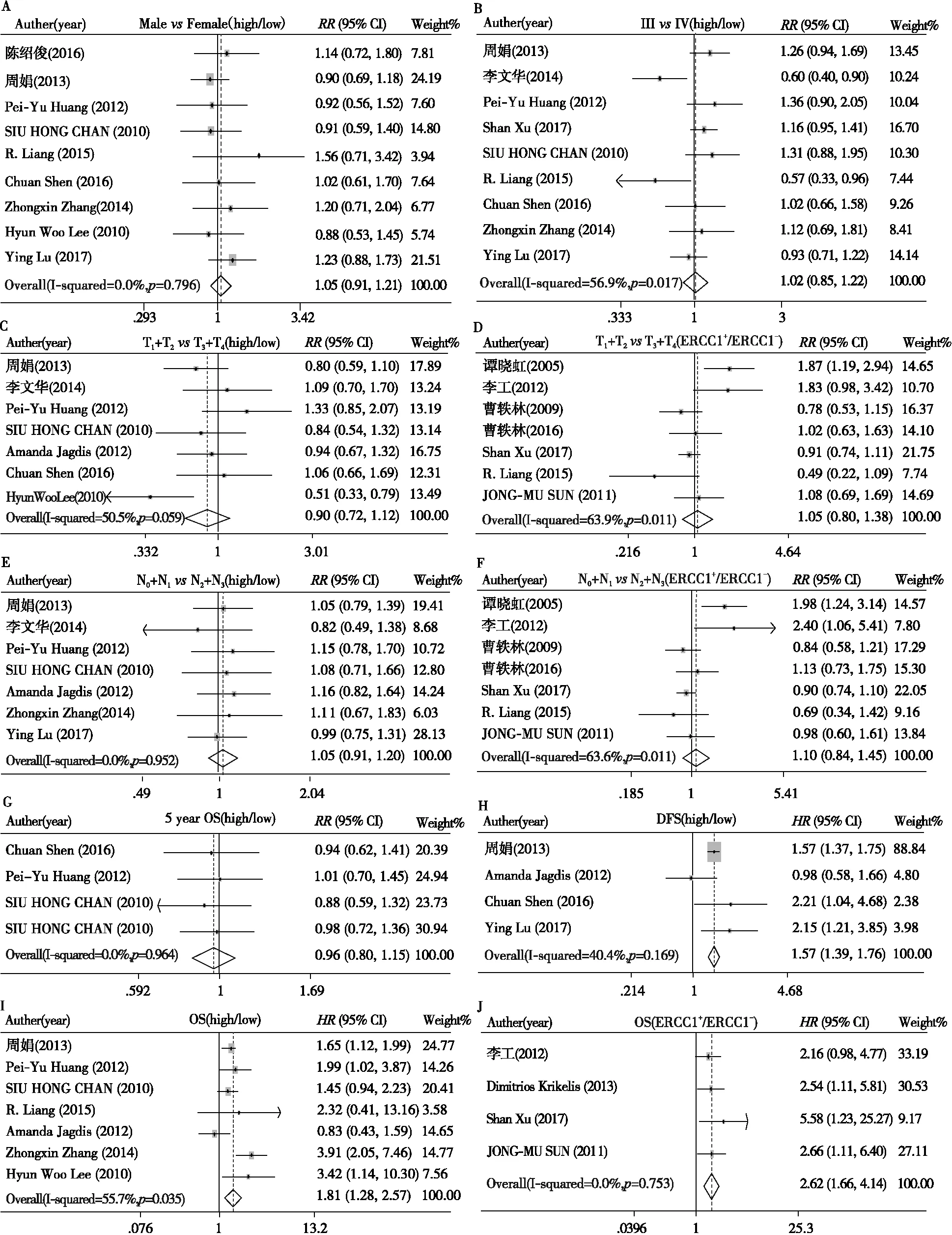
图2ERCC1表达与鼻咽癌临床病理特征关系的森林图
Figure2.ForestPlotfortheAssociationbetweenERCC1ExpressionandClinicopathologicalCharacteristicsofNasopharyngealCarcinoma
Graph A-C,E,G-I=highvslow expression; others=ERCC1+vsERCC1-.
3 讨 论
由于鼻咽癌解剖位置的特殊性及其对放射治疗的高度敏感性,鼻咽癌主要以放射治疗为主,早期患者行单纯根治性放疗具有很高的治愈率;对于局部晚期鼻咽癌患者,III期临床研究表明,单纯放疗组的5年生存率为60.2%,奥沙利铂为基础的同步放化疗组患者的5年生存率仅增加13%(73.2%)[4];同步放化疗在提高生存获益的同时也增加了并发症的发生率,并且对于鼻咽癌患者而言,特别是中晚期鼻咽癌具有较高的远处转移率;因此,有效的肿瘤标记物预测中晚期鼻咽癌治疗疗效、预后对于优化治疗方案及筛选获益人群非常重要。已有meta分析表明ERCC1的表达水平与头颈部肿瘤患者的临床结局有关,是头颈部肿瘤患者预后预测标记物[24],没有单独分析ERCC1与鼻咽癌患者临床病理特征的关系。本研究组纳入包含2 209例鼻咽癌患者的18项研究综合分析,发现ERCC1阳性表达的鼻咽癌患者比阴性患者的总生存预后差,ERCC1阳性患者死亡风险是阴性患者的2.168倍(P/N,HR=2.618,95%CI:1.657~4.136);同样发现,ERCC1高表达组鼻咽癌患者的总生存预后比低表达组患者差,死亡风险是低表达组患者的1.812倍(H/L,HR=1.812,95%CI: 1.276~2.573);对于DFS,ERCC1高表达鼻咽癌患者的预后比低表达组患者差,其复发或死亡风险是低表达组的1.566倍(H/L,HR=1.566,95%CI: 1.395~1.758);ERCC1表达水平与鼻咽癌患者其他临床病理特征的关系尚无统计学差别,基于现有研究分析尚未发现ERCC1异常表达改变鼻咽癌浸润、淋巴结转移风险。
核酸损伤切除修复(NER)是最重要的修复途径,ERCC1是NER中重要的修复基因,ERCC1是高度保守的DNA单链核酸内切酶,ERCC1编码的蛋白与XPF形成异源二聚体,在DNA损伤位点,识别并切除5’端损伤侧单链,限制和调节DNA合成[25]。铂类为基础的放化疗综合治疗是局部晚期鼻咽癌患者的主要治疗方式;铂类分子进入细胞中迅速分解,以水合阳离子与DNA的链内或链间交联形成DNA加合物,NER会清除这些加合物,ERCC1蛋白是核酸损伤切除修复过程的限速酶,ERCC1相对高表达会加速铂-DNA加合物的清除过程及增加清除能力,导致铂类为基础的化疗方案的耐药;研究表明改变ERCC1表达会改变肿瘤细胞对放化疗的敏感性,肿瘤细胞凋亡是肿瘤细胞放化疗耐药的重要影响因素,ERCC1通过抑制凋亡水平降低食管癌对放化疗的敏感性[26],敲低ERCC1的胶质瘤细胞经电离辐射后存活率明显低于对照组,Liccardi等发现,ERCC1敲低组胶质瘤细胞DNA链断裂程度明显增加,活化caspase-3也高于对照组[27]。在低氧条件下,肿瘤细胞对放射治疗的敏感性低[28],David Murray等认为放疗导致的DNA链损伤修复主要通过依赖ERCC1/ERCC4(XPF)的DNA交链修复途径实现,而不是核酸切除修复途径,ERCC1的缺失会改善低氧环境下肿瘤细胞对放疗的不敏感性,UV20和UV41细胞是ERCC1/ERCC4(XPF)基因缺失型突变细胞株,在低氧状况下,这两株细胞对γ射线照射非常敏感,而且氧增强比降低[29];在本研究中,我们也发现ERCC1阳性/高表达组患者比ERCC1阴性/低表达组患者临床预后差,ERCC1高表达一方面可通过核酸切除修复途径降低肿瘤细胞对顺铂的敏感性,另一方面可通过放疗诱导的DNA交链途径使得肿瘤细胞对放疗敏感性差,肿瘤细胞代谢耗氧快,实体肿瘤内常处于缺氧状态,下调ERCC1在肿瘤细胞中的表达可增加放疗敏感性,降低氧增强比,同等疗效下可降低或者不增加放疗剂量,减轻患者放疗毒副反应;降低ERCC1在肿瘤细胞中表达的新的治疗方案有望改善患者临床预后;此外,ERCC1相对高表达的患者并不能从铂类为基础的放化疗方案中获益,寻找新的放疗增敏剂非常必要。
本研究存在一些不足,除了生存预后外,其他临床病理特征的研究数量和样本样较少,与ERCC1表达水平的关系尚无统计学差别;表2中5年生存率在ERCC1高低表达组中差别无统计学意义,但是时点生存率的统计分析结果更容易受混杂因素的影响,涉及风险比HR的总生存预后能更好地反映整体随访时间过程的生存状态;纳入研究地域、种族、治疗方案、药物剂量等的差异造成了本研究的异质性,ERCC1阳/阴性、高/低表达没有统一的分界标准,ERCC1对于鼻咽癌患者生存预后结局预测临床应用之前,还有较长的距离,需要行头对头的大样本多中心研究完善上述不足。
总之,ERCC1表达水平在一定程度上可以预测鼻咽癌患者的临床预后,是鼻咽癌患者放化疗的预后因子;基于研究中的局限,需深入行统一检测方法、统一分界标注的大样本高质量临床研究。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
