抑制内质网应激信号通路PERK-eIF2α介导NF-κB抑制口咽癌细胞增殖*
2019-04-15王婕张妙吕欣桐乔俏
王婕,张妙,吕欣桐,乔俏
110001 沈阳,中国医科大学附属第一医院 放射治疗科
头颈部肿瘤是全球第六大常见恶性肿瘤,也是发展中国家第三大常见肿瘤。其中口咽癌约占4.2%。放射治疗是其主要的治疗方法之一。尽管近几年来放疗治疗技术取得了很大进步,但近半个世纪来其5年生存率始终徘徊在50%[1]。因此,寻求有效途径抑制口腔癌细胞增殖,提高其治愈率是目前亟待解决的问题。有文献表明,内质网应激通路PERK-eIF2α可激活细胞中的自我保护机制从而抑制细胞凋亡[2]。而核因子κB(NF-κB)可以抑制细胞凋亡,并已在胶质瘤、甲状腺癌等其它恶性肿瘤中得到证实[3-4]。因此,我们认为通过抑制内质网应激信号通路PERK-eIF2α介导NF-κB或可诱导口咽癌细胞凋亡。本研究以口咽鳞癌细胞系(Fadu、Detroit 562)为细胞模型,探讨内质网应激信号通路PERK-eIF2α参与调控口咽癌细胞增殖具体机制。
1 材料与方法
1.1 实验材料
MEM、RPMI 1640和胎牛血清购自于美国GIBCO公司。GSK2606414购自德国Calbiochem公司。Bay11-7082、DMSO、RIPA裂解液、FITC Annexin V 凋亡检测试剂盒(APOAF)购自于美国Sigma公司。Negative siRNA、PERK siRNA、eIF2α siRNA和转染试剂DharmaFECT 1购自于美国Dharmacon公司。phospho-eIF2α、phospho-p65、p65、兔抗人β-actin购自于美国Cell Signaling公司。Thapsigargin、PERK购自于英国Abcam公司。MTT试剂盒、BCA浓度测定试剂盒、Western Blot实验相关试剂购买于中国碧云天生物科技公司。
1.2 细胞培养及转染
本研究选用HPV(-)的口咽鳞癌Fadu细胞株和Detroit 562细胞株。Fadu细胞用含有10%胎牛血清的MEM培养瓶、Detroit 562细胞用含有10%胎牛血清的RPMI 1640培养瓶在37 ℃、5% CO2饱和湿度的恒温培养箱中培养,2~3 d传代1次,观察细胞生长情况,待细胞种植密度为70%~80%时,将Negative siRNA、PERK siRNA、eIF2α siRNA、转染试剂DharmaFECT 1和培养液按实验要求混合后分别加入各组培养皿中,24 h后更换新鲜培养液,48~60 h收取细胞。
1.3 MTT实验
检测不同浓度PERK通路抑制剂GSK2606414对口咽鳞癌细胞增殖的影响:接种两种口咽鳞癌细胞(Fadu、Detroit 562)于96孔细胞培养板中,每孔5×103个细胞,培养24 h后,给予不同浓度的GSK2606414处理两种细胞,浓度从低到高依次为0 μmmol/L、1 μmmol/L、10 μmmol/L、50 μmmol/L,同时设计阴性对照组。每组设3个复孔,分别于培养24 h后加入20.00 μL MTT,在37 ℃下继续培养4 h,弃上清,每孔加入150 μL DMSO,于37 ℃孵育30 min,酶标仪上振荡10 min,以酶标仪检测波长570 nm处吸光度(A)值,计算细胞存活率:细胞存活率(%)=(实验组A值-调零组A值)/(对照组A值-调零组A值)×100%。另给予两种口咽鳞癌细胞(Fadu、Detroit 562)不同浓度的NF-κB抑制剂Bay11-7082处理,浓度从低到高依次为0 μmmol/L、1 μmmol/L、10 μmmol/L、50 μmmol/L,同时设计阴性对照组,以同样的方法检测。另给与两种口咽鳞癌细胞(Fadu、Detroit 562)5 Gy X射线照射,分别设立Negative siRNA组、Negative siRNA+IR组、PERK siRNA+IR组和eIF2α siRNA+IR组,以同样的方法检测。
1.4 Western Blot实验
检测沉默PERK、eIF2α及Thapsigargin处理后对口咽癌细胞中PERK、phospho-eIF2α、phospho-p65、p65蛋白表达的影响:参照参考文献[5]的实验方法,两组细胞分别设立Negative siRNA组、PERK siRNA组、eIF2α siRNA组、Thapsigargin(100 nmol/L,24 h)组。25 mL的培养瓶接种细胞,细胞种植密度为70%~80%时,将Negative siRNA、PERK siRNA、eIF2α siRNA、转染试剂DharmaFECT 1和培养液按实验要求混合后分别加入各组培养皿中,24 h后更换新鲜培养液,48~60 h收取细胞。RIPA裂解液提取细胞核蛋白及总蛋白,参照BCA蛋白检测试剂盒说明书检测蛋白浓度后,分别用6%、10%、12% SDS-聚丙烯酰胺凝胶电泳和电转移法转至PVDF膜上,用5% BSA封闭,一抗PERK、phospho-eIF2α、phospho-p65、p65、β-actin 4 ℃孵育过夜,辣根过氧化物酶标记的二抗室温孵育2 h,应用放射自显影技术进行蛋白条带的显影。Image J图像分析系统分析结果,获得各条带的吸光度(A)值,以相应蛋白条带的平均吸光度值与β-actin吸光度值的比值表示各组蛋白表达水平,进行统计学分析。另给予两种口咽鳞癌细胞(Fadu、Detroit 562)5 Gy X射线照射,分别设立Negative siRNA组、Negative siRNA+IR组、PERK siRNA+IR组和eIF2α siRNA+IR组,以同样的方法检测。
1.5 流式细胞仪检测细胞凋亡
参照参考文献[6]的实验方法,接种2种口咽癌细胞(Fadu、Detroit 562)于6孔细胞培养板,细胞种植密度为70%~80%时,将口咽癌细胞(Fadu、Detroit 562)分别设立Negative siRNA组、PERK siRNA组、eIF2α siRNA组。将Negative siRNA、PERK siRNA、eIF2α siRNA、转染试剂DharmaFECT 1和培养液按实验要求混合后分别加入各组培养皿中,24 h后更换新鲜培养液。结束培养后,胰酶消化提取细胞,4 ℃预冷的PBS清洗细胞2次;参照试剂盒的说明书,用1X Banding Buffer重新悬浮细胞,加入5 μL PI、5 μL Annexin V,避光10 min。1 h内上机进行检测。流式细胞仪检测细胞时,至少检测5 000个细胞。另将两种口咽鳞癌细胞(Fadu、Detroit 562)分别设立对照组、Bay11-7082组,以同样的方法检测。
1.6 统计学方法
所有实验均重复3次,结果以均数±标准差表示。应用SPSS 21.0软件进行数据分析,组间比较采用独立样本t检验或单因素方差分析,以P<0.05为差异具有统计学意义。
2 结 果
2.1 PERK-eIF2α信号通路特异性抑制剂GSK2606 414抑制口咽癌细胞增殖
如图1所示,MTT实验检测GSK2606414对两种细胞存活率的影响。实验中我们发现,随着GSK2606414预处理浓度的增加,Fadu细胞及Detroit 562细胞的存活率均逐渐降低(F=56.06,P=0.001;F=71.13,P=0.001)。这一结果提示,抑制PERK通路抑制口咽癌细胞增殖。
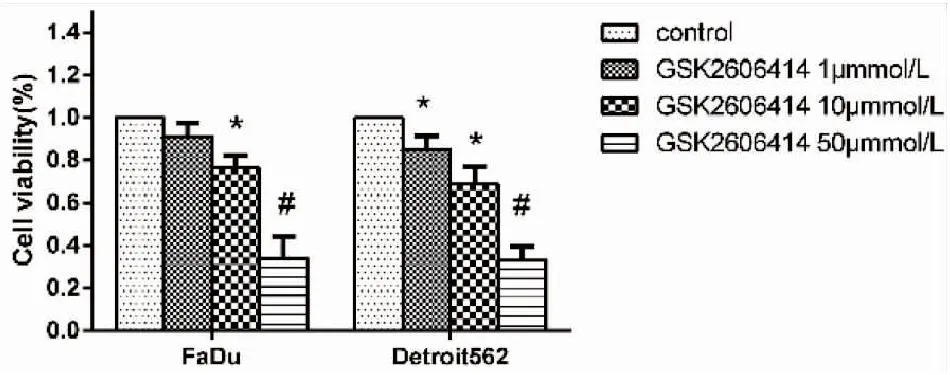
图1.不同浓度GSK2606414处理后口咽癌细胞活力
Figure1.CellViabilityafterTreatmentofTwoOropharyngealCancerCellsinMTT
*P< 0.05,#P< 0.01
2.2 沉默PERK-eIF2α信号通路活化诱导口咽鳞癌细胞凋亡
采用流式细胞仪检测Negative siRNA组、PERK siRNA组及eIF2α siRNA组细胞凋亡情况发现,PERK siRNA组及eIF2α siRNA组两种口咽癌细胞凋亡比例均较Negative siRNA组明显增高,见图2A。其中PERK siRNA组Fadu细胞、Detroit 562细胞凋亡比例分别为(5.61±1.19)%和(8.69±1.04)%,分别较各自的Negative siRNA组明显增加,差异有统计学意义(t=8.16,14.54,P<0.05)。而eIF2α siRNA组Fadu细胞、Detroit 562细胞凋亡比例分别为(9.67±1.01)%和(11.68±1.26)%,分别较各自的Negative siRNA组明显增加,差异有统计学意义(t=16.64,16.08,P=0.004,0.004)。实验结果提示沉默PERK-eIF2α信号通路活化诱导口咽鳞癌细胞凋亡,见图2 B。
2.3 抑制PERK-eIF2α信号通路下调NF-κB磷酸化
首先,在两种口咽鳞癌细胞(Fadu、Detroit 562)中,通过转染分别沉默PERK及eIF2a后,采用Western Blot法检测发现,两种细胞PERK及phospho-eIF2a的表达均较对照组减少,见图3 A、a、B、b。进一步通过转染同时沉默PERK与eIF2a后,采用Western Blot法检测发现,两种细胞phospho-p65的表达均较对照组减少,见图3 C、c。提示我们PERK-eIF2a激活NF-κB磷酸化。最后利用PERK激活剂Thapsigargin处理后,两种细胞phospho-p65的表达均较对照组增加,见图3 D、d。进一步证实PERK-eIF2α信号通路异常活化诱导NF-κB磷酸化。

图2.流式细胞仪检测不同处理因素对细胞凋亡的影响
Figure2.ApoptosisafterTreatmentofTwoOropharyngealCancerCellsinFlowCytometry
*P< 0.05,#P< 0.01. A. Apoptosis rate of each group of Fadu and Detroit 562 cells;B. Statistical figure
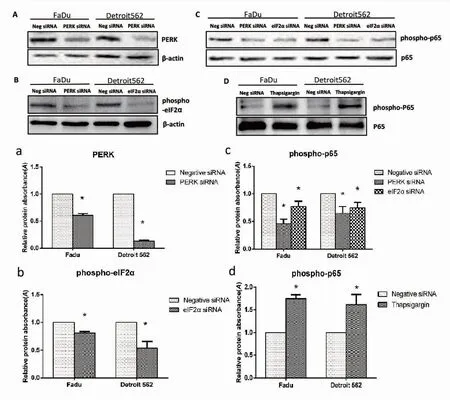
图3.蛋白印迹法检测不同处理后两种细胞中蛋白表达情况
Figure3.ProteinExpressioninTwoCellsafterDifferentTreatments
*P< 0.05. A. PERK protein images of Western Blotting assay; B. Phospho-eIF2a protein images of Western Blotting assay; C. Phospho-p65 protein images of Western Blotting assay; D. Phospho-p65 protein images of Western Blotting assay; a. Relative level of PERK; b. Relative level of phospho-eIF2a; c. Relative level of phospho-p65; d. Relative level of phospho-p65;
2.4 抑制NF-κB诱导口咽鳞癌细胞凋亡抑制其增殖
如图4 A所示,MTT实验检测NF-κB抑制剂Bay11-7082对两种细胞存活率的影响。实验中我们发现,随着Bay11-7082预处理浓度的增加,Fadu细胞和Detroit 562细胞的存活率均逐渐降低(F=57.48,P=0.001;F=116.76,P=0.001)。这一结果提示,阻断NF-κB通路抑制口咽癌细胞增殖。采用流式细胞仪检测对照组及Bay11-7082组细胞凋亡情况发现,Bay11-7082组两种口咽癌细胞凋亡比例均较对照组明显增高,见图4 B。其中Bay11-7082组Fadu细胞、Detroit 562细胞凋亡比例分别为(12.65±1.77)%和(11.84±0.98)%,分别较各自的对照组明显增加,差异有统计学意义(t=12.38,20.88,P=0.007,0.002)。实验结果提示抑制NF-κB诱导口咽鳞癌细胞凋亡抑制其增殖,见图4 C。
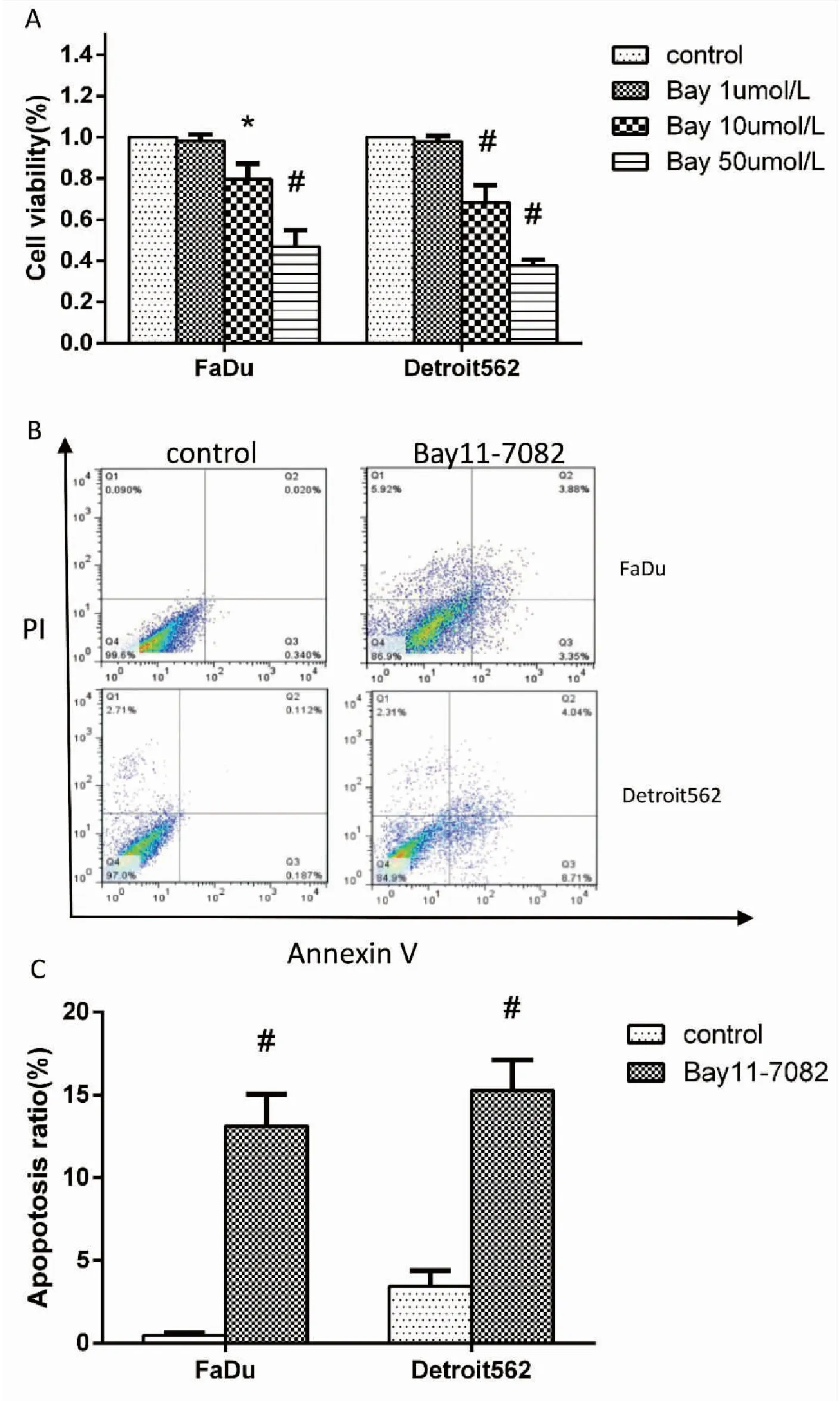
图4.Bay11-7082处理后口咽癌细胞的情况
Figure4.OropharyngealCancerCellafterTreatmentwithBay11-7082
*P<0.05,#P<0.01. A. The viability of oropharyngeal cancer cells after treatment with different concentrations of Bay11-7082; B. Flow cytometry was used to detect the apoptosis rate of Fadu and Detroit 562 cells after Bay11-7082 treatment; C. Statistical figure
2.5 抑制PERK-eIF2α信号通路下调NF-κB磷酸化抑制照射后口咽鳞癌细胞增殖
如图5 A、B示,在两种口咽鳞癌细胞(Fadu、Detroit 562)中,通过转染分别沉默PERK及eIF2a后照射,采用Western Blot法检测发现,两种细胞phospho-p65的表达均较对照组减少。进一步MTT法显示,在两种口咽鳞癌细胞(Fadu、Detroit 562)中,PERK siRNA+IR组和eIF2α siRNA+IR组细胞存活率均较对照组降低,见图5 C。其中,Fadu细胞中PERK siRNA+IR组和eIF2α siRNA+IR组细胞存活率分别为(0.8±0.08)和(0.61±0.06),较Negative siRNA+IR组(0.95±0.04)均明显减少,差异有统计学意义(P=0.04,0.001)。Detroit 562细胞中PERK siRNA+IR组和eIF2α siRNA+IR组细胞存活率分别为(0.72±0.04)和(0.77±0.06),分别较Negative siRNA+IR组(0.89±0.03)明显减少,差异有统计学意义(P=0.003,0.025)。该结果提示抑制PERK-eIF2α信号通路下调NF-κB磷酸化抑制照射后口咽鳞癌细胞增殖。
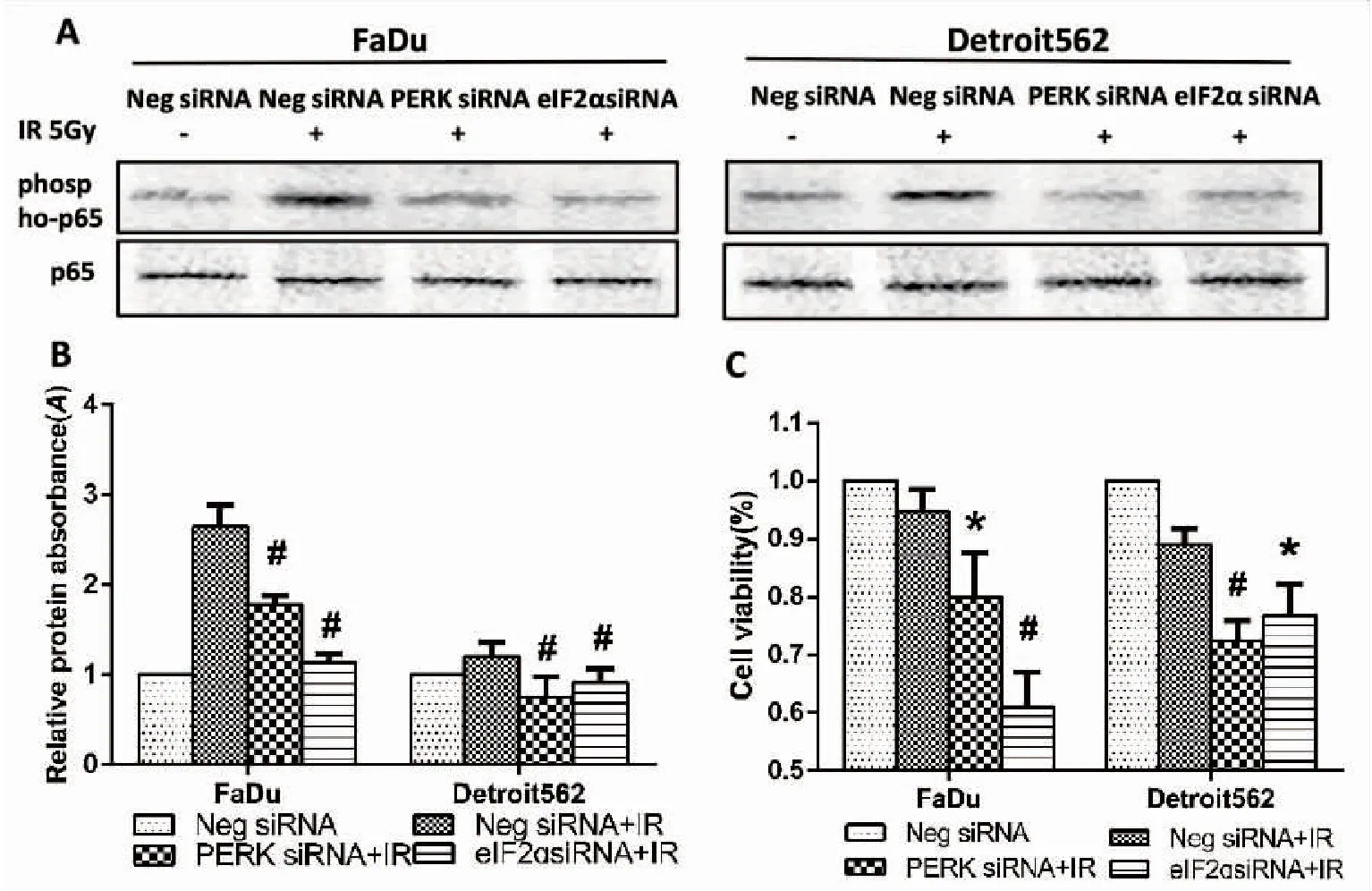
图5.Phospho-p65在口咽癌细胞中的表达情况
Figure5.ExpressionofPhospho-p65inOropharyngealCancerCells
*P< 0.05,#P< 0.01. A. Phospho-p65 protein images of Western Blotting assay;B. Relative level of phospho-p65; C. The viability of oropharyngeal cancer cells after different treatment
3 讨 论
近年来,人类乳头瘤病毒(human papilloma virus,HPV)感染已成为口咽癌的重要发病原因之一。HPV(+)口咽癌患者比HPV(-)口咽癌患者的预后更好[7-8]。但是在亚洲人群中,HPV(-)口咽癌患者比例更高[9-10]。因此,提高HPV(-)口咽癌放疗敏感性对我国口咽癌患者是更急于解决的问题。有鉴于此,我们选择HPV(-)口咽癌细胞系为研究对象。越来越多的证据表明,内质网应激在恶性肿瘤的发生、发展以及对放化疗敏感性的调控中起着重要作用。辐射导致DNA损伤和内质网中错误折叠蛋白质的积累以诱导内质网应激。内质网应激常导致内质网未折叠蛋白质或错误折叠蛋白的蓄积,引起未折叠蛋白反应。因此,干扰未折叠蛋白反应可能是治疗肿瘤的机制之一。未折叠蛋白反应通过3个定位于内质网的跨膜蛋白作为感受器,即PERK,IRE1α和ATF6。内质网应激致未折叠蛋白在内质网积聚后PERK自身磷酸化胞质激酶域,活化eIF2α,激活细胞中的自我保护机制并主动调节应激反应蛋白[2]。另外,在鼻咽癌细胞和乳腺癌细胞中,抑制内质网信号通路可以通过增加其放射敏感性从而增加凋亡抑制其增殖[11-12]。但在人结直肠癌细胞和食管癌细胞中,激活内质网信号通路可以增加其放射敏感性从而增加凋亡,抑制其增殖[13-14]。本实验研究结果显示,随着PERK通路抑制剂GSK2606414预处理浓度的增加,两种口咽鳞癌细胞(Fadu、Detroit 562)的存活率均逐渐降低。这一结果提示,通过抑制PERK通路可以抑制口咽癌细胞增殖。
凋亡是调节细胞死亡、维持细胞稳态的重要途径。本实验研究结果显示,在两种口咽鳞癌细胞(Fadu、Detroit 562)中,通过转染沉默PERK及eIF2a后,细胞凋亡比例明显增高。实验结果提示沉默PERK-eIF2α信号通路活化诱导口咽鳞癌细胞凋亡,这进一步说明PERK抑制剂抑制细胞增殖通过诱导口咽癌细胞凋亡实现。
核因子-κB(NF-κB)是具有特异性DNA结合序列的核转录调节因子,其中以NF-κB p65最为常见。NF-κB在与内质网应激相关的疾病中已被认为是一种可行的治疗靶点,如神经退行性疾病和糖尿病[15-16]。前期研究发现,内质网应激途径PERK-eIF2a通过激活NF-κB使在口咽癌细胞产生辐射抗拒性[17]。另外,Jiang[18]和Wek[19]以前的研究表明,eIF2α磷酸化可以激活人胚肾细胞中的NF-κB以调节细胞凋亡,Deng等[20]进一步阐明了PERK的下游信号eIF2α通过降低IκBα水平激活NF-κB。有争议的是,虽然Fan和Tyagi[21]发现在乳腺癌细胞中,内质网应激通路PERK通过激活NF-κB以介导雌激素诱导细胞凋亡,但是与Cullinan等[22]的研究类似,其认为PERK激活NF-κB不需要eIF2α磷酸化。我们在本实验研究结果显示,在两种口咽鳞癌细胞(Fadu、Detroit 562)中,通过转染沉默PERK及eIF2a后,PERK、phospho-eIF2a、phospho-p65的表达均较对照组减少。这一结果提示,PERK-eIF2a激活NF-κB磷酸化。为了进一步证明上述实验结果,我们利用PERK激活剂Thapsigargin处理两种细胞后,其phospho-p65的表达均较对照组增加。进一步证实PERK-eIF2α信号通路异常活化诱导NF-κB磷酸化。
核因子-κB(NF-κB)广泛存在于各种类型的细胞中,参与协调许多生物学功能,包括细胞分化、炎症反应、免疫反应、细胞凋亡及肿瘤生长等[23-24]。其具有的抑制细胞凋亡的作用在胶质瘤、甲状腺癌等其它恶性肿瘤中得到证实[3-4]。进一步实验发现,随着NF-κB抑制剂Bay11-7082预处理浓度的增加,两种口咽鳞癌细胞(Fadu、Detroit 562)的存活率均逐渐降低。这一结果提示,阻断NF-κB通路抑制口咽癌细胞增殖。进一步发现Bay11-7082处理后两种口咽癌细胞凋亡比例明显增高。实验结果提示抑制NF-κB诱导口咽鳞癌细胞凋亡抑制其增殖。分别沉默PERK及eIF2a后照射发现,两种细胞存活率及其phospho-p65的表达均较对照组减少,提示我们抑制PERK-eIF2α信号通路下调NF-κB磷酸化抑制照射后口咽鳞癌细胞增殖,故抑制该通路或可增加口咽鳞癌细胞对放射的敏感性。
综上,本研究结果示抑制内质网应激信号通路PERK-eIF2α调控NF-κB诱导口咽癌细胞增殖,为寻求有效途径抑制口咽癌细胞增殖提供了新的靶点和理论依据。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
