嗜热链球菌KLDS3.1012胞外多糖合成途径的基因组学及表型特征分析
2019-04-12李柏良王成凤丁秀云霍贵成
李柏良,赵 莉,王成凤,靳 妲,丁秀云,2,刘 飞,*,霍贵成
(1.东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030;2.广州基迪奥生物科技有限公司,广东 广州 510000)
嗜热链球菌是非致病性乳酸菌,常与德氏乳杆菌保加利亚亚种组合使用,作为酸奶的发酵剂[1-2]。部分嗜热链球菌可以产生胞外多糖(exopolysaccharides,EPS),EPS分泌到培养基中,其不仅可以改善发酵乳制品的流变学和感官特性[3-4],还具有诸多的益生特性,如抗氧化性和抗肿瘤活性、降低血压和血糖、改善肠道菌群、抑制致病菌和调节免疫系统等[5-9]。因此,能够产EPS的嗜热链球菌菌株在发酵方面具有更大的价值。
EPS的合成过程分为前体物质糖核苷酸的合成及EPS基因簇合成EPS两个阶段。单糖、双糖作为微生物主要利用的碳源,经转运系统转运至胞内,糖类物质的转运方式一般有3 种:磷酸烯醇式丙酮酸依赖磷酸转移酶系统(phosphotransferase system,PTS)、ABC型糖转运系统以及糖渗透[10]。其中PTS为主要的转运方式,由负责糖类物质磷酸化的可溶性磷酸载体蛋白HPr、能量耦合蛋白酶EI以及膜结合的具有糖特异性的通透酶EII组成。通常EII由3 个功能性的亚单位EIIA、EIIB与EIIC构成,转运甘露糖的PTS则由EIIA、EIIB、EIIC与EIID组成。根据序列及结构的特征,EII可以分为乳糖家族、葡萄糖家族、甘露糖家族及甘露醇家族。在糖转运过程中,如果某一PTS中的EII因缺失亚基而不完整,是不可以通过另一个非同家族的PTS的EII替代其功能。转运到细胞内的糖经过一系列的酶促反应,最后形成糖核苷酸,作为合成EPS的活性前体[11]。
参与指导EPS重复单元合成、链长、聚合与输出的基因常成簇存在,称之为EPS基因簇。异型多糖重复单元的形成通过引导糖基转移酶转移相应的糖核苷酸到异戊二烯醇磷酸酯(脂载体)上,在其他的糖基转移酶作用下,高度特异性地转移相应的糖核苷酸形成重复单元的主、侧链。已经形成的重复单元经翻转酶从胞内输出至细胞外膜,随后经聚合酶聚合成完整的EPS,输出至细胞膜外[12-13]。
嗜热链球菌KLDS3.1012是从中国新疆传统发酵酸奶中分离出来的,由东北农业大学乳品科学教育部重点实验室保藏。前期实验研究发现该菌株具产黏性能强及所产酸奶品质优良等特点,适合于制备高品质直投式发酵剂[14]。为更加深入分析该菌株合成ESP的遗传基础,本研究首先通过二代测序技术对该菌株进行基因组测序,基于生物信息学分析该菌株的糖代谢能力及EPS基因簇,同时利用API 50CH测定该菌株的糖发酵情况,并采用高效离子交换色谱法测定EPS的单糖组成。为研究该菌株EPS遗传基础与EPS结构之间关系及后续更加合理地应用该菌株提供了理论依据。
1 材料与方法
1.1 材料与试剂
嗜热链球菌KLDS3.1012由东北农业大学乳品科学教育部重点实验室工业微生物菌种保藏中心(KLDSDICC)提供,且通过16S rRNA基因测序鉴定。
M17肉汤培养基 青岛高科园海博生物技术有限公司;细菌基因组提取试剂盒 北京天根生物技术有限公司;API 50CH 法国梅里埃公司;DEAE-Sepharose Fast Flow和Sepharose CL-6B填料 美国GE医疗生命科学公司;无水乙醇 天津市天力化学试剂有限公司;三氯乙酸、三氟乙酸 天津市大茂化学试剂厂;重蒸苯酚北京博奥拓达科技有限公司;浓硫酸 哈尔滨理工化学试剂有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
LDZF-50KB-II立式蒸汽灭菌器 上海申安医疗器械厂;CJ-2D超净工作台 天津泰斯特仪器有限公司;DHP-927型电热恒温培养箱 上海一恒科技有限公司;透析袋 北京索莱宝生物科技有限公司;蛋白纯化仪美国GE医疗生命科学公司。
1.3 方法
1.3.1 菌株的活化及基因组提取
将甘油保藏的菌株KLDS3.1012以2%的体积分数接种于M17液体培养基,42 ℃培养24 h,连续转接两次,第3次培养12 h后用于基因组提取。按照细菌基因组提取试剂盒说明书的步骤提取菌株KLDS3.1012的基因组。
1.3.2 全基因组测序及组装
利用Illumina HiSeq(2×100 bp配对末端文库)和Illumina MiSeq(2×250 bp配对末端文库)平台组合测序技术对菌株KLDS3.1012进行基因组测序。通过进行质量控制和数据过滤,利用SOAPdenovo 2.0对所有有效数据(Clean Data)进行组装[15]。
1.3.3 基因组注释
采用NCBI原核生物基因组注释流程(prokaryotic genome annotation pipeline,PGAP,https://www.ncbi.nlm.nih.gov/books/NBK174280/)进行基因预测及注释。基因组中蛋白序列通过WebMGA网站进行COG(Cluster of Orthologous Group)注释[16]。
1.3.4 生物信息学分析
利用CGView Server构建基因组图谱[17]。糖代谢途径参照KEGG通路数据库进行分析[18]。ISfinder用于鉴定基因组序列中的转座酶[19]。使用ACT(Artemis Comparison Tool)软件对菌株KLDS3.1012与嗜热链球菌ND03的EPS基因簇进行分析[20]。
1.3.5 表型特征的测定
采用API CHL培养基和API 50CH测试条按照试剂盒说明书测定菌株KLDS3.1012的碳水化合物利用情况。按照邵丽[21]所述的实验步骤,提取菌株KLDS3.1012所产的EPS。参考Ren Wei等[22]的方法利用DEAESepharose Fast Flow和Sepharose CL-6B对EPS进行纯化。参照邵丽[21]的方法,使用高效离子交换色谱(high performance anion exchange chromatography,HPAEC)法进行单糖组成的测定。
1.4 数据处理
利用HPAEC测定各标准品的保留时间和峰面积,以各浓度为横坐标,峰面积为纵坐标,绘制标准曲线。对样品中各单糖的峰面积进行积分,根据标准曲线计算相应的浓度。
2 结果与分析
2.1 基因组的基本特征及注释

图1 嗜热链球菌KLDS3.1012的基因组圈图Fig. 1 Circular genome map of S. thermophilus KLDS3.1012
菌株KLDS3.1012的基因组序列已提交到GenBank数据库,登录号为:NZ_LHSK01000000。通过CGView Server构建其基因组圈图(图1)并利用PGAP流程进行注释,一共预测出1 992 个基因,其中包括1 705 个蛋白编码基因,213 个假基因,15 个rRNA,55 个tRNA和4 个ncRNA。
菌株KLDS3.1012的亲缘关系报告(表1)显示,菌株KLDS3.1012与嗜热链球菌ND03在基因组序列最为相似(99.572 2%),亲缘关系最近,而与嗜热链球菌M17PTZA496的基因组序列差异较大,对称一致性仅为83.842 8%。

表1 嗜热链球菌亲缘关系报告Table 1 Genome neighbor report of S. thermophilus strains
2.2 糖代谢能力分析
2.2.1 糖转运系统
菌株KLDS3.1012不仅含有HPr(AKL23_RS05975)和EI(AKL23_RS05970),还含有10 个糖特异性通透酶(EII)的基因,其中包括蔗糖通透酶EII的基因、PTS果糖通透酶EII、PTS甘露糖通透酶EII和PTS葡萄糖通透酶EII(表2)。然而,PTS葡萄糖通透酶EII是由假基因编码的,而另外2 个EII基因也不完整,因此不能通过PTS转运葡萄糖。在菌株KLDS3.1012的基因组中鉴定到乳糖/半乳糖渗透酶(AKL23_RS06545)和葡萄糖渗透酶(AKL23_RS04150)。由于编码ABC型糖转运系统的基因不完整,因此ABC型糖转运系统不能将糖转运到菌株KLDS3.1012的细胞质中。综上所述,从基因组分析,菌株KLDS3.1012可以利用蔗糖、果糖、甘露糖、葡萄糖、半乳糖和乳糖。

表2 嗜热链球菌KLDS3.1012的PTS相关基因Table 2 Putative genes related to phosphotransferase system (PTS) in S. thermophilus KLDS3.1012
2.2.2 糖核苷酸的合成途径
被转运到细胞质中的糖会通过各种代谢途径生成糖核苷酸。如图2所示,菌株KLDS3.1012可以通过β-半乳糖苷酶(AKL23_RS06540)水解乳糖生成葡萄糖和半乳糖,一方面,半乳糖通过UDP-半乳糖的途径(AKL23_RS06565和AKL23_RS06560)转化生成UDP-半乳糖和Leloir途径转化生成葡萄糖-1-磷酸。另一方面,葡萄糖被葡萄糖激酶(AKL23_RS03575)磷酸化生成葡萄糖-6-磷酸,再由磷酸变位酶(AKL23_RS03880)进一步形成葡萄糖-1-磷酸。葡萄-1-磷酸作为重要的中间产物,它可以通过UDP-葡萄糖焦磷酸化酶(AKL23_RS08610)转化成UDP-葡萄糖或通过一系列酶促反应(AKL23_RS05870、AKL23_RS05860、AKL23_RS05865、AKL23_RS03055和AKL23_RS06935)生成dTDP-鼠李糖。编码UDP-葡萄糖4-差向异构酶的基因具有3 个拷贝(AKL23_RS05370、AKL23_RS06390和AKL23_RS06555),这可能与UDP-葡萄糖和UDP-半乳糖之间的相互转换相关。甘露糖、果糖和蔗糖转运到细胞质中后分别被磷酸化形成甘露糖-6-磷酸、果糖-6-磷酸和蔗糖-6-磷酸,三者之间可以相互转化(AKL23_RS08125、AKL23_RS08110和AKL23_RS10365)。随后,果糖-6-磷酸由AKL23_RS04205、AKL23_RS05900和AKL23_RS02810编码的一系列酶转化成UDP-N-乙酰葡糖胺。总之,从基因组分析,菌株KLDS3.1012能够形成4 种糖核苷酸,即UDP-葡萄糖、dTDP-鼠李糖、UDP-半乳糖和UDP-乙酰葡糖胺。这些糖核苷酸可以形成EPS的重复单元,再通过EPS基因簇形成EPS。
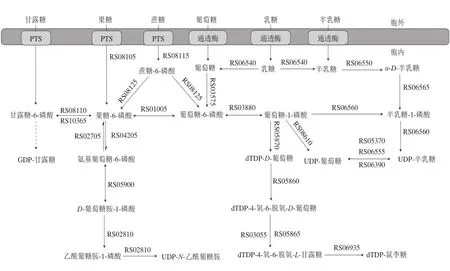
图2 嗜热链球菌KLDS3.1012糖核苷酸的合成Fig. 2 Synthesis of sugar nucleotides in S. thermophilus KLDS 3.1012
2.3 EPS基因簇的生物信息学分析
如图3所示,菌株KLDS3.1012存在1 个EPS合成基因簇(图4),由35 个基因组成。在该基因簇中的5'末端存在1 个嘌呤核苷磷酸化酶的编码基因deoD(AKL23_RS05125),该基因存在于大部分EPS基因簇附近[23-24]。基因AKL23_RS05120、AKL23_RS05115、AKL23_RS05110和AKL23_RS05105分别负责编码EPS的合成调节、链长决定和输出相关的保守基因。AKL23_RS05100编码的起始糖基转移酶,可以将UDP-半乳糖转移到脂质载体上。负责编码其他糖基转移酶的基因分别是AKL23_RS05095(假基因)、AKL23_RS05070、AKL23_RS05025(UDP-N-乙酰葡糖胺转移酶),AKL23_RS05020、AKL23_RS05015和AKL23_RS05000,这些糖基转移酶编码基因对决定EPS的单糖组成起到关键的作用。AKL23_RS05055编码的翻转酶具有将重复单位输出的功能。AKL23_RS004985编码的orf14.9与生长功能相关,该基因也存在于其他嗜热链球菌的EPS基因簇中[25]。AKL23_RS004980和AKL23_RS004960分别编码磷酸酶和通透酶。此外,该基因簇中还存在3 个磷酸甘油酸变位酶的编码基因(AKL23_RS004975、AKL23_RS004970和AKL23_RS004965)。

图3 嗜热链球菌KLDS3.1012的EPS基因簇Fig. 3 Exopolysaccharides gene cluster in S. thermophilus KLDS3.1012
前面的基因组亲缘关系研究表明,菌株KLDS3.1012与嗜热链球菌ND03的基因组序列亲缘关系最近,高达99.57%。通过ACT工具对2 株菌的EPS基因簇序列进行比对分析,由图4可知,菌株KLDS3.1012 EPS基因簇与嗜热链球菌ND03的EPS基因簇具有很高的同源性,仅存在7 个倒置区域,而且中间的空白区域是由于菌株KLDS3.1012的gap造成的。

图4 嗜热链球菌KLDS3.1012 EPS基因簇的比对分析Fig. 4 Alignment of exopolysaccharides gene cluster in S. thermophilus KLDS3.1012
2.4 碳水化合物代谢能力
API 50CH碳水化合物代谢结果(图5)表明,菌株KLDS3.1012可以代谢半乳糖、葡萄糖、果糖、甘露糖、乳糖和蔗糖。虽然与其他嗜热链球菌碳水化合物代谢能力存在差异,但是菌株KLDS3.1012在碳水化合物利用方面,遗传分析与表型结果是相一致的。

图5 嗜热链球菌KLDS3.1012的API 50CH发酵结果Fig. 5 Results of API 50CH test strip on S. thermophilus KLDS3.1012
2.5 EPS的单糖组成
菌株KLDS3.1012所产的EPS通过DEAE-Sepharose Fast Flow和Sepharose CL-6B进行两步纯化,随后经三氟乙酸水解,最后用高效离子色谱测定EPS的单糖组成。由图6可知,菌株KLDS3.1012所产的EPS由鼠李糖、半乳糖和葡萄糖以2.6∶1.7∶1的物质的量比组成。在单糖组成中没有发现UDP-N-乙酰葡糖胺,然而,生物信息学分析表明菌株KLDS3.1012可以形成UDP-N-乙酰葡糖胺并且拥有UDP-N-乙酰葡糖胺转移酶,这可能是由于相关基因表达水平的不足造成的,还需要进一步的研究验证这一点。

图6 嗜热链球菌KLDS3.1012的EPS单糖离子色谱图Fig. 6 HPAEC profile of monosaccharide composition of EPS from S. thermophilus KLDS3.1012
3 讨 论
嗜热链球菌作为重要的发酵剂,从功能上看,嗜热链球菌在治疗乳糖不耐症、抗氧化、改善肠道免疫反应和缓解一些癌症方面起着至关重要的作用[26]。从代谢能力上看,嗜热链球菌不仅能够代谢碳水化合物形成乳酸,酸化乳制品,还能形成糖核苷酸产生EPS[27-28]。嗜热链球菌所产的EPS具有结构复杂和功能多样的特点,因此作为近年来的持续热点问题。随着基因组测序技术的发展,研究人员可以利用生物信息学的手段充分挖掘嗜热链球菌所合成的EPS的相关分子元件,为揭示嗜热链球菌合成EPS的机理及调控提供基础。Bolotin等[29]研究了嗜热链球菌CNRZ1066和LMG13811的糖代谢相关遗传基础;Sun Zhihong等[30]完成了ND03的全基因组测序并对其独特的EPS基因簇进行分析;Wu Qinglong等[23]通过嗜热链球菌ASCC 1275的EPS基因簇分析,发现该菌株高产EPS的相关基因;Bai Ying等[31]报道了嗜热链球菌MN-BM-A01的EPS产量和相关基因的分析;Vendramin等[32]对8 株已完成基因组测序的嗜热链球菌epsA基因的启动子进行了比较基因组学分析。本研究不仅从生物信息学层面分析了菌株KLDS3.1012的糖代谢能力及EPS基因簇,同时还利用API 50CH测定该菌株的糖发酵情况及采用高效离子交换色谱法测定EPS的单糖组成,为研究EPS的基因与结构奠定了基础。
虽然嗜热链球菌在糖代谢水平上相对保守,然而不同的嗜热链球菌菌株的糖代谢情况并不一致,嗜热链球菌基本都可以利用葡萄糖、乳糖和果糖[33],而半乳糖、甘露糖、蔗糖、麦芽糖、蜜二糖和棉子糖的利用却有菌株特异性[34-35],如嗜热链球菌AR333可以利用葡萄糖、乳糖和蔗糖[22],嗜热链球菌MTCC 5461可以利用17 种碳水化合物[36],而本研究中的菌株KLDS3.1012可以利用半乳糖、葡萄糖、果糖、甘露糖、乳糖和蔗糖。能够利用半乳糖是工业发酵菌株的优良性状,可以避免半乳糖的过量积累而影响发酵乳制品的质量。此外,利用半乳糖可以提高EPS的产量,因为半乳糖可以形成糖核苷酸。嗜热链球菌所产EPS的单糖组成及比例也都不一样,AR333和GST-6所产的EPS都由半乳糖和葡萄糖组成,但是物质的量比差异较大[5,22],DGCC 7785所产的EPS由半乳糖、葡萄糖和N-乙酰半乳糖胺组成[37],而本研究中的KLDS3.1012所产的EPS由鼠李糖、半乳糖和葡萄糖,与嗜热链球菌DGCC 7698所产的EPS具有相似性[37]。
糖核苷酸作为合成EPS的活性前体,是合成EPS的关键底物[11]。在分析菌株KLDS3.1012的糖核苷酸合成途径中发现,在其基因组中,催化UDP-葡萄糖与UDP-半乳糖相互转变的UDP-葡萄糖4-差向异构酶的编码基因高达3 个拷贝,利于二者的灵活转变,以满足形成重复单元过程中对不同糖核苷酸的需求。嗜热链球菌的EPS基因簇中参与指导EPS重复单元合成、链长、聚合与输出的基因相对保守,而糖基转移酶差别甚大,其具有多态性,目前,在51 株嗜热链球菌中存在118 个糖基转移酶,不同的糖基转移酶可以转移不同的糖核苷酸形成EPS的重复单元[38],因此糖基转移酶对EPS的结构起到决定性作用。本研究中菌株KLDS3.1012的糖基转移酶中只鉴定出半乳糖核苷酸转移酶和UDP-N-乙酰葡糖胺转移酶,此外,该菌株的EPS基因簇与嗜热链球菌ND03的EPS基因簇具有很高的同源性。
4 结 论
从基因组水平分析,菌株KLDS3.1012具有半乳糖、葡萄糖、果糖、甘露糖、乳糖和蔗糖转运系统和4 种糖核苷酸(UDP-葡萄糖、dTDP-鼠李糖、UDP-半乳糖和UDP-N-乙酰葡糖胺)合成的相关基因及1 个胞外多糖合成基因簇。表型测定结果表明菌株KLDS3.1012可以利用以上6 种碳源并能形成由鼠李糖、半乳糖和葡萄糖组成的EPS。
