瓦伦西亚橘烯生物转化生成圆柚酮
2019-04-12任婧楠张璐璐潘思轶
李 晓,范 刚*,任婧楠,张璐璐,潘思轶
(华中农业大学食品科学技术学院,环境食品学教育部重点实验室,湖北 武汉 430070)
圆柚酮为倍半萜烯类化合物,属雅槛蓝烷系的双环倍半萜酮[1]。圆柚酮在低浓度时表现出浓郁的柚子香气,并带有甜橙、木香香韵,但味苦,其气味阈值较低,仅为1 μg/L[2]。圆柚酮因具有宜人的柑橘香气而受到人们的关注,自其被发现以来,关于圆柚酮的天然分布、晶体结构及其多种立体异构体的香味特征,都得到广泛的研究[3-4]。圆柚酮价格十分昂贵,由于它在天然产物中含量很低,而且其具有立体异构体,几乎无法分离得到,且提取成本很高,所以圆柚酮的提取及应用受到很大限制[5-6]。
作为柚味香精的重要成分,圆柚酮常被用于食品饮料及日化产品中,其在饮料中的用量一般为2~6 mg/L;在日化香精配方中,圆柚酮与其他柑橘类精油(如苦橙油、香柠檬油等)配合使用,可以增加产品柑橘香调[7]。近年来,国外关于圆柚酮的研究更加侧重于生理作用及提取工艺。有研究报道,从益智药材中分离得到的圆柚酮,在抗实验性胃溃疡、抑制脂多糖活化等方面具有显著活性[8]。也有研究发现圆柚酮对玉米象和米象2 种害虫具有驱虫效果[9]。此外,圆柚酮还对地下白蚁具有明显的驱避和毒性作用,同时可以降低白蚁体细胞的脂肪比例[10-12]。谢建春等[13-14]发现蒸馏萃取法及延长蒸馏时间可以提高柚皮油中圆柚酮的含量。除物理方法外,圆柚酮还可以通过化学合成的方法进行制备。目前主要的合成方法是使用瓦伦西亚橘烯作为底物,使用重铬酸盐进行氧化,或在叔丁基过氧化氢存在下使用催化剂进行氧化,通过三步反应转化得到圆柚酮[15-17]。

图1 瓦伦西亚橘烯转化为圆柚酮Fig. 1 Conversion of valencene to nootkatone
采用化学合成法生产圆柚酮由于使用大量重金属催化剂,如铬酸叔丁酯、三氧化铬等,会对环境造成严重的污染,并存在一定的安全问题,且不属于天然香料,目前已有学者采用微生物及其代谢酶进行转化生产研究(图1)[18-21]。欧洲和美国食品法规明确规定,采用化学合成法得到的圆柚酮产品不能作为一种天然香料进行销售和使用,而通过微生物转化生产的香料被认为是天然的。GB 29938—2013《食品用香料通则》规定通过酶法或微生物法工艺生产的香料也被认为是天然的。近些年来,随着人们食品安全意识的提高,人们更加倾向选择天然物质作为添加剂,这鼓励了利用生物转化法生产天然香料的研究工作[22]。目前国内外有关瓦伦西亚橘烯生物转化生产圆柚酮的研究还很少。本研究旨在通过比较3 株不同微生物菌种转化瓦伦西亚橘烯生产圆柚酮的效果,筛选适于转化瓦伦西亚橘烯生产圆柚酮的菌种,优化发酵培养基成分,增加瓦伦西亚橘烯转化生成圆柚酮的转化量,并提高其转化率,降低天然香料圆柚酮的生产成本。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与试剂
黑曲霉(Aspergillus niger)、毛霉(Mucor sp.)、解脂耶氏酵母(Yarrowia lipolytica) 上海生物网菌种保藏中心(RCCC)。
无水乙醇、磷酸、吐温80(分析纯) 国药集团化学试剂有限公司;瓦伦西亚橘烯(>70.0%) 美国Sigma公司;圆柚酮(>97.0%) 日本东京化成工业株式会社。
1.1.2 培养基
马铃薯琼脂(PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂15~20 g,蒸馏水1 000 mL,121 ℃灭菌20 min,冷却放置斜面。
麦芽汁琼脂培养基:麦芽汁150 mL,琼脂3 g,121 ℃高压蒸汽灭菌20 min。高温灭菌后倒平板。
蛋白胨培养基:1.5%蔗糖,1.5%葡萄糖,0.5%蛋白胨,0.1% K2HPO4,0.05% KCl,0.001% FeSO4·7H2O,蒸馏水,pH 7。121 ℃高压蒸汽灭菌20 min。
YPD培养基:2%葡萄糖,1%酵母膏,2%蛋白胨。
1.2 仪器与设备
6890N/5975B气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)联用仪 美国Agilent公司;萃取纤维头(50/30 μm DVB/CAR/PDMS)、固相微萃取头(solid phase microextraction,SPME) 美国Supelo公司;DF-101s集热式恒温加热磁力搅拌器郑州长城科工贸有限公司;25×16型血球计数板 上海求精生化试剂仪器有限公司;LDZX-50KBS高压灭菌锅上海申安医疗器械厂。
1.3 方法
1.3.1 标准曲线的绘制
以无水乙醇为溶剂,分别配制200、400、600、800、1 000 mg/L的标准圆柚酮溶液,采用SPME-GC-MS检测分析,以峰面积为纵坐标、圆柚酮质量浓度为横坐标绘制标准曲线,得到标准曲线方程为Y=380 602X+240 216,R2=0.992 6。
1.3.2 菌种活化
冻干菌种管冷藏保存在5~10 ℃。用无菌吸管吸取0.3~0.4 mL生理盐水,滴入管内,轻轻振荡,使冻干菌体溶解成悬浮状液体。取约0.2 mL菌悬液,转接于培养基平板上,在每个平板的底部做好标记,30 ℃过夜培养长出细菌单菌落。将平板用封口膜封好置于4 ℃冰箱中备用。
将A. niger、Mucorsp.接种于PDA培养基斜面上,Y. lipolytica接种于麦芽汁琼脂培养基上,30 ℃培养3~7 d,待孢子长出后置于4 ℃冷藏保存。每个月用斜面培养基转接活化1 次。
1.3.3 孢子悬浮液制备与底物预处理
从传代的菌种培养基中挑取部分菌丝接种于灭菌的斜面培养基上,30 ℃恒温培养4 d。以适量无菌水从生长良好的斜面培养基上洗下孢子,在摇床上30 ℃、200 r/min振荡4 h,打散孢子。然后以体积分数0.01%吐温80为接种剂调整孢子悬浮液浓度为106~107个/mL[14,23]。
底物瓦伦西亚橘烯用0.22 μm微孔滤膜过滤除菌,4 ℃保存。
1.3.4 菌体预培养与底物的转化
1.3.4.1A. niger孢子悬浮液转化
取1 000 μL的A. niger孢子悬浮液接种于装有50 mL蛋白胨培养基(pH 7.0)摇瓶中。30 ℃、100 r/min培养3 d。然后加入瓦伦西亚橘烯(0.92 mg/mL),接着培养4 d。
1.3.4.2Mucorsp.孢子悬浮液转化
取1 000 μL的Mucorsp.孢子悬浮液接种于装有50 mL蛋白胨培养基的摇瓶中,30 ℃、100 r/min培养7 d。然后加入瓦伦西亚橘烯(0.92 mg/mL),30 ℃进一步培养4 d。
1.3.4.3Y. lipolytica孢子悬浮液转化
取1 000 μL的Y. lipolytica菌种悬浮液接种于装有50 mL的YPD培养基摇瓶中,30 ℃、100 r/min培养3 d。然后加入瓦伦西亚橘烯(0.92 mg/mL),30 ℃继续培养4 d。然后10 000 r/min离心10 min,取上清液,检测转化产物。所有实验同时设置底物空白对照(只添加底物,不添加菌种)和菌株空白对照(只添加菌种,不添加底物),重复3 次。
1.3.5 转化产物分析
准确量取5 mL离心后的发酵液移入20 mL钳口样品瓶中,加入1.8 g NaCl以促进挥发性成分的挥发,用聚四氟乙烯隔垫密封,于磁力搅拌器上40 ℃加热平衡15 min后,通过隔垫插入己活化好的50/30 μm DVB/CAR/PDMS萃取头(270 ℃活化1 h),推出纤维头,顶空吸附40 min后,插入GC-MS进样口解吸5 min,分别测定黑曲霉转化瓦伦西亚橘烯在24、48、72 h和96 h时的转化产物。
GC条件:6890N型气相色谱仪,毛细管柱为HP-5(30 m×250 μm,0.25 μm),程序升温,起始温度40 ℃,保持3 min,以3 ℃ /min升至160 ℃,保持2 min,再以8 ℃/min升至220 ℃,保持3 min。进样口温度250 ℃。MS条件:5975B质谱仪,离子源温度230 ℃,四极杆温度150 ℃,电子电离源,电子能量70 eV,质量范围为45~550 u[24]。
定性分析:采用GC-MS联用仪进行分析鉴定,并利用C6~C30正构烷烃的保留时间计算各个色谱峰的保留指数。分析结果运用计算机谱(NIST05/WILEY7.0)进行初步检索和资料分析,再结合文献的保留指数进行比对并进行人工谱图解析,确认挥发性物质的各个化学组成。
定量分析:采用外标法进行定量圆柚酮。其他产物定量使用环己酮作为内标,以环己酮的峰面积与香气物质的峰面积进行对比计算,以此定量。成分含量及转化率的计算见下式:

1.3.6 解脂耶氏酵母发酵培养基组成的优化
1.3.6.1 发酵培养基中碳源、氮源、无机盐对转化的影响
以YPD培养基为基础,并分别以30 g/L质量浓度的葡萄糖、麦芽糖、甘油、可溶性淀粉、蔗糖、β-环糊精和α-乳糖作为唯一碳源,考察碳源种类对产物圆柚酮转化率的影响。
以YPD培养基为基础,分别以20 g/L酵母膏、蛋白胨、牛肉膏、(NH4)2SO4和NH4Cl作为单一氮源,考察氮源种类对产物圆柚酮转化率的影响。
以Y P D培养基为基础,分别添加0.5 g/L的ZnSO4·7H2O、CaC12、MnSO4·H2O、CuSO4·5H2O、FeSO4·7H2O、MgSO4·7H2O,考察无机盐对圆柚酮转化率的影响。
1.3.6.2 培养基成分正交优化

表1 培养基正交设计试验L9(33)Table 1 Coded levels and corresponding actual levels of independent variables used in L9 (33) orthogonal array design g/L
通过对培养基碳源、氮源和无机盐的考察,确定最适碳源、氮源和无机盐,设计3因素3水平正交试验,如表1所示。以α-乳糖、蛋白胨和FeSO4·7H2O质量浓度为变量、以圆柚酮产量为指标优化培养基组成。
1.4 数据统计与分析
由3 次平行实验测定得到的各实验平均值及标准偏差采用Microsoft Office Excel 2010进行计算。不同组别间的显著性采用SPSS Statistics 20.0软件进行F值检验及单因素方差分析。
2 结果与分析
2.1 黑曲霉转化瓦伦西亚橘烯的产物分析

表2 黑曲霉转化瓦伦西亚橘烯的产物Table 2 Conversion products of valencene by A. niger mg/L
柑橘的香气物质主要由单萜类和单萜醇组成,而酚类化合物、去甲异戊二烯类化合物和其他挥发物对柑橘香气也起着重要的作用[25]。如表2所示,黑曲霉转化瓦伦西亚橘烯的产物包括D-柠檬烯、α-松油醇、香芹醇、香芹酮、胡椒酮、水芹醛、β-榄香烯、α-紫罗兰酮、α-香附酮9 种物质。在最初的24 h,产物有D-柠檬烯、香芹醇、香芹酮、水芹醛、其中D-柠檬烯质量浓度最高,为(14.74±2.55)mg/L。在接下来的48 h,产物香芹酮和水芹醛含量继续增加,而D-柠檬烯、香芹醇含量减少,同时还有5 种新的物质被检出,包括α-松油醇、胡椒酮、β-榄香烯、α-紫罗兰酮、α-香附酮;当转化72 h时,检测不出香芹醇、α-紫罗兰酮和α-香附酮。α-香附酮为圆柚酮的同分异构体,其在96 h也被检出。最近研究发现,葡萄基因组中含有一大类单萜烯合成酶和倍半萜合成酶,其中许多已被确定能够生产芳香单萜醇,如香叶醇、芳樟醇和α-松油醇等[26-27]。转化生成产物中,柠檬烯是除圆柚酮外产量最高的产物,据文献[28]报道,柠檬烯在进行微生物转化时,主要发生环氧化反应以及水解反应,其氧化可产生l、2位环氧化物质,在发生水解反应时,主要水解产物为柠檬烯-1,2-二醇;在6位发生羟基化反应以及羰基化反应时,其产物主要为香芹酮以及二氢香芹酮;在8位发生氧化反应时,产物为松油醇。瓦伦西亚橘烯微生物转化过程中,α-松油醇、香芹酮等可能为柠檬烯的代谢产物。

图2 黑曲霉转化瓦伦西亚橘烯为圆柚酮的转化量以及转化率Fig. 2 Amount and conversion rate of nootkatone biotransformed by A. niger
如图2所示,在24 h内,圆柚酮有少量生成,转化量达到(4.66±2.75)mg/L;在24~48 h,圆柚酮大量生成,其质量浓度达到(140.94±30.26)mg/L;当转化至72 h,圆柚酮产量开始降低,可能是由于产物不断生成积累使得转化量降低,转化圆柚酮受到抑制;当转化至96 h,产物转化量持续降低,转化量为(91.97±9.80)mg/L。在转化过程中,圆柚酮的转化率最高达到(15.32±3.29)%。曲霉的生物活性很高,有关曲霉生物转化萜类物质的研究,也有一些报道。Furusawa等[18]发现黑曲霉(Aspergillus niger)转化瓦伦西亚橘烯5 d后,并未发现生成圆柚酮。Rocha等[29]研究发现土壤曲霉(Aspergillus terreus)可以对倍半萜内酯生物转化产生一种罕见的衍生物,表明土壤真菌可能在倍半萜内酯的生物转化中发挥作用,从而导致它们的化学结构发生异常变化。
2.2 毛霉转化瓦伦西亚橘烯的产物分析

表3 毛霉转化瓦伦西亚橘烯的产物Table 3 Conversion products of valencene by Mucor sp.mg/L
毛霉能对许多自然物质进行生物转化[30]。如表3所示,毛霉转化瓦伦西亚橘烯的产物包括D-柠檬烯、α-松油醇、香芹醇、香芹酮、水芹醛、紫苏醇、肉豆蔻醛和α-香附酮8 种物质,这与黑曲霉转化产物有所相同。在最初的24 h,瓦伦西亚橘烯被转化为右旋萜二烯(D-柠檬烯),其质量浓度为(15.61±4.34)mg/L。在2 4~4 8 h,D-柠檬烯含量开始降低,质量浓度为(1.6 2±0.3 7)m g/L,同时新生成5 种产物,包括α-松油醇、香芹醇、香芹酮、紫苏醇、α-香附酮;当转化至72 h,α-香附酮含量持续增加,D-柠檬烯含量保持稳定,另外,α-松油醇、香芹醇、香芹酮、紫苏醇含量降低,同时得到一种新的产物肉豆蔻醛((5.52±2.69)mg/L);在转化至96 h,各种物质的含量趋于稳定,检出新的物质水芹醛((7.09±2.59)mg/L),未检测到肉豆蔻醛。柠檬烯是除圆柚酮外产量最高的产物,柠檬烯在7位发生甲基的羟基化反应时,可以得到产物紫苏醇。瓦伦西亚橘烯微生物转化过程中,α-松油醇、香芹醇、香芹酮、紫苏醇等可能为柠檬烯的代谢产物。

图3 毛霉转化瓦伦西亚橘烯为圆柚酮的转化量以及转化率Fig. 3 Amount and conversion rate of nootkatone biotransformed by Mucor sp.
如图3所示,在初始24 h,圆柚酮有少量生成,产物转化量达到(3.16±4.31)mg/L;在48~72 h,圆柚酮大量生成,其质量浓度达到(112.73±23.04)mg/L;当转化至72 h,圆柚酮转化量持续增加,底物瓦伦西亚橘烯继续转化,圆柚酮转化量达到(137.67±14.02)mg/L;当转化至96 h,产物含量基本保持稳定,转化量为(142.18±30.90)mg/L。在转化过程中,圆柚酮的转化率最高达到(15.45±3.36)%,其转化能力和黑曲霉差不多。毛霉能够选择性地将瓦伦西亚橘烯转化为圆柚酮,Furusawa等[31]发现从苔类植物黏附的土壤中分离出的一株菌种,经鉴定为毛霉,其转化瓦伦西亚橘烯生成4 种转化产物,其中圆柚酮的转化率达82%,本实验转化率要低于其转化率,可能是由于其所用菌株为自然分离,虽然和Mucorsp.同属一个种,但生物转化能力不同。
2.3 解脂耶氏酵母转化瓦伦西亚橘烯的产物分析
如表4所示,解脂耶氏酵母对瓦伦西亚橘烯的转化产物包括D-柠檬烯、α-松油醇、香芹醇、香芹酮、紫苏醇、甲基丁香酚、石竹烯和α-香附酮8 种物质。在最初的24 h,检出的产物为D-柠檬烯、α-松油醇、香芹酮、甲基丁香酚、石竹烯和α-香附酮,其中石竹烯质量浓度最高,达到(8.29±1.17)mg/L。在48~72 h,这6 种产物继续积累,同时生成2 种新的物质,包括香芹醇((13.53±1.71)mg/L)和紫苏醇((1.15±0.13)mg/L);当转化至72 h,所有转化产物含量都有所降低,同时并未检测到紫苏醇,香芹酮质量浓度最低((0.22±0.12)mg/L);转化至96 h,D-柠檬烯、α-松油醇、香芹醇和石竹烯含量继续降低,α-香附酮质量浓度有所增加((8.63±1.02) mg/L),未检测到香芹酮,紫苏醇和甲基丁香酚。瓦伦西亚橘烯微生物转化过程中,柠檬烯在48 h产量很高,α-松油醇、香芹醇、香芹酮、紫苏醇等可能为柠檬烯的代谢产物。

表4 解脂耶氏酵母转化瓦伦西亚橘烯的产物Table 4 Conversion products of valencene by Y. lipolytica mg/L
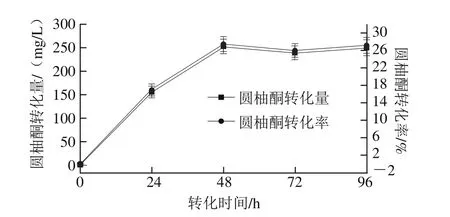
图4 解脂耶氏酵母转化瓦伦西亚橘烯为圆柚酮的转化量以及转化率Fig. 4 Amount and conversion rate of nootkatone biotransformed by Y. lipolytica
如图4所示,在初始24 h,圆柚酮有大量生成,产物转化量达到(155.75±12.64)mg/L;在48~72 h,圆柚酮持续生成,其转化量达到(252.52±15.79)mg/L;当转化至72 h,圆柚酮含量保持稳定,但有所降低;当转化至96 h,产物含量基本保持稳定,转化量为(249.62±17.23)mg/L。在转化过程中,圆柚酮转化率最高达到(27.45±1.72)%,其转化能力与黑曲霉和毛霉相比,转化率更高。Palmerín-Carre等[22]利用Y. lipolytica2.2ab菌株,进行圆柚酮转化实验,通过加入3.2 g/L底物,在双相系统条件下对瓦伦西亚橘烯进行转化,最终得到圆柚酮转化量为216.9 mg/L,在单一有机相的条件下对瓦伦西亚橘烯进行转化,其转化量达217.4 mg/L。与本实验相比,加入0.92 g/L的底物,通过解脂耶氏酵母转化生成圆柚酮的含量略高于其研究,主要原因可能是降低底物质量浓度,减少了底物的抑制作用。在Wriessnegger等[32]的研究中,毕赤酵母(Pichia pastoris)被用作全细胞生物催化剂,从橙子的丰富香气化合物瓦伦西亚橘烯中生产圆柚酮,并发现毕赤酵母醇脱氢酶和截短的羟基-甲基戊二酰辅酶A还原酶显著增强圆柚酮的产量(208 mg/L)。利用酶进行合成转化瓦伦西亚橘烯也有相应的研究。另外,阿拉斯加雪松酵母中瓦伦西亚橘烯合成酶和瓦伦西亚橘烯氧化酶可以共表达转化瓦伦西亚橘烯生成圆柚酮(144 μg/L),在不采用双相介质(正十二烷为有机相)的条件下,仅生成3 μg/L的圆柚酮[33],其转化量远低于本实验。在单一水相的条件下,菌种Phanerochaete chrysosporium转化瓦伦西亚橘烯生成圆柚酮产量达110.3 mg/L,在双相体系条件下,单胞菌Botryodiplodia theobromae转化瓦伦西亚橘烯生成圆柚酮产量达239.7 mg/L[22],而本研究发现解脂耶氏酵母的转化能力要高于这两株菌。Gavira等[34]利用酿酒酵母(Saccharomyces cerevisiae),采用一种基因挖掘的方法,从高等植物中筛选出4 种潜在的P450酶,并在重组酵母微粒体中筛选相应的酶,生物转化实验产生β-圆柚酮和圆柚酮,同时,其随着底物质量浓度的增加而降低,本实验也得到相同的结果。
2.4 解脂耶氏酵母发酵培养基组成的优化结果
上述实验结果显示,解脂耶氏酵母的转化能力要明显高于黑曲霉和毛霉,故选取解脂耶氏酵母菌株进行发酵培养基成分的优化。
2.4.1 发酵培养基中碳源对转化效果的影响
由图5A可知,选取的7 种碳源均可以促进菌种生长,但其转化瓦伦西亚橘烯生成圆柚酮的转化量不同。其中α-乳糖最有利于瓦伦西亚橘烯转化生成圆柚酮,因为乳糖是比较易被微生物利用的糖,是促进细胞快速生长的一种有效的糖类物质。α-乳糖作为碳源进行菌种转化时,其转化圆柚酮产量达到228.16 mg/L,转化率达到24.80%。相较于其他几种碳源,其转化效率更高,其中蔗糖的转化效果与α-乳糖相差无几,其转化圆柚酮质量浓度达到207.47 mg/L,转化率为22.55%。糊精相较于其他6 种碳源,其转化效率最低,转化生成圆柚酮的量仅为8.98 mg/L,其转化率也仅为0.98%。
由图5B可知,在实验选取的5 种氮源进行菌种转化的过程中,蛋白胨最有利于瓦伦西亚橘烯转化生成圆柚酮。其在同等质量浓度的氮源条件下,其转化瓦伦西亚橘烯为圆柚酮的量最高,其转化生成圆柚酮质量浓度达到367.09 mg/L,转化率达到39.90%。在利用蛋白胨为唯一氮源的条件下,其转化的能力要明显高于其他4 种氮源,其中包括2 种无机氮源。
无机盐离子大部分作为酶的辅基和激活剂,维持细胞结构和生物大分子的稳定性,通过控制细胞的氧化还原电位,调节和维持细胞的渗透压平衡,并作为能量来源。通常在低浓度条件下,无机盐能够促进微生物生长和产物合成,而在高浓度时常表现出明显的抑制作用[35]。P、S、K、Mg等元素可以参与细胞的组成,并具有能量转移、细胞透性调节等功能。如图5C所示,在培养基中添加少量的Fe2+、Cu2+后对于转化具有促进作用,可能是因为Fe2+、Cu2+是P450酶系需要的离子,P450酶能将Fe2+氧化得到电子[36]。由于Fe2+明显的促进作用,其转化圆柚酮的量达到(435.95±24.40)mg/L,转化率达到(47.38±2.65)%,因此,后续实验选取其作为金属盐进行培养基优化。

图5 碳源(A)、氮源(B)以及无机盐(C)对圆柚酮转化量以及转化率的影响Fig. 5 Effects of different carbon sources (A), nitrogen sources (B) and metal ions (C) on conversion rate of nootkatone
2.4.2 培养基正交试验结果
如表5所示,从转化结果以及转化率来看,FeSO4·7H2O、α-乳糖和蛋白胨3 个因素对瓦伦西亚橘烯转化生成圆柚酮转化量的影响顺序为:FeSO4·7H2O>α-乳糖>蛋白胨。均值K代表同一因素不同水平的重要性,其中K值越高,对此因素的影响越大[37]。通过各因素组合,发现试验7最有利于解脂耶氏酵母转化瓦伦西亚橘烯为圆柚酮,其组合为α-乳糖40 g/L、蛋白胨15 g/L、FeSO4·7H2O 0.6 g/L,圆柚酮转化量达到(457.32±76.11)mg/L,圆柚酮转化率达到49%。利用初始YPD培养基培养解脂耶氏酵母转化生成圆柚酮的转化量仅为(252.52±15.79)mg/L,转化率为(27.45±1.72)%,优化培养基后,发酵培养基的转化率提高了21.55%。可能是由于初始YPD培养基是适合几乎所有酵母生长的培养基,但是对解脂耶氏酵母转化瓦伦西亚橘烯并不是很适合,通过正交试验,可以得到其最适合转化的培养基成分。
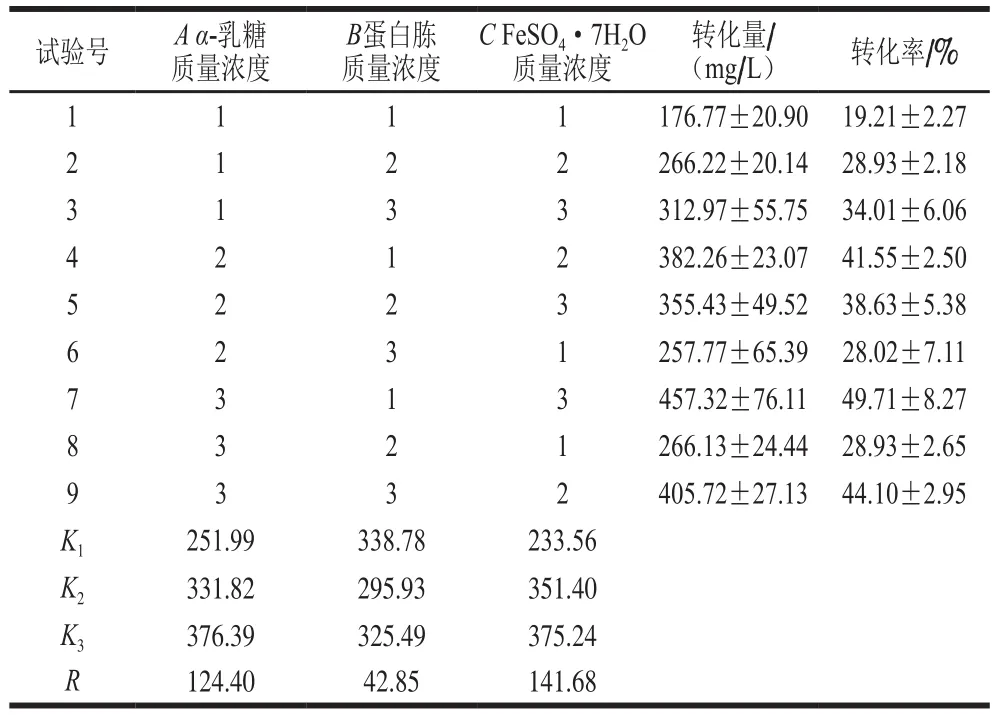
表5 培养基正交试验的转化结果Table 5 Orthogonal array design with experimental results
3 结 论
本实验利用SPME-GC-MS分析3 株真菌转化瓦伦西亚橘烯的转化产物,共检出14 种转化产物,其中,D-柠檬烯、α-松油醇、香芹醇、香芹酮和
α-香附酮在3 种菌株的转化产物中均被检出。3 种菌株都可对瓦伦西亚橘烯进行转化并生成圆柚酮,其中解脂耶氏酵母(Y. lipolytica)转化能力最强,在48 h时生成(252.52±15.79)mg/L圆柚酮,转化率为(27.45±1.72)%,表现出良好的转化能力。对发酵培养基进行优化后,圆柚酮转化量达到(457.32±76.11)mg/L,圆柚酮转化率达到49%,和未优化的发酵培养基相比,转化率提高了21.55%。
