几株百菌清敏感海洋发光细菌的分类地位分析
2019-04-12段效辉张群李金庆刘鹏王文雯王颖
段效辉,张群,李金庆,刘鹏,王文雯,王颖
(1.烟台出入境检验检疫局检验检疫技术中心,山东烟台264000;2.济南出入境检验检疫局检验检疫技术中心,山东济南250000)
海洋环境的特异性带来了海洋微生物在物种和生态功能上的多样性,其中的发光细菌就是一类在正常的生理条件下能够发射可见荧光(荧光波长在450 nm~490 nm)的细菌,该类细菌在黑暗处肉眼可辨[1]。近年来,学者根据发光细菌发光强度的变化与外来受试物的毒性大小有一定相关性,在各种环境监测中把发光细菌发光强度作为测定环境中有毒物质的指标,与其它检测方法相比具有快速、灵敏、操作简便、成本低廉等优点,近年来已被广泛应用于水环境生物毒素检测[2-3],环境样品毒性测试[4-6],食品安全性检测[7],致癌物质生物毒性检测[8]等方面。
百菌清是一种广谱性杀菌剂,有多重剂型,近年来在农业生产中得到广泛应用。由于其对植物体具有的良好黏着特性,且本身降解速度较慢,而大量残留于果蔬、土壤以及水环境中[9-10]。百菌清在环境中的累积效应,可对鱼类、鸟类等动物产生高毒性,也可对人类的内分泌系统造成较大干扰[11]。
目前气相色谱法和液相色谱法是用于百菌清检测的两种主要方法,但由于方法前处理复杂、需要仪器昂贵等原因,而使得其应用具有一定的局限性[12-14]。
发光细菌对污染物生物毒性的高度敏感和易于检测,使发光细菌分析法成为一种简便、灵敏、快速的急性毒性检测方法。目前国内外发光细菌法大多用来监测环境、土壤、水质等的急性毒性,用于食品中多菌灵、氯霉素等农兽药残留的检测及毒性评价也得到一定发展[15]。
本文从海洋生物中筛选对百菌清敏感的发光细菌,同时利用形态学观察、16S rDNA 序列测定、限制片段长度多态性(amplified ribosome DNA restriction analysis,ARDRA)分析、构建系统发育树等方法,对从青岛海域新鲜海鱼中分离纯化得到的发光细菌进行形态、分子鉴定及分类地位分析,为后续开展海洋发光细菌检测百菌清方法的建立奠定基础。
1 材料与方法
1.1 培养基
发光细菌固体培养基:甘油3 mL,酵母粉5 g,胰蛋白胨5 g,碳酸钙1 g,琼脂20 g,陈海水1 000 mL,pH7.8~8.0,121 ℃灭菌20 min。
发光细菌液体培养基:酵母粉5 g,胰蛋白胨5 g,氯化钠30 g,磷酸氢二钠5 g,磷酸二氢钾1 g,甘油3 mL,pH 7.6,121 ℃灭菌20 min。
海水2216E 琼脂斜面培养基:蛋白胨5 g,酵母粉1 g,磷酸铁0.01 g,琼脂20 g,陈海水1 000 mL,pH 7.6,121 ℃灭菌20 min。
金黄色葡萄球菌(ATCC25923):烟台出入境检验检疫局检验检疫技术中心动植物检疫实验室购买并保存。
1.2 主要试剂和仪器
27F 和1492R 16S rDNA 序列上下游引物、DNA Marker、Ex Taq 酶及限制性内切酶AfaⅠ、MspⅠ:宝生物工程(大连)有限公司;GoTaqGreen Master Mix 溶液:美国普洛麦格(Promega)公司;革兰氏染色试剂盒:北京陆桥技术股份有限公司;Epgradient PCR 扩增仪:德国艾本德(Eppendorf)股份公司;Universal Hood Ⅱ凝胶成像仪:美国伯乐(Bio-Rad)公司;ALB128 金属浴:美国赛默飞世尔科技公司(Thermo Fisher Scientific);Centrifuge 5417R 高速冷冻离心机:德国艾本德(Eppendorf)股份公司;SPARK 10M 酶标仪:美国帝肯(TECAN)贸易有限公司。
1.3 发光细菌的分离与纯化
将青岛市前湾渔码头新鲜捕获的海鱼,于无菌环境下,用无菌3%NaCl 溶液冲洗鱼体表杂物后,用灭菌镊子、解剖刀分别采集5 片~6 片鱼鳞、全部鱼鳃、大部分鱼肠(用解剖刀剖开鱼肠,使内容物可以流出),然后分别放入含有玻璃珠的45 mL 无菌3%NaCl 溶液,并置于涡旋震荡器上振荡2 min~3 min,充分混匀后放置于无菌超净台中备用。在无菌超净台中,用移液枪向倾注有发光细菌固体培养基的平板中注入800 μL 3%NaCl 溶液,分别吸取混匀后的200 μL 鱼鳞、鱼鳃、鱼肠悬液同样注入到平板培养基中,再用涂布棒涂布均匀,一式两份,做好标记。将处理好的平板放入28 ℃培养箱中,倒置培养,直到有菌落生成,取出,置于暗室观察,对发出荧光的菌落做好标记,编号。用接种针挑取标记好的发光菌落,进行连续划线接种,直到得到可在暗室发出荧光的纯菌落。
1.4 发光细菌对百菌清敏感性的筛选
1.4.1 百菌清对发光细菌生长的影响
采用杯碟法筛选生长特性对百菌清敏感的海洋发光细菌。分离到的海洋发光细菌接种于2216E 平板,于28 ℃培养24 h 后,以无菌生理盐水制成均匀悬液,至OD600nm=0.5,约106CFU/mL。吸取菌悬液0.2 mL 涂布于2216E 平板,静置1 min 后,放置4 个灭菌的牛津杯于平板上,每个牛津杯间隔一定的距离。将其中3个牛津杯中加入浓度为5 mg/L 的百菌清溶液100 μL,最后一个加入无菌水100 μL 做对照。将平板小心放置于25 ℃恒温培养箱培养24 h,观察记录抑菌圈直径大小。根据美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)药物敏感性试验标准,判断菌株对百菌清的敏感程度。抑菌圈直径越大,则发光细菌生长对百菌清的敏感性越强。
1.4.2 百菌清对发光细菌发光强度的影响
制备不同浓度的百菌清溶液,分别与过夜培养的发光细菌悬液反应,以酶标仪测定百菌清作用前后发光细菌的发光强度,计算发光细菌的发光抑制效率,抑制率高,则敏感性好。按照下面的公式计算百菌清对发光细菌的发光抑制效率:

式中:X为发光抑制效率,%;Kc为未添加百菌清溶液中发光细菌发光强度;Kt为待测溶液中发光细菌发光强度。
发光抑制效率越大,则发光细菌的发光对百菌清的敏感性越强。
1.5 发光细菌的鉴定
1.5.1 聚合酶链式反应(polymerase chain reaction,PCR)模板的制备
取过夜培养的发光细菌菌悬液3 μL 转入装有100 μL 灭菌双蒸水的1.5 mL 离心管中,在99 ℃水浴10 min,10 000 g 离心10 min,冷却后取上清液作为PCR 反应模板。
1.5.2 16S rDNA PCR 扩增
发光细菌16S rDNA PCR 扩增所用引物为细菌16S rDNA 通用引物,上游引物27F:5’-AG
AGTTTGATCCTGGCTCAG-3’;下游引物1492R:5’-TACGGTTACCTTGTTACGACTT-3’。
PCR 反应体系(25 μL)为:GoTaq Green Master Mix 12.5 μL,上游引物27F 1 μL,下游引物1492R 1 μL,模板DNA 2.5 μL,ddH2O 8 μL。PCR 反应条件为:95 ℃预变性3 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,30 个循环,72 ℃延伸10 min。PCR产物用1.5%琼脂糖凝胶电泳进行检测。
1.6 16S rDNA PCR产物ARDRA 分析
采用两种限制性内切酶Afa I、Msp I 对发光细菌16S rDNA PCR 扩增产物片段进行同步双酶切,酶切反应体系(20 μL)为:PCR产物8 μL,内切酶各1 μL,10×Buffer 2 μL,0.1%BSA 2 μL,去离子水6 μL。37 ℃恒温3 h 后,酶切产物加2 μL 10×loading Buffer 终止反应。取酶切产物10 μL 用2.0%琼脂糖凝胶电泳检测。
1.7 16S rDNA PCR产物测序及系统发育树构建
16S rDNA PCR产物经纯化后测序。测序所得基因序列提交到NCBI 网站(http://blast.ncbi.nlm.nih.gov)进行Blast 比对。采用MEGA 5.05 软件以Neighborjoining 统计方法自展1 000 次进行系统发育树构建。
2 结果与分析
2.1 发光细菌的分离及形态观察
经分离纯化培养后共获得17 株发光细菌见表1。

表1 发光细菌在鱼体寄生部位Table 1 Parasitic position of luminous bacteria in fresh sea fish
17 株细菌均在暗室中发出明亮的蓝绿色可见光,具有发光特性;革兰氏阴性菌;在发光固体培养基上菌落为圆形类似馒头状,表面光滑湿润,边缘整齐或呈锯齿状;油镜下观察,呈杆状或弧状。在鱼鳞、鱼鳃和鱼肠中均分离获得发光细菌。其中生物体肠道内分离获得发光细菌数量相对较多,是分离发光细菌的重要资源。
2.2 发光细菌对百菌清敏感性测试
有毒有害物质对发光细菌发光的影响可分为通过细胞质毒性抑制细胞代谢过程和直接抑制参与发光反应的酶的活性两种方式[16]。本部分从生长和发光两方面测定发光细菌对百菌清的敏感特性。
2.2.1 百菌清对发光细菌生长的影响
根据我国食品中农药最大残留限量规定[17],菠菜、黄瓜等蔬菜以及西瓜、甜瓜中百菌清限量一般为5 mg/L,而日本果蔬农残限量标准中,百菌清在叶菜中的残留要求在1 mg/L~6 mg/L。本试验遂选取浓度为5 mg/L 的百菌清溶液利用杯碟法从分离得到的17 株发光细菌中筛选百菌清敏感株。根据美国临床实验室标准化协会(CLSI)标准与指南,大多数情况下,抑菌圈直径在13 mm 以上的情况,说明菌株对该抗生素敏感。试验结果发现,百菌清可抑制多株发光细菌的生长,排除重复分离株,有6株发光细菌的抑菌圈直径超过了13 mm,抑菌圈直径最高可达25 mm,较低的一株Ft-2-1 也在16 mm,具体结果见表2。
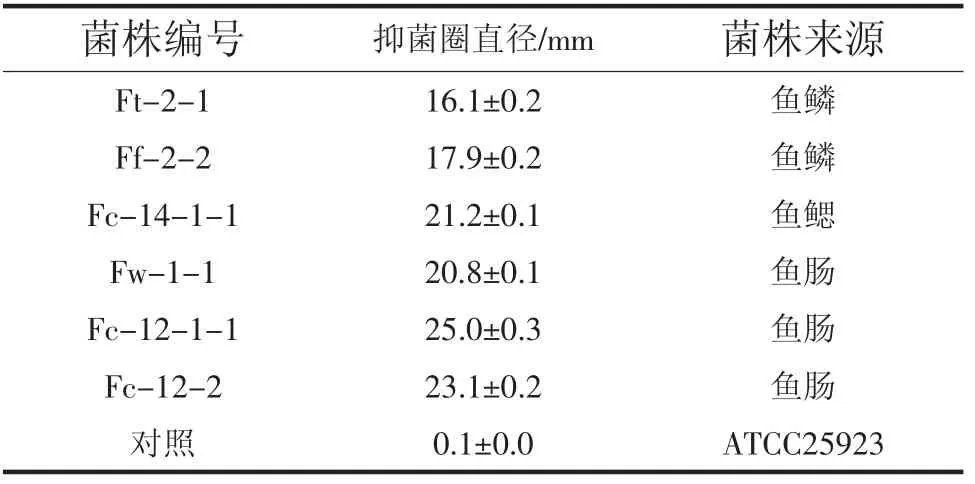
表2 百菌清对菌株生长的影响Table 2 Influence of chlorothalonil to the growth of each strain
2.2.2 百菌清对发光细菌发光强度的影响
发光细菌的发光强度能够在一定浓度范围内对某些有害物质呈现一定比例关系,是用于有害因子检(监)测的重要依据。制备不同浓度的百菌清溶液,与发光细菌反应,测定百菌清溶液对发光细菌发光强度的抑制情况,测定发光细菌的发光对百菌清的敏感特性,结果见图1。
结果显示,对百菌清具有生长敏感特性的6株发光细菌,其发光强度也受到百菌清不同程度的影响,但不具备一一对应关系。其中抑菌圈直径相对较低的菌株Ft-2-1,其发光强度受到百菌清较大影响,65%以上的发光强度被抑制。相反的,抑菌圈直径最大的菌株Fc-12-1-1,其发光抑制效率都小于20%,菌株Fw-1-1 也表现出类似特性。菌株Fc-12-2 和Fc-14-1-1 在较强的生长敏感性的同时也表现出较好的发光敏感性,其发光抑制率都达到了60%。在6株发光细菌中,菌株Ff-2-2 对百菌清的敏感特性较稳定,同时具备了生长和发光敏感特征,且其发光强度同百菌清浓度呈现较好的线性比例关系。
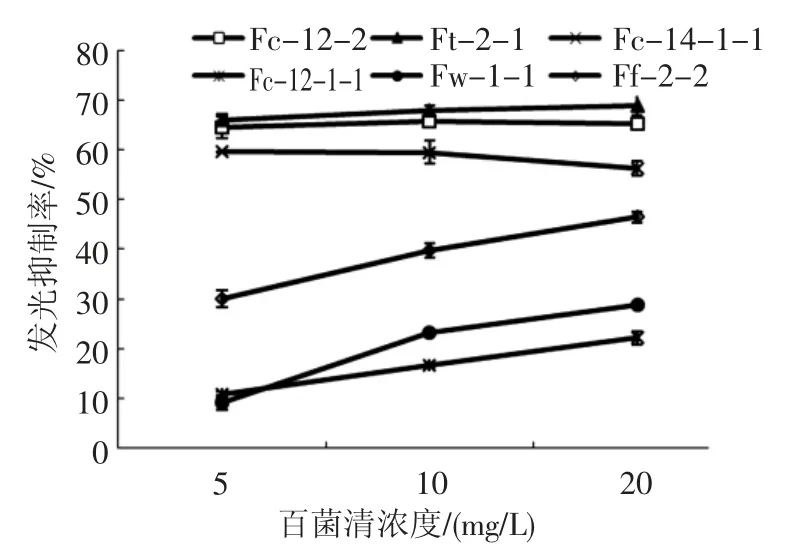
图1 百菌清对菌株发光强度的影响Fig.1 Influence of chlorothalonil to the fluorescence intensity of each strain
2.3 发光细菌16S rDNA序列ARDRA分析
研究表明,每一个菌种的16S rDNA 限制片段长度多态性类型都有一个独特的酶切图谱,代表了一个操作分类单位(即OTU),用16S rDNA 序列进行ARDRA 分析可以区分出细菌种的差异[18],该技术在微生物生态学领域有着广泛的应用。本部分选用限制性内切酶AfaⅠ和MspⅠ对6株百菌清敏感发光细菌16S rDNA 的PCR 扩增产物进行双酶切分析,其结果见图2。

图2 16S rDNA PCR产物ARDRA 分析图谱Fig.2 ARDRA analysis maps of 16S rDNA PCR products
根据图2 中的限制性酶切图谱,6株菌株共分为3个不同的OTUs,其中OTU1 包括菌株Ft-2-1、Fc-12-1、Fc-14-1-1 和Fc-12-2,OTU2 仅有菌株Ff-2-2,OTU3 仅有菌株Fw-1-1。
2.4 16S rDNA 序列测定结果
发光细菌的16S rDNA 序列测定结果如表3所示。

表3 6株发光细菌的16S rDNA 序列相似性比较Table 3 Similarity of 16S rDNA sequences from 6 luminous bacteria
结合形态学鉴定结果及试验菌株16S rDNA 序列的最高相似性可得知,6株百菌清敏感发光细菌分别为费氏弧菌(Vibrio fischeri)、黑美人弧菌(Vibrio nigripulchritudo)、长牡蛎弧菌(Vibrio crassostreae)、依氏假交替单胞菌(Pseudoalteromonas issachenkonii)、明亮发光杆菌(Photobacterium phosphoreum)、Vibrio toranzoniae。
2.5 16S rDNA 序列系统发育分析结果
6株发光细菌系统发育树分析结果如图3显示。
6株发光菌株分别与Vibrio fischeri、Vibrio nigripulchritudo、Vibrio crassostreae、Pseudoalteromonas is-sachenkonii、Photobacterium phosphoreum、Vibrio toranzoniae具有最近的亲缘关系,其中菌株Fc-12-1-1、Fc-14-1-1、Ft-2-1、Fc-12-2 亲缘关系较近,这与16S rDNA序列ARDRA 分析相一致。菌株Ff-2-2 与Fw-1-1 虽然ARDRA 分析结果显示两者分属于两个分类单位,但系统发育树结果显示二者亲缘关系也较为接近,这可能与本研究中选择的限制性内切酶有关[18-19]。

图3 6株发光细菌的16S rDNA 序列系统发育树分析结果Fig.3 Phylogenetic tree analysis results of 16S rDNA sequences from 6 luminous bacteria
3 讨论和结论
从青岛海域新鲜海鱼的鱼鳞、鱼鳃、鱼肠中分离获得17 株海洋发光细菌,从生长和发光两个方面研究了发光细菌对百菌清的敏感特性。利用形态学观察、16S rDNA 序列测定、ARDRA 分析、构建系统发育树等方法,对分离纯化得到的发光细菌进行系统发育地位分析。确定了6株百菌清敏感发光细菌及其分类地位。
根据美国临床实验室标准化协会(CLSI)标准与指南,抑菌圈直径在13 mm 以上时表明微生物对该抗生素敏感。本文筛选的6株发光细菌受百菌清的抑制,抑菌圈直径在16 mm~25 mm 之间,对百菌清表现出较好的敏感特性。6株发光细菌的发光强度也受到百菌清不同程度的影响,但与生长敏感特性不呈现正比例关系。其中,菌株Fc-12-1-1 受百菌清抑制,抑菌圈高达25 mm,而其发光强度则最高仅被抑制约20%,而菌株Ft-2-1 的抑菌圈直径在16 mm,对百菌清的生长敏感特性明显低于菌株Fc-12-1-1,其发光强度则被抑制65%以上,大大高于百菌清对菌株Fc-12-1-1 的发光抑制。这一结果说明,百菌清对发光细菌发光的抑制效应并不是主要通过抑制生长来产生的。这很可能是由于百菌清直接抑制参与发光反应的酶的活性而不是通过细胞质毒性抑制细胞代谢过程[16]。
分离的6株百菌清敏感海洋发光细菌,4 株属于弧菌属,分别是Vibrio fischeri、Vibrio nigripulchritudo、Vibrio crassostreae和Vibrio toranzoniae,另2株分别属于假单胞菌属(Pseudoalteromonas issachenkonii)和发光杆菌属(Photobacterium phosphoreum)。其中,Vibrio fischeri(费氏弧菌)已作为水质急性毒性监测指标微生物在水质安全监控中发挥了重要作用[20-21],Photobacterium phosphoreum(明亮发光杆菌)以及Photobacterium leiognathi(鰒发光杆菌)也在食品安全检测中得到了一定的应用[15,22]。但此次分离的所有发光细菌,都未见有报道用于百菌清检(监)测的应用,有益的补充了用于食品安全检(监)测的发光细菌菌株资源。
用于食品安全检测的发光细菌一般包括淡水和海水两种。由于淡水的发光细菌资源有限,目前用于食品安全检测的仅有青海弧菌等几种[7],用于食品安全的检测受到一定限制。而海水发光细菌则包括了多种弧菌及明亮发光杆菌、海氏交替单胞菌等,从海水中分离更多的发光细菌用于食品安全研究,是一项重要的途径。本文分离的6株海洋发光细菌,正是现有发光细菌资源的有益补充,同时基于其发光强度随百菌清浓度的增大而降低,发光抑制效率在10%~80%之间的敏感特性,有望用于百菌清的定量检测。
