芝麻抗氧化肽分离纯化与结构鉴定的研究
2019-04-12李若昀张丽霞高锦鸿宋国辉黄纪念
芦 鑫 李若昀 张丽霞 高锦鸿 孙 强 宋国辉 黄纪念
(河南省农业科学院农副产品加工研究中心1,郑州 450002)( 河南省农产品生物活性物质工程技术研究中心2,郑州 450002) (河南农业职业学院3,郑州 451450) (河南省农科院农副产品加工研究所4,郑州 450002)
芝麻是世界重要油料作物之一,2014年全球芝麻产量623万t。我国是芝麻生产与消费大国,年均消费芝麻在100万t以上[1]。我国芝麻主要用于榨油,榨油后的副产品芝麻饼粕的蛋白质含量能达到50%左右,研究表明,芝麻蛋白是一种营养价值较高的蛋白质资源,但受加工技术所限,通常作饲料或肥料,使芝麻蛋白质资源未得到充分利用[2-4]。将蛋白通过酶解转化为具有功能性肽类是深加工的常用方式,研究表明,芝麻蛋白通过酶解可以产生抗氧化肽[5-7]。
目前,前人对芝麻抗氧化肽的研究主要集中在制备与活性检测,对芝麻抗氧化肽的结构鉴定、结构组成研究较少[8]。多肽结构与抗氧化活性有密切关系,多肽的结构鉴定是揭示构效关系的基础,也是指导后续生产应用的基础[9-10]。本研究采用胰蛋白酶水解芝麻蛋白制备抗氧化肽,酶解液采用纳滤脱盐、超滤初步分离纯化,然后采用制备液相进行纯化,随后采用高效液相质谱联用仪获取多肽序列,合成上述多肽,验证抗氧化活性,为芝麻蛋白的资源开发提供参考。
1 材料与方法
1.1 材料与试剂
芝麻蛋白:实验室自制,制备方法参照袁东振[11],芝麻蛋白溶液采用截留分子质量为5 000 u透析膜透析,冻干,获得芝麻蛋白,芝麻蛋白浓度为(92.17±0.31)%。
多肽VALVTGGDSGIGR、DVANEANQLDLK、ELFFGAGGENPESFFK、QDNANNA- NQLDPNPR、ENIEHTAATHSYNPR:上海吉尔生物公司合成;胰蛋白酶:上海阿拉丁生化科技股份有限公司;1, 1-二苯基-2-三硝基苯肼自由基(DPPH)、2, 2′-联氮双( 3-乙基苯并噻唑啉-6-磺酸)二铵盐自由基(ABTS)、2, 4, 6-三硝基苯磺酸( TBNS)、2, 4, 6-三吡啶基三嗪(TPTZ): 美国sigma-aldrich公司;平膜RO4、NFM、UE003、UE005、UE008、UE010:中科瑞阳膜技术有限公司;甲醇:色谱纯,德国MERCK集团;其他试剂:国药集团化学试剂有限公司。
LC-500型制备液相;Testcell C-70 平膜装置;TGL20M-Ⅱ高速冷冻离心机;UV-6300双光束型紫外可见分光光度计;DNM-9606酶标分析仪等设备用于实验。
1.2 实验方法
1.2.1 芝麻多肽的制备
取一定质量芝麻蛋白加入0.06 mol/L pH8.5的Na2HPO4-KH2PO4缓冲液中,配成质量浓度5%的蛋白溶液,加酶量8 000 u/g蛋白加入胰蛋白酶,45 ℃反应2 h,沸水浴10 min终止反应,冷却室温。在此酶解条件下,酶解液的水解度为(17.54±0.17)%。采用3 mol/L HCL调节pH到7,10 000 r/min离心30 min,收集上清液(SPT)备用。
1.2.2 纳滤脱盐
将SPT装入平膜装置,采用NFM纳滤膜脱盐,操作压力为5 MPa,搅拌速度400 r/min,透过液达到料液体积80%时,终止纳滤,截留液补充蒸馏水到初始酶解液体积,进行第二次纳滤,纳滤过程重复三次,截留液(SPTN)备用,测定脱盐率与多肽回收率。
式中:Rs为脱盐率;mrs和mfs为50 mL截留液和初始酶解液中灰分质量/mg。
式中:Rp为多肽回收率;Crp和Cfp为截留液和初始酶解液中多肽浓度/mg/mL;Vr和Vf为截留液和原始酶解液体积/mL。
1.2.3 超滤分离酶解液
SPTN依次通过UE010(截留分子质量10 ku)、UE008(截留分子质量8 ku)、UE005(截留分子质量5 ku)、UE003(截留分子质量3 ku)进行超滤,超滤条件为:温度25 ℃,压力3 MPa,转速400 r/min,分成6个组分(<3 ku,3~5 ku,5~8 ku,8~10 ku,>10 ku,脱盐料液)。测定各组分DPPH、ABTS的IC50和FRAP值。
1.2.4 DPPH自由基清除能力测定
参考TORRES-FUENTES方法稍作修改,取酶解液100 μL加入于96孔酶标板中,随后加入100 μL 2×10-4mol/L DPPH乙醇溶液,振荡30 s,室温避光反应30 min,在波长517 nm处测定吸光度Ai,以同样的方法同时测定100 μL酶解液与100 μL乙醇混合后的吸光度Aj,100 μL DPPH溶液与100 μL乙醇混合后的吸光度Ao[14]。DPPH自由基清除率(DI)计算公式:
调节酶解液浓度至0.01~10 mg/mL,测定DPPH自由基清除率,采用IBM SPSS24的probit回归计算IC50,即DPPH清除率达到50%时,对应的浓度。
1.2.5 ABTS自由基清除能力测定

调节酶解液浓度至0.01~10 mg/mL,测定ABTS自由基清除率,采用IBM SPSS24的probit回归计算IC50,即ABTS清除率达到50%时,对应的浓度。
1.2.6 FRAP测定
取50 μL 3 mg/mL 酶解液加入到96孔酶标板中,随后加入150 μL FRAP工作液(由pH 3.6,0.3 mol/L醋酸盐缓冲液,10 mmol/L TPTZ,20 mmol/L FeCl3溶液以10∶1∶1比例混合),振荡30 s,避光37 ℃反应30 min,在波长591 nm处测定吸光度。另以0~2 mmol/L FeSO4标准溶液作标准曲线[16]。
1.2.7 制备液相分离酶解液
将活性最高的组分,首先通过反渗析膜RO4进行浓缩,浓缩至50 mg/mL,随后采用0.45 μm针头滤器过滤,以上样量4 mL进样到制备液相。制备液相条件为:色谱柱Ultimate AQ-C18(250×20 mm,5 μm),55%(V/V)甲醇溶液,其中含0.1%(V/V)三氟乙酸,流速8 mL/min,检测波长280 nm,1 min/管收集流动相,将各色谱峰对应试管分别混合,测定各个色谱峰的DPPH、ABTS清除能力与FRAP值,确定最强活性的色谱峰。
1.2.8 高效液相质谱联用仪分析芝麻抗氧化肽序列
将高活性组分采用氮吹仪吹干,寄送到苏州普泰公司,通过Nano-LC-ESI-MS/MS 分析多肽序列。色谱系统为安捷伦1100 高效液相系统,ESI-MS/MS为美国热电 LTQ离子阱质谱仪,色谱柱为Thermo Finnigan LTQ Linear Ion Trap。其中高效液相的流动相A由2%(V/V)乙腈水溶液(含0.5%甲酸),流动相B是90%(V/V)乙腈水溶液(含0.5%甲酸)。测定时,流动相B从初始组成2%在60 min内增加到90%,随后维持40 min。质谱数据采用ProtTech’s ProtQuest (Norristown, PA, USA)软件分析。
1.2.9 多肽抗氧化性验证
合成VALVTGGDSGIGR、DVANEANQLDLK、ELFFGAGGENPESFFK、QDNANN- ANQLDPNPR、ENIEHTAATHSYNPR 5种多肽,将多肽粉分别加入蒸馏水,配成浓度为0.01~5 mg的溶液,测定DPPH和ABTS清除率的IC50,以及FRAP,具体方法见1.2.4,1.2.5,1.2.6。
1.2.10 常规指标测定
芝麻饼粕中蛋白含量测定采用凯氏定氮(GB 5009.5—2016),转换系数5.30;多肽浓度测定采用三氯乙酸可溶性氮法[12-13];水解度测定采用TNBS法[13];酶解液灰分测定采用550 ℃灰化法(GB 5009.4—2016)。
1.3 数据处理
采用SAS 9.3进行单因素方差分析,0.05水平为显著,0.01为极显著。
2 结果与分析
2.1 芝麻蛋白酶解液纳滤脱盐
纳滤是膜孔径1~10 nm的压力驱动膜,分离范围介于超滤与反渗析之间,对相对分子质量小于200 u的单价离子与有机小分子截留能力差,小分子会透过纳滤膜进入透过液,而大分子保留在截留液中[17]。芝麻蛋白酶解液的纳滤脱盐见表1,由表1可知,随着纳滤次数从1次增加到3次,SPT中的盐分基本除去,为后续芝麻抗氧化肽的分离纯化奠定有利基础。3次纳滤后,多肽回收率为(97.76±0.21)%,芝麻多肽基本都保留在截留液中,这表明胰蛋白酶酶解芝麻蛋白主要形成2肽以上的多肽。
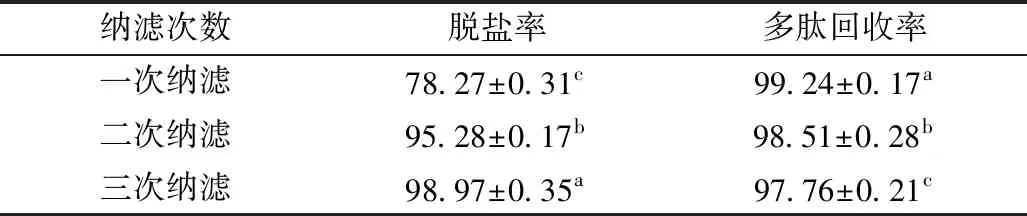
表1 芝麻蛋白酶解液的纳滤脱盐/%
注:表中同一列中带有相同小写字母的样品间在0.05水平上无显著差异,余同。
2.2 芝麻抗氧化肽超滤分离
超滤分离芝麻蛋白酶解液所得组分及抗氧化活性见表2。由表2可知,采用超滤纯化SPTN得到的5个组分,抗氧化能力存在显著差异。低分子组分,如SPTN-I,其抗氧化活性较强,而高分子组分抗氧能力较弱。这与任娇艳等[18]采用超滤分离草鱼蛋白源抗氧化肽,李华等[19]利用超滤分离黑豆抗氧化肽,王章存等[20]超滤分离小麦抗氧化肽的结果相一致。这可能是肽链较短,空间位阻作用小,内部的活性基团(巯基、酚羟基)暴露,促进于自由基发生反应[21-22]。
2.3 制备液相纯化SPTN-I
芝麻抗氧化肽的制备液相图谱如图1所示。由图1可知,采用制备液相分离SPTN-I时,获得7个色谱峰,其中P4、P5、P6、P7完全分离,而P1、P2、P3有重叠。制备液相分离SPTN-I的组成及抗氧化活性见表3,P5的抗氧化活性最高,选择P5进行后续纯化。

图1 芝麻抗氧化肽的制备液相图谱

组分分子质量范围/ku组成分例/%DPPH清除能力IC50/mg/mLABTS清除能力IC50/mg/mLFRAP/μmol/mgSPTN-I<337.56±0.216.95±0.07f5.87±0.13f1.97±0.02bSPTN-II3~518.31±0.077.54±0.11e7.09±0.21e2.05±0.03aSPTN-Ⅲ5~812.70±0.1311.62±0.19d9.87±0.16d1.49±0.07cSPTN-Ⅳ8~1010.69±0.1814.85±0.25b11.93±0.09b0.99±0.04eSPTN-Ⅴ>1020.74±0.1517.33±0.06a14.78±0.25a0.75±0.07fSPTN——12.80±0.28c10.61±0.09c1.16±0.05d

表3 制备液相分离SPTN-I的组成及抗氧化活性
2.4 抗氧化肽结构鉴定与活性验证
通过高效液相质谱联用分析SPTN-I中P5组分,该峰里有5个多肽(见图2~图6),其二级质谱图m/z分别为888.77、794.02、665.52、870.69、841.57,采用ProtTech’s ProtQuest软件分析,其芝麻抗氧化肽的序列见表4。5种多肽的分子质量胰蛋白酶水解生成芝麻抗氧化肽是12肽至16肽之间,相对分子质量在1 328.7~1 774.8 u之间,QDNANNANQLDPNPR的抗氧化能力最强,ELFFGAG GENPESFFK的抗氧化能力较弱。对比其他抗氧化肽,芝麻抗氧化肽与从牛蛙蛋白、金枪鱼骨架蛋白的酶解物中得到1 988 u和1 519 u的抗氧化肽相近[23-24],与从大米蛋白制备的520.77 u抗氧化肽相差较远[10]。不同来源的抗氧化肽相对分子质量相差悬殊的原因:一是原料蛋白的氨基酸组成存在差异,所形成的多肽组成不同,其实现抗氧化的途径不同[25];二是制备抗氧化肽所采用的蛋白酶不同,其形成的多肽大小存在差异。采用胰蛋白酶制备抗氧化肽,由于胰蛋白酶水解位点单一,形成肽段较长,如吴慧等[26]采用胰蛋白酶水解乳清蛋白制备出LDGNAKPTPEGDLEL和LYEDLKPTPEGPMEL抗氧化肽[26]。
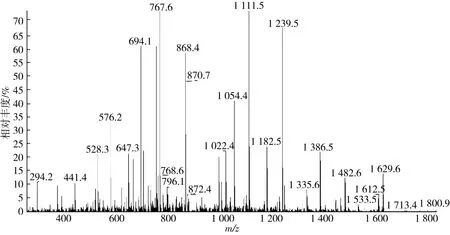
图2 芝麻抗氧化肽ELFFGAGGENPESFFK质谱图

图3 芝麻抗氧化肽FESEAGLTEFWDR质谱图

图4 芝麻抗氧化肽DVANEANQLDLK质谱图

图5 芝麻抗氧化肽ENIEHTAATHSYNPR质谱图
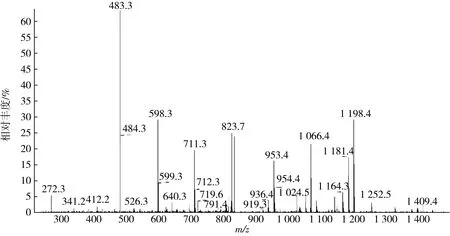
图6 芝麻抗氧化肽QDNANNANQLDPNPR质谱图
观察芝麻抗氧化肽的氨基酸组成时,发现:5种多肽的C末端都有碱性氨基酸残基(赖氨酸、精氨酸),N端以酸性氨基酸残基或酸性氨基酸的酰胺残基(除FESEAGLTEFWDR),推测上述氨基酸因其侧链有氨基或羧基,具有螯合金属离子和作为质子供体的作用,从而提高多肽的抗氧化肽能力[27]。文献
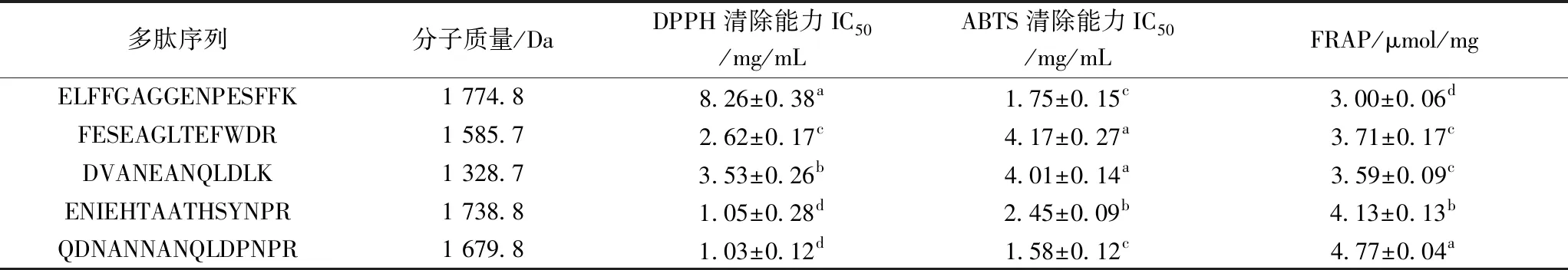
表4 芝麻抗氧化肽的序列、分子量和抗氧化能力

表5 芝麻抗氧化肽的来源蛋白
报道酪氨酸、组氨酸、色氨酸、亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、半胱氨酸、赖氨酸、天冬氨酸、谷氨酸等对肽的抗氧化性有贡献[28-30],除甲硫氨酸和半胱氨酸未在芝麻抗氧化肽中发现,其余氨基酸均存在与抗氧化肽中,其中天冬氨酸残基5个、苯丙氨酸残基6个,谷氨酸残基9个,估计这些氨基酸的存在对芝麻多肽的抗氧化活性起了作用。
采用Protein information resource (PIR)数据库检索多肽序列发现(见表5):芝麻抗氧化肽有4种来源于芝麻11S球蛋白,1种来源于芝麻7S球蛋白。胰蛋白酶水解芝麻11S蛋白,可以从肽段中63~75、167~181、188~199、320~334位点产生抗氧化肽。同时,芝麻11S蛋白也是芝麻蛋白的主体,占芝麻蛋白的60%[31-32],这预示芝麻11S球蛋白在制备芝麻抗氧化肽过程中起主导作用。因此,高11S蛋白的芝麻品种适宜于芝麻抗氧化肽的制备。
3 结论
采用纳滤脱盐、超滤分离、制备液相纯化可以有效分离纯化胰蛋白酶酶解芝麻蛋白形成的抗氧化肽,采用Nano-LC-ESI-MS/MS分析5种芝麻抗氧化肽结构。
由纳滤与超滤实验结果可知,胰蛋白酶水解芝麻蛋白形成的多肽,分子量较高,其中<3 ku的组分具有最高的抗氧化活性。
5种芝麻抗氧化肽依次为12肽DVANEANQLDLK、13肽FESEAGLTEFWDR、15肽ENIEHTAATHSYNPR、15肽QDNANNANQLDPNPR、16肽ELFFGAGGENPESFFK,分子质量分别是1 328.7、1 585.7、1 738.8、1 679.8、1 774.8 u。多肽的N端以酸性氨基酸残基为主,C末端为碱性氨基酸残基。
芝麻11S蛋白在抗氧化肽的形成过程中起到主导作用,胰蛋白酶水解芝麻11S蛋白可以产生4种抗氧化肽。
