氧化苦参碱提高乳腺癌MCF-7细胞对NK-92MI细胞杀伤作用的敏感性①
2019-04-12陈冬玲
陈冬玲 王 倩 李 忠
(南阳理工学院张仲景国医国药学院,南阳473004)
乳腺癌是女性最常见的恶性肿瘤之一。2017年在美国和欧盟的女性中乳腺癌的病死率位居前两位,死亡人数将分别达到40 610例和92 600例[1,2]。在围手术期进行化疗是治疗乳腺癌的重要辅助手段,有助于提高治疗效果,但耐药性的产生是其疗效下降的重要原因[3]。肿瘤免疫治疗是一种新兴的肿瘤治疗模式,其中自然杀伤(Natural killer,NK)细胞的作用越来越受到重视。因此如何增强肿瘤细胞对NK细胞杀伤的敏感性成为目前研究的热点之一。苦参是豆科植物苦参的干燥根,主要活性成分为苦参碱(Matrine,MT)和氧化苦参碱(Oxymatrine,OMT)。近年来的研究显示,OMT可通过诱导凋亡、抑制增殖、阻碍侵袭和转移及提高化疗药物敏感性发挥抗肿瘤活性[4-9]。但关于OMT能否提高乳腺癌细胞对NK细胞杀伤作用的敏感性目前尚未见报道。因此本研究旨在体外观察OMT处理前后MCF-7细胞对NK-92MI细胞敏感性的变化,并探讨其可能的分子机制。
1 材料与方法
1.1材料 OMT购自中国药品生物制品检定所;MCF-7细胞和NK-92MI购自中国科学院上海生命科学研究院细胞资源中心;人乳腺癌阿霉素耐药株由本校医学实验中心提供;胎牛血清、马血清、DMEM培养基和α-MEM培养基购自Gibco公司;NF-κB抑制剂吡咯烷二硫代甲酸铵(PDTC)购自Sigma公司;CCK-8试剂盒、乳酸脱氢酶(LDH)检测试剂盒、AnnexinV-FITC凋亡检测试剂、人TNF-α和IFN-γ ELISA试剂盒购自碧云天生物技术有限公司;藻红蛋白(PE)标记的小鼠抗人ULBP1、ULBP2、和MICA/B单克隆抗体以及IgG2a同型对照抗体购自eBioscience公司;兔抗人p-p65(Ser536)、p65和β-actin抗体和辣根过氧化物酶标记山羊抗兔IgG购自Abcam公司。
1.2方法
1.2.1细胞培养 NK-92MI细胞用含12.5%胎牛血清和12.5%马血清的α-MEM培养液,在37℃、5%CO2条件下常规培养;MCF-7细胞用含10% 胎牛血清的DMEM培养液,在37℃、5%CO2条件下培养。
1.2.2CCK-8法检测细胞活力 将MCF-7细胞和NK-92MI细胞以每孔5 000个接种于96孔板,在37℃、5%CO2条件下培养24 h。弃上清,加入100 μl 含有不同浓度OMT的细胞培养液,终浓度分别为1.25、2.5、5、10、20和40 μmol/L,每个浓度设5个复孔,同时设调零孔和对照组,在37℃、5%CO2条件下分别培养24、48和72 h。每孔加入10 μl CCK-8溶液,37℃孵育1 h,用酶标仪检测各孔于450 nm波长处的吸光度A值。细胞活力=药物组A值/对照组A值×100%。采用SPSS16.0软件Probit回归模型计算OMT对MCF-7细胞的半数抑制浓度(Half maximal inhibitory concentration,IC50)。
1.2.3LDH法检测NK-92MI细胞杀伤活性 将MCF-7细胞以每孔5 000个接种于96孔板,在37℃、5%CO2条件下培养过夜。去上清,加入100 μl含有OMT(终浓度分别为1.25、2.5、5 μmol/L)的细胞培养液,培养24 h后,去上清,按5∶1、10∶1 和20∶1 的效靶比(E∶T)分别加入NK-92MI细胞,同时设MCF-7细胞对照组、NK-92MI细胞对照组和MCF-7细胞最大释放对照组,每组设5个复孔。培养24 h后,400 g 离心5 min,每孔取上清液100 μl转移至一新的96 孔板中,每孔取加入50 μl LDH检测工作液,室温避光孵育30 min,用酶标仪检测各孔490 nm波长处的吸光度A值。杀伤率(%)=(实验组A值-靶细胞对照组A值-NK-92MI细胞对照组A值)/(靶细胞最大释放对照组A值-靶细胞对照组A值)×100%。实验重复3次。
1.2.4流式细胞术检测细胞凋亡 将MCF-7细胞以每孔105个接种于6孔板,在37℃、5%CO2条件下培养过夜。去上清,加入2 ml含有不同浓度OMT(0、1.25、2.5、5 μmol/L)的细胞培养液。培养24 h后,去上清,按5∶1效靶比加入NK-92MI细胞,每组设5个复孔。培养24 h后,弃上清,收集各孔贴壁细胞,PBS洗涤2次,重悬于400 μl Annexin V-FITC结合液中。先加入5 μl AnnexinV-FITC,4℃避光孵育15 min,再加入10 μl碘化丙啶染色液,4℃避光孵育15 min。使用流式细胞仪分析检测细胞凋亡。实验重复3次。
1.2.5Western blot法检测p65的磷酸化 MCF-7细胞分别经5 μmol/L OMT和/或10 μmol/L PDTC处理24 h,同时设无药对照组。用RIPA裂解各组细胞提取总蛋白,用紫外分光光度法测定蛋白质浓度,取25 μg蛋白样品进行SDS-PAGE电泳并转移至PVDF膜,用封闭液(5% BSA/TBST)封闭1 h,加入一抗(p-p65和p65抗体以1∶1 000稀释,β-actin抗体以1∶2 000稀释),4℃孵育过夜,TBST洗膜3次,加入二抗(1∶2 000稀释)室温下孵育1 h,TBST洗膜3次,加入ECL进行发光反应,暗室X胶片显影,拍照,使用Image J 1.45s软件进行灰度分析。以目标蛋白与内参β-actin灰度值的灰度比值作为目标蛋白的相对表达水平。实验重复3次。
1.2.6流式细胞术检测MCF-7细胞表面ULBP2、MICA/B和Fas表达 MCF-7细胞分别经5 μmol/L OMT和/或10 μmol/L PDTC处理24 h,同时设无药对照组。收集各组细胞,PBS 洗涤2次,加入PE标记的ULBP2、MICA/B、Fas或同型IgG2a抗体,4℃避光孵育30 min,PBS洗涤2次,送流式细胞仪检测平均荧光强度(Mean fluorescence intensity,MFI),相对荧光强度=(药物组MFI-同型对照MFI)/(对照组MFI-同型对照MFI)。实验重复3次。
1.2.7ELISA检测TNF-α和IFN-γ的分泌 将MCF-7细胞以每孔5 000个接种于96孔板,分别加入5 μmol/L OMT和/或10 μmol/L PDTC,同时设无药MCF-7细胞组和无细胞对照组,每组设5个复孔。培养24 h后,去上清,按5∶1的效靶比向各孔加入NK-92MI细胞悬液。培养24 h后,400 g 离心5 min,每孔取上清液100 μl转移至一新的96孔板中,采用ELISA双抗体夹心法检测各孔上清液中TNF-α和IFN-γ的含量,先绘制标准曲线,建立标准曲线方程,然后用酶标仪检测各样品孔450 nm波长处的吸光度A值,并计算出样品中TNF-α和IFN-γ的含量(pg/ml)。实验重复3次。
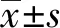
2 结果
2.1OMT抑制MCF-7细胞活力 如图1所示,随着OMT浓度和作用时间的增加,MCF-7细胞活力显著降低。OMT作用MCF-7细胞24、48和72 h的IC50分别为44.53、20.87和12.94 μmol/L。这表明OMT对乳腺癌MCF-7细胞具有显著的抑制作用,且呈剂量和时间依赖性。
2.2OMT增强MCF-7细胞对NK-92MI细胞杀伤作用的敏感性 如图2所示,与未经OMT处理的MCF-7细胞相比,1.25 μmol/L OMT处理MCF-7细胞24 h后,在不同效靶比下NK-92MI细胞对其杀伤率并未发生明显变化;2.5或5 μmol/L OMT处理MCF-7细胞24 h后,在不同效靶比下NK-92MI细胞对其杀伤率显著升高(P<0.05)。
2.3NK-92MI细胞促进OMT预处理MCF-7细胞凋亡 如图3所示,在效靶比为5∶1 时,与未经OMT处理的MCF-7细胞相比,1.25 μmol/L OMT处理MCF-7细胞24 h后, NK-92MI细胞诱导的MCF-7细胞凋亡率无明显变化;而2.5或5 μmol/L OMT处理MCF-7细胞24 h后,NK-92MI细胞诱导的MCF-7细胞凋亡率显著升高(P<0.05)。
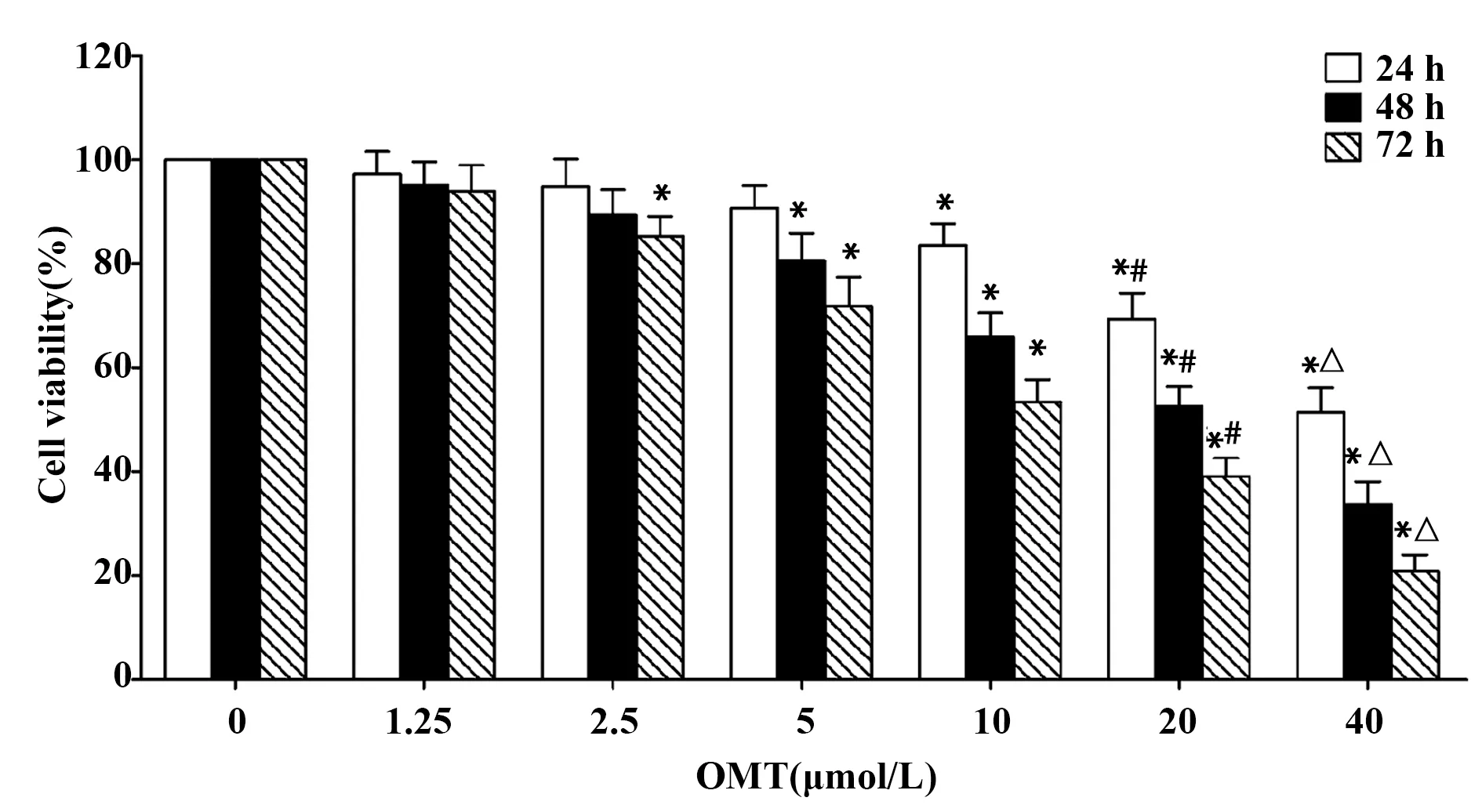
图1 OMT对MCF-7细胞活力的影响Fig.1 Effect of OMT on cell viability in MCF-7 cellsNote: *.P<0.05 versus control group;#.P<0.05 versus 10 μmol/L group;△.P<0.05 versus 20 μmol/L group.
2.4OMT上调MCF-7细胞p65的磷酸化水平 如图4所示,与未经药物处理的MCF-7细胞相比,5 μmol/L OMT处理MCF-7细胞24 h后,p65的磷酸化水平显著升高(P<0.05),而10 μmol/L PDTC处理MCF-7细胞24 h后,p65的磷酸化水平显著降低(P<0.05);同时,OMT+PDTC组p65的磷酸化水平明显低于OMT组(P<0.05)。这提示OMT可激活MCF-7细胞的RelA/p65途径,且可被NF-κB抑制剂PDTC部分阻断。
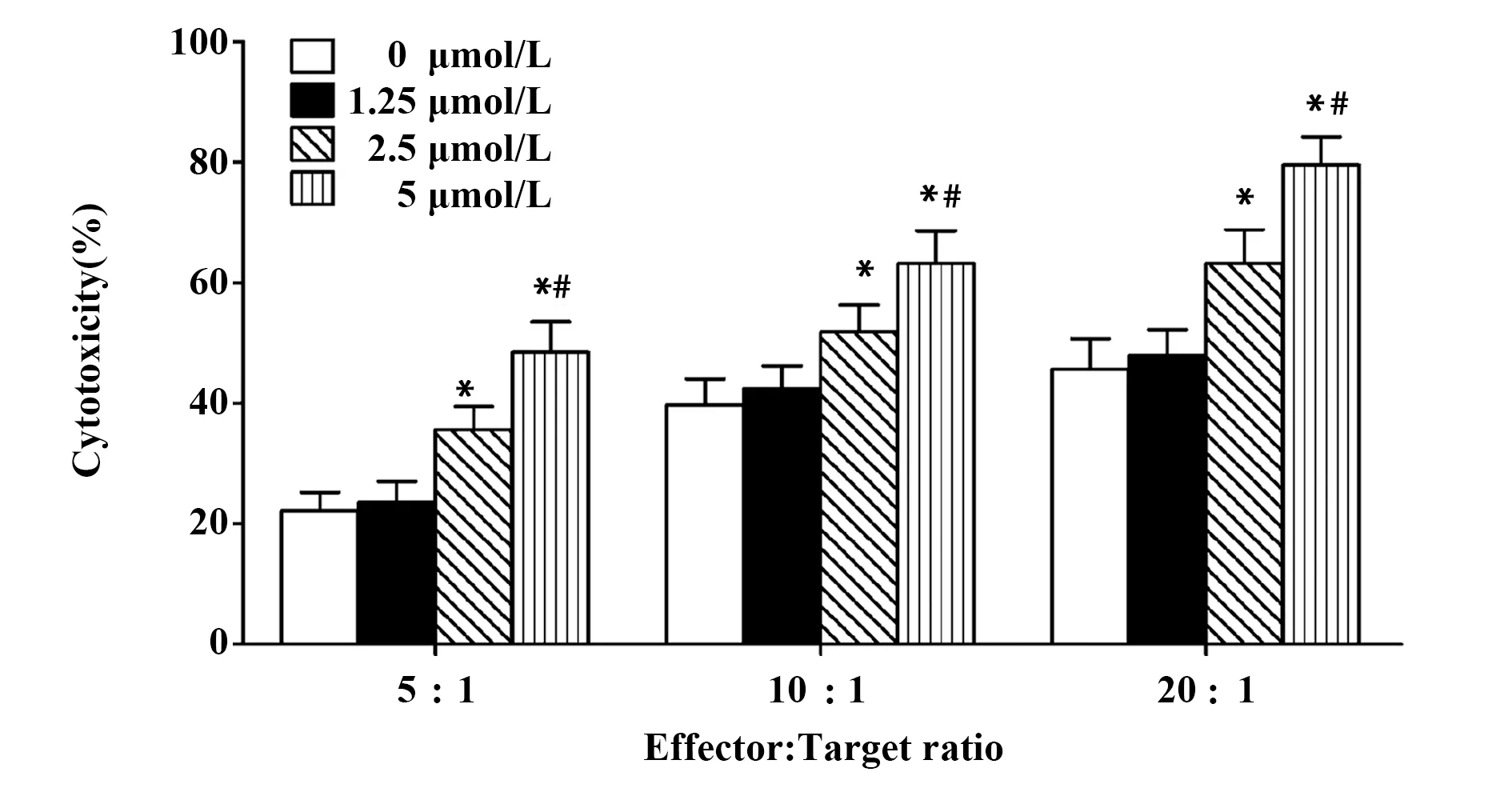
图2 不同效靶比下NK-92MI细胞对MCF-7细胞的杀伤作用Fig.2 Cytotoxicity of NK-92MI cells against MCF-7 cells at different E∶T ratioNote: *.P<0.05 versus control group;#.P<0.05 versus 2.5 μmol/L group.
图3 NK-92MI细胞诱导MCF-7细胞凋亡Fig.3 NK-92MI cell-induced apoptosis of MCF-7 cellsNote: A.Scatter diagram of flow cytometry;B.Statistical analysis of the apoptosis rate(Q2+Q4).*.P<0.05 versus control group;#.P<0.05 versus 2.5 μmol/L group.
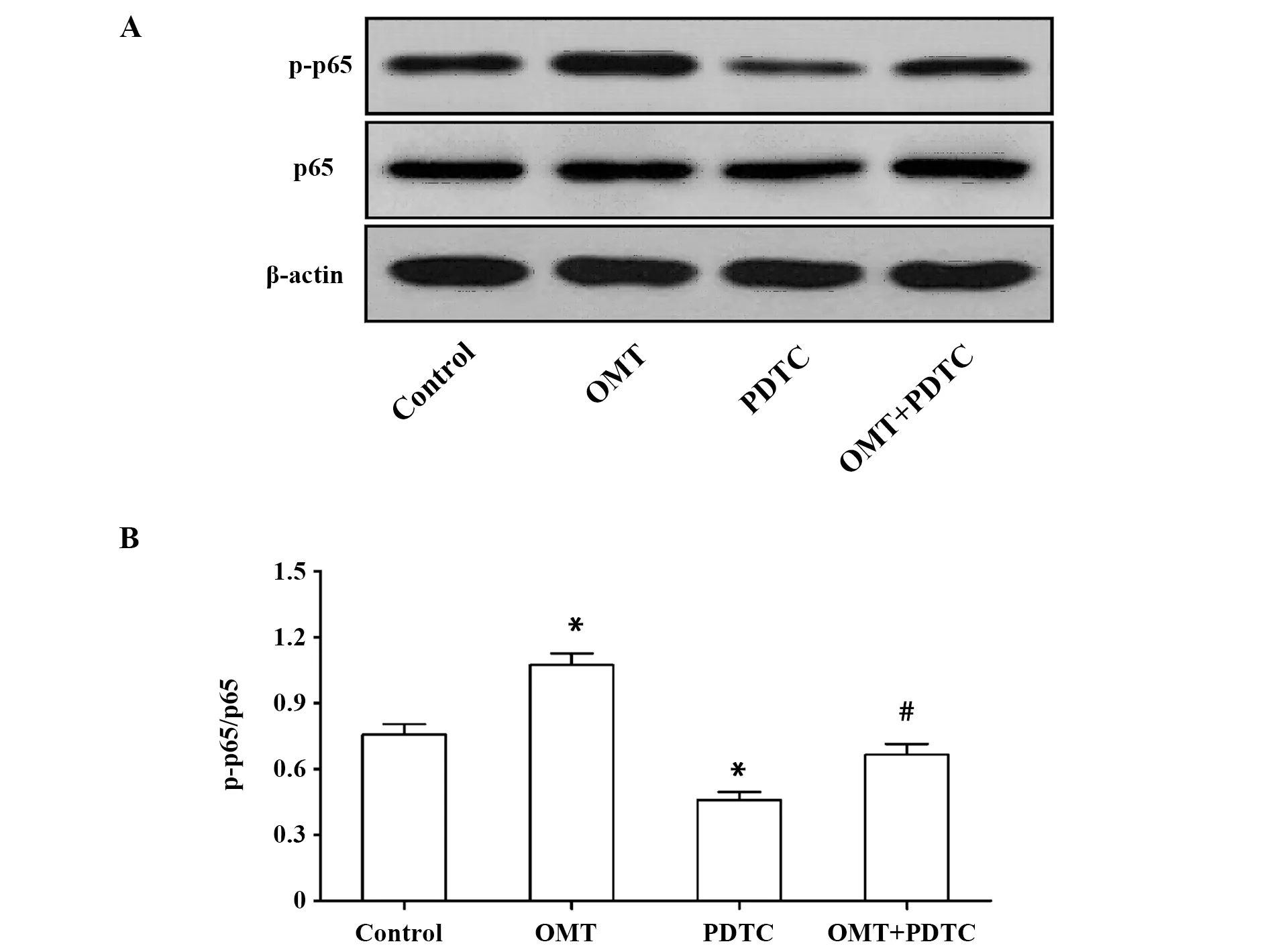
图4 MCF-7细胞中p65蛋白的磷酸化水平Fig.4 Phosphorylation of p65 in MCF-7 cellsNote: A.Western blot assay;B.Statistical analysis.*.P<0.05 versus control group;#.P<0.05 versus OMT group.
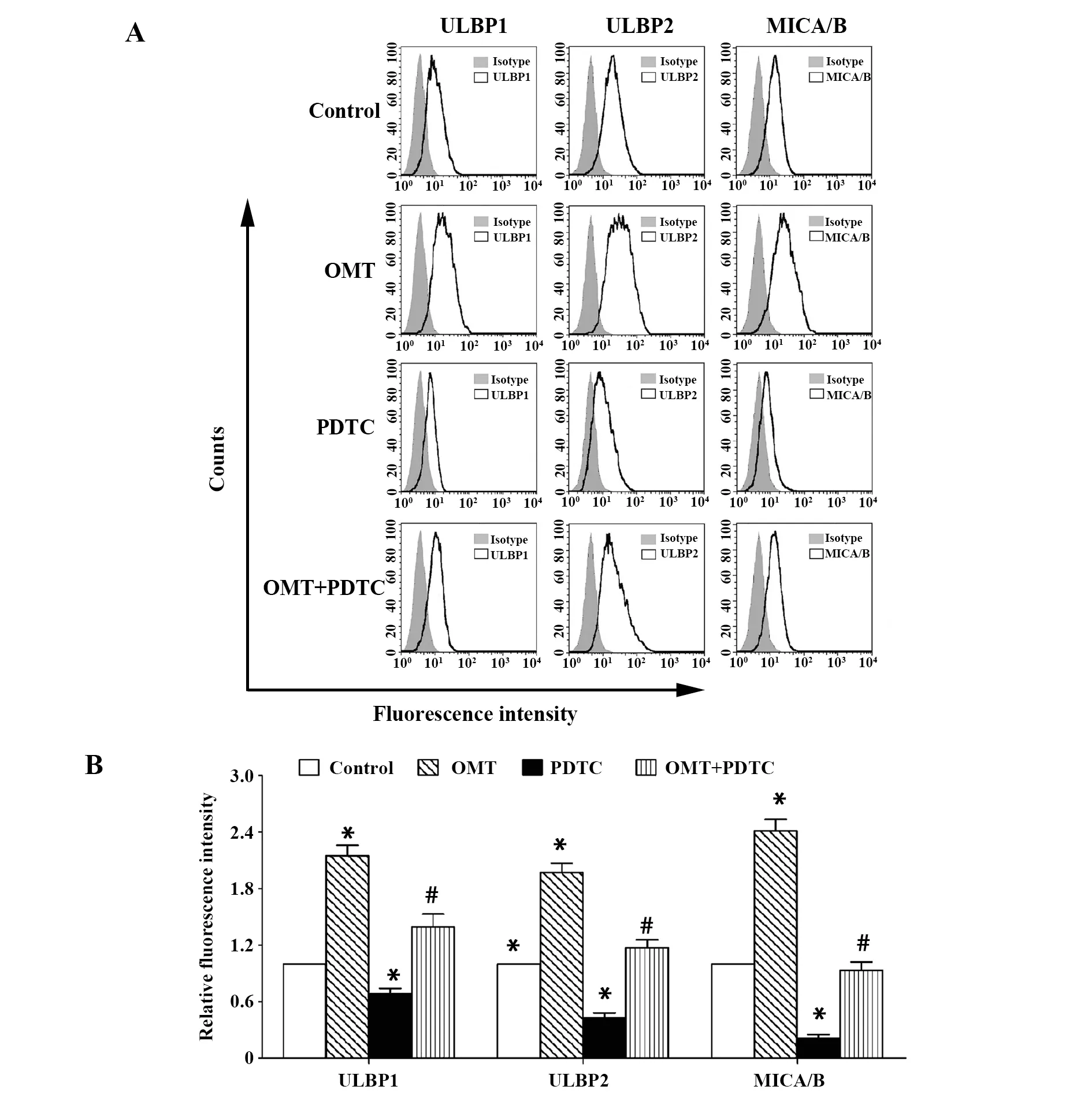
图5 MCF-7细胞表面ULBP1、ULBP2和MICA/B蛋白的表达Fig.5 Expression of ULBP1,ULBP2 and MICA/B at surface in MCF-7 cellsNote: A.Flow cytometry assay;B.Statistical analysis.*.P<0.05 versus control group;#.P<0.05 versus OMT group.
2.5OMT上调MCF-7细胞表面ULBP1、ULBP2和MICA/B蛋白的表达 如图5所示,与未经药物处理的MCF-7细胞相比,经5 μmol/L OMT处理24 h的MCF-7细胞,其表面ULBP1、ULBP2和MICA/B蛋白的相对荧光强度显著升高(P<0.05);而经10 μmol/L PDTC处理24 h的MCF-7细胞,其表面ULBP1、ULBP2和MICA/B蛋白的相对荧光强度显著降低(P<0.05);此外,与OMT组相比,OMT+PDTC组MCF-7细胞表面ULBP1、ULBP2和MICA/B蛋白的相对荧光强度显著降低(P<0.05)。这表明OMT可能通过NF-κB信号通路上调MCF-7细胞表面ULBP1、ULBP2和MICA/B蛋白的表达。
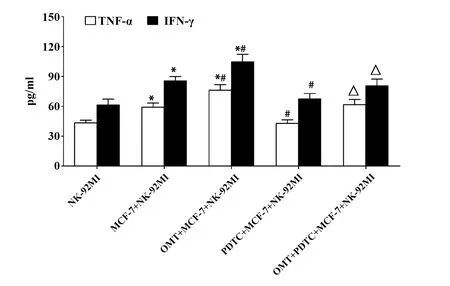
图6 NK-92MI细胞TNF-α和IFN-γ的分泌Fig.6 Secretion of TNF-α and IFN-γ from NK cellsNote: *.P<0.05 versus control group;#.P<0.05 versus MCF-7 group;△.P<0.05 versus OMT+MCF-7 group.
2.6OMT促进TNF-α和IFN-γ的分泌 如图6所示,与NK-92MI对照组相比,MCF-7+NK-92MI组上清液中的TNF-α和IFN-γ含量显著升高(P<0.05);与MCF-7+NK-92MI组相比,OMT+MCF-7+NK-92MI组上清液中的TNF-α和IFN-γ含量更高(P<0.05),而PDTC+MCF-7+NK-92MI组上清液中的TNF-α和IFN-γ含量明显降低(P<0.05);此外,OMT+PCTC+MCF-7+NK-92MI组上清液中的TNF-α和IFN-γ含量低于OMT+MCF-7+NK-92MI组(P<0.05)。这提示OMT处理后的MCF-7细胞可促进NK-92MI细胞分泌更多的TNF-α和IFN-γ,该效应可能与OMT激活NF-κB信号通路有关。
3 讨论
NK细胞是机体固有免疫系统的主要细胞,不需要特异性抗原的刺激就可以杀伤靶细胞,因此NK细胞在抵御肿瘤,尤其在清除转移瘤细胞和微小肿瘤病灶中发挥着重要作用[10,11]。NK-92是一株IL-2依赖型NK细胞株,本研究所采用的NK-92MI细胞是NK-92细胞转染人IL-2 cDNA得到的IL-2非依赖的NK细胞株。本研究发现,OMT可在体外显著抑制人乳腺癌MCF-7细胞活力,并具有时间和剂量依赖性。为避免OMT的毒性作用对后续实验的干扰,本研究选取毒性作用不明显的低浓度OMT(1.25、2.5、5 μmol/L)处理MCF-7细胞24 h,以进一步观察低浓度OMT作用前后MCF-7细胞对NK-92MI细胞杀伤敏感性的变化。LDH试验和流式细胞术结果表明,NK-92MI细胞对低浓度OMT处理后的乳腺癌MCF-7细胞的杀伤作用显著增强,并呈剂量依赖性。
NKG2D是NKG2家族的成员,为Ⅱ型C-凝集素样受体,在NK细胞、CD8+T细胞、NKT细胞和γδT细胞表面都有表达,是一个重要的激活性受体[12]。NKG2D的配体主要有两类:一类是MHC-Ⅰ类链相关的A/B分子(MHC class Ⅰ chain-relatedmolecules A/B,MICA/B),另一类配体是UL16 结合蛋白(UL16-binding proteins,ULBPs)。NKG2D配体在大多数上皮源性肿瘤细胞表面表达,如卵巢癌、结肠癌、白血病等,但在正常细胞表面极少表达[13]。当肿瘤细胞表面的NKG2D配体与NK细胞表面的NKG2D结合后可直接激活NK细胞,从而发挥对肿瘤细胞的杀伤作用[14]。Feng等[15]研究发现,乳腺癌细胞表面ULBP1、ULBP2和MICA蛋白的表达水平升高后,NK细胞对其杀伤活性显著增强。
Chen等[16]研究发现,与正常组织相比,NF-κB和MICA在垂体腺瘤组织中呈高表达,且二者呈正相关。Huang等[17]研究发现,采用siRNA沉默NF-κB基因可下调鼻咽癌顺铂耐药株CNE2/DDP细胞和肝癌HepG2细胞中MICA/B和ULBP1-3蛋白的表达水平。Zhu等[18]研究证实,抑制NF-κB信号通路可阻断足叶乙甙上调MCF-7细胞中MICA/B的mRNA和蛋白表达水平。上述研究表明,NF-κB信号通路与肿瘤细胞中NKG2D配体的表达水平密切相关。NF-κB是由p50和RelA/p65组成的异二聚体,因RelA/p65含有转录激活域(Transcriptional activation domain,TAD),能够激活靶基因转录,成为NF-κB最重要的功能亚基。Ser536位于RelA/p65的TAD内,该位点磷酸化可增强其转录活性。
本研究发现,OMT可上调MCF-7细胞表面ULBP1、ULBP2和MICA/B蛋白的表达水平,并上调RelA/p65在Ser536处的磷酸化水平,但该作用可被NF-κB抑制剂PDTC抑制。同时PDTC还可下调MCF-7细胞ULBP1、ULBP2和MICA/B蛋白表达以及RelA/p65在Ser536处的磷酸化水平。这提示OMT可能通过激活NF-κB通路上调MCF-7细胞表面ULBP1、ULBP2和MICA/B蛋白的表达。
IFN-γ可抑制肿瘤细胞增殖、侵袭和诱导肿瘤细胞凋亡、增加肿瘤细胞表面NKG2D配体和Fas的表达及抗肿瘤血管生成等[19-23]。IFN-γ可通过上调Fas蛋白表达增强FasL诱导的MCF-7细胞凋亡[22]。TNF-α和IFN-γ联用可导致MCF-7细胞发生S期阻滞和细胞凋亡[24]。本研究发现,经OMT预处理的MCF-7细胞可诱导NK-92MI细胞分泌大量TNF-α和IFN-γ,这可能是OMT加剧由NK-92MI细胞诱导的MCF-7细胞凋亡的机制之一。同时NF-κB抑制剂PDTC可抑制该效应,提示这可能与OMT激活NF-κB信号通路有关。
综上所述,在体外OMT可增强MCF-7细胞对NK-92MI细胞杀伤作用的敏感性,这可能与其激活NF-κB信号通路,进而上调MCF-7细胞表面ULBP1、ULBP2和MICA/B蛋白表达及促进NK-92MI细胞分泌TNF-α和IFN-γ有关。
