NKG2D的结构与功能①
2019-04-12曹伟娅李存娣
曹伟娅 李存娣 王 健
(安徽理工大学医学院病原生物学教研室,淮南232001)
自然杀伤细胞(Natural killer cell,NK)具有肯定的抗肿瘤活性,其在抗肝细胞癌分裂增生、浸润转移中起重要作用。NKG2D(Natural killer group 2D)作为表达在NK细胞、CD8+γδT细胞、γδT细胞等免疫活性细胞表面的重要活化性受体[1],属C型凝集素受体家族中的关键成员,诱导NK细胞表达NKG2D,可进一步促进NK细胞活化,并在抗肿瘤免疫应答过程中起重要作用[2]。本文围绕NKG2D结构、功能、表达及其在肝癌中的作用进行综述,现将结果报道如下。
1 NKG2D的发现
NKG2D是20世纪90年代发现的存在于NK细胞表面的活化性受体。Houchins等[3]于1991年在筛选人源性NK细胞优势表达基因时发现NKG2D,同时还筛选出与之相邻的NKG2A、NKG2C、NKG2E。4组基因均编码由215~233个氨基酸组成的Ⅱ型膜蛋白,令人称奇的是NKG2C与NKG2A在C末端(COOH-)有94%的同源性,在跨膜区和膜内区有56%的同源性,而NKG2D与另外3组基因的氨基酸同源性仅有21%,它们共同参与NKG2受体家族的组成。
NK细胞是机体重要的免疫细胞,不仅与抗肿瘤、抗病毒感染和免疫调节有关[4-6],而且与T细胞和B细胞相比,NK细胞表面的NKG2D在活化过程中不受宿主MHC限制,并能通过多种信号激活途径杀伤、溶解肿瘤细胞。NK细胞表面可表达多种受体(图1),依功能可分为活化性受体和抑制性受体,前者系指具有特征性的天然细胞毒性受体(Natural cytotoxicity receptor,NCR)家族成员,如NKp46、NKp30、NKp44和C型凝集素家族受体(NKG2D、CD94/NKG2C、CD94/NKG2E、CD94/NKG2F、CD161),还有活化的杀伤性免疫球蛋白受体(activating killer immunoglobulin receptors,KIRs),如KIR2DS1、KIR2DS4、KIR2DL4。NK细胞抑制性受体主要包括NKG2A、KIR2DL1、KIR2DL2/L3、KIR3DL1。如表1。
NKG2受体家族包括NKG2A、B、C、D、E,其中NKG2A、B属于抑制性受体,NKG2C、D、E属于活化性受体。NKD2A、B、C、E在细胞表面表达需CD94分子辅助参与,并与CD94分子形成异源二聚体。值得注意的是,NKG2A的细胞质结构域含两个与含
有络氨酸蛋白2结构域同源的磷酸酶-1(Src homology region 2 domain-containing phosphatase-1,SHP-1)相关联的免疫酪氨酸抑制性受体(Immu-noreceptor tyrosine-based inhibitory motifs,ITIMs)基序,这些抑制性基序在胞质结构域由一致的序列I/VXYXXV/L组成,能够在受体配体结合后导致ITIM的酪氨酸磷酸化[7],随后招募细胞内SHP-1酪氨酸磷酸酶,然后使激活的级联信号分子上的酪氨酸残基去磷酸化,传递抑制信号。NKG2A介导的信号通路在介导肝癌等恶性肿瘤的发生和进展中发挥关键的抑癌作用[8]。MKG2C可与CD 94形成异源二聚体,因缺乏ITIMs基序,不能传递抑制信号,却能够传递活化信号。人源性NKG2D是以同源二聚体形式表达,无需CD94,也不会与之结合,小鼠NK细胞表达的也是NKG2D同源二聚体。Ho等[9]以C57BL/6J、BALB/cJ和C57BL/6T小鼠为实验动物模型,采用cDNA克隆、IL-2诱导活化的NK细胞(亦称淋巴因子激活的杀伤细胞,Lymphokine-activated killer cell,LAK) 培养和免疫印迹分析等方法,基于表达序列标签数据库克隆出与人类NKG2D和CD94互补同源的C57BL/6的cDNA,证实小鼠NKG2D基因序列位于NK基因序列CD94和Ly49受体家族附近,从小鼠NK细胞中克隆出两种NKG2D转录产物,分别为2.7 kb和2.1 kb。小鼠CD94和人类CD94在氨基酸水平上分别有54%一致性和66%相似性。

图1 NK细胞受体Fig.1 NK cell receptorsNote: Activated receptors can be expressed on NK cells, such as NKG2D, C, NKp46, CD16 and others, and multiple inhibitory receptors also can be expressed on NK cells, such as NKD2A, NKG2B and so on.
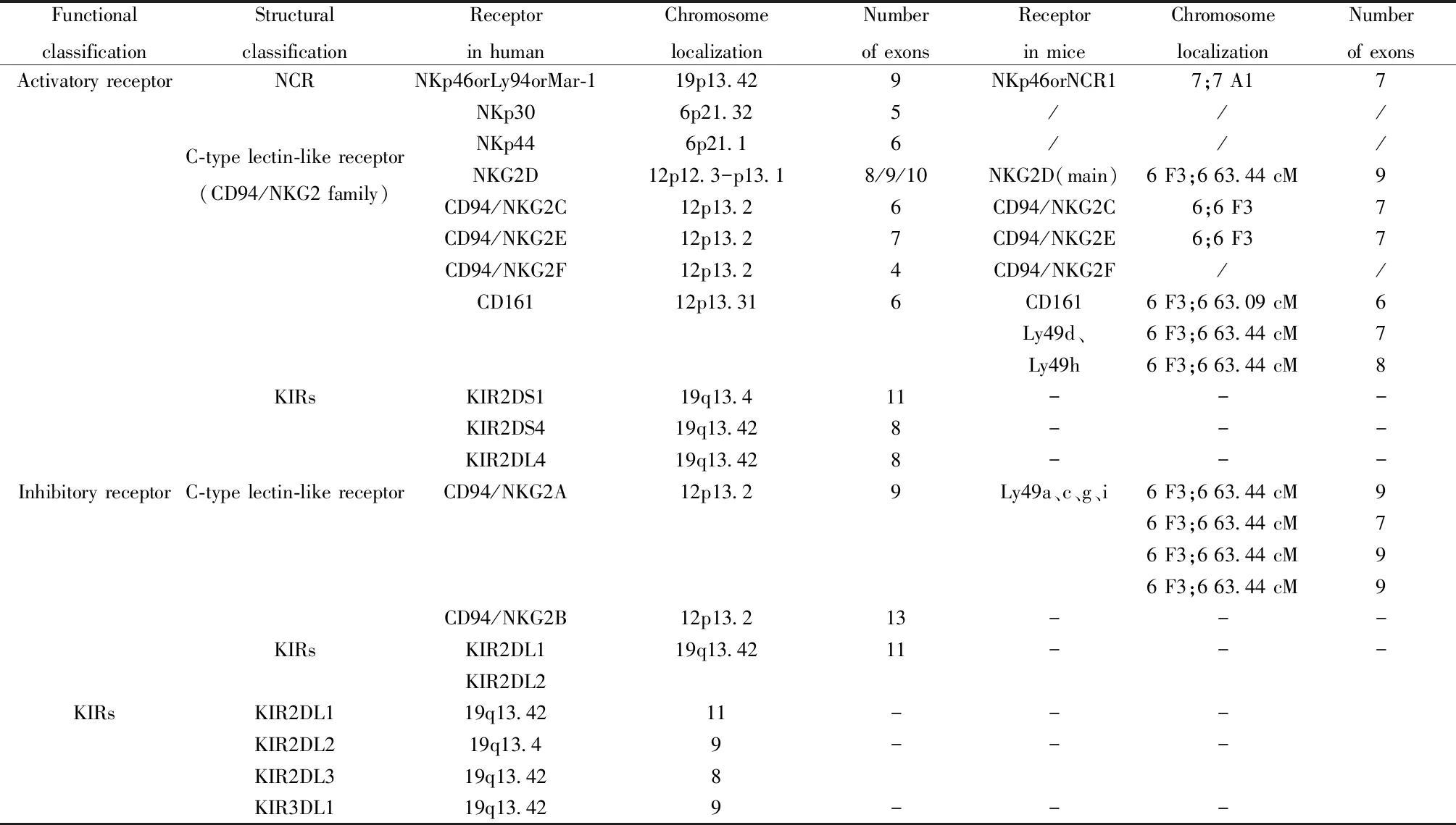
表1 NK细胞活化性受体和抑制性受体
2 NKG2D的染色体定位
2.1鼠源性NKG2D的染色体定位 Dissen等[10]研究发现,NK细胞介导同种异体反应性功能(NK-mediated alloreactivity,NKa)的基因位点位于常染色体上,是一个显性基因,调控由NK细胞介导的同种异体反应,定位在小鼠自然杀伤基因复合体(Natural killer gene complex,NKC)区域,可以调控同种异体淋巴细胞NK细胞的溶菌作用,通过连锁分析和脉冲场凝胶电泳实验证实,定位于小鼠6号染色体上的自然杀伤基因复合体含NKR-P1和Ly-49、NKG2D同系物等多基因家族。
2.2人源性NKG2D的染色体定位 人源性NKG2D基因定位于12p12.3-p13. 1(图2), 基因组
长270 kb,编码分子量为42 kD的Ⅱ型膜蛋白[11]。2012年,Imai等[12]采用单核苷酸多态性(Single nucleotide polymorphisms,SNPs)分析732例原子弹爆炸后幸存者外周血NK细胞和CD8+T细胞表面NKG2D的表达,发现其定位于12号染色体,其NKC区域包括NKG2D hb-1和NKG2D hb-2两个单倍体区。NKG2D hb-1含有两个关键的单倍体等位基因LNK1和HNK1,分别与低自然细胞毒活性和高自然细胞毒活性的表型密切相关,HNK1/HNK1单倍型较LNK1/LNK1对揭示癌症风险的降低更有意义。在NK细胞NKG2D的表达中,LNK1/LNK1、LNK1/HNK1、HNK1/HNK1单倍型表达依次显著增加(P=0.003),或以个体单倍型标记的单核苷酸多态性(haplotype-tagging single nucleotide polymorphisms,htSNPs)依次为主要的纯合子、杂合子、小纯合基因型(P=0.02~0.003),提示NKG2D单倍型参与NK细胞和CD8+T细胞NKG2D蛋白的表达,使机体针对肿瘤细胞毒性反应存在明显的个体差异。
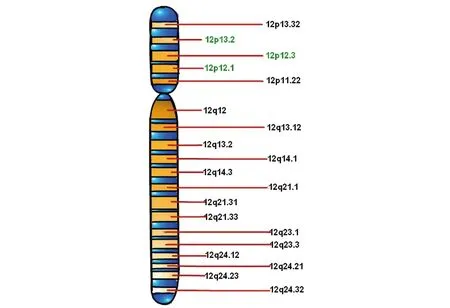
图2 NKG2D染色体定位Fig.2 Chromosome localization of NKG2DNote: Human NKG2D is located at 12p12.3-p13.1.
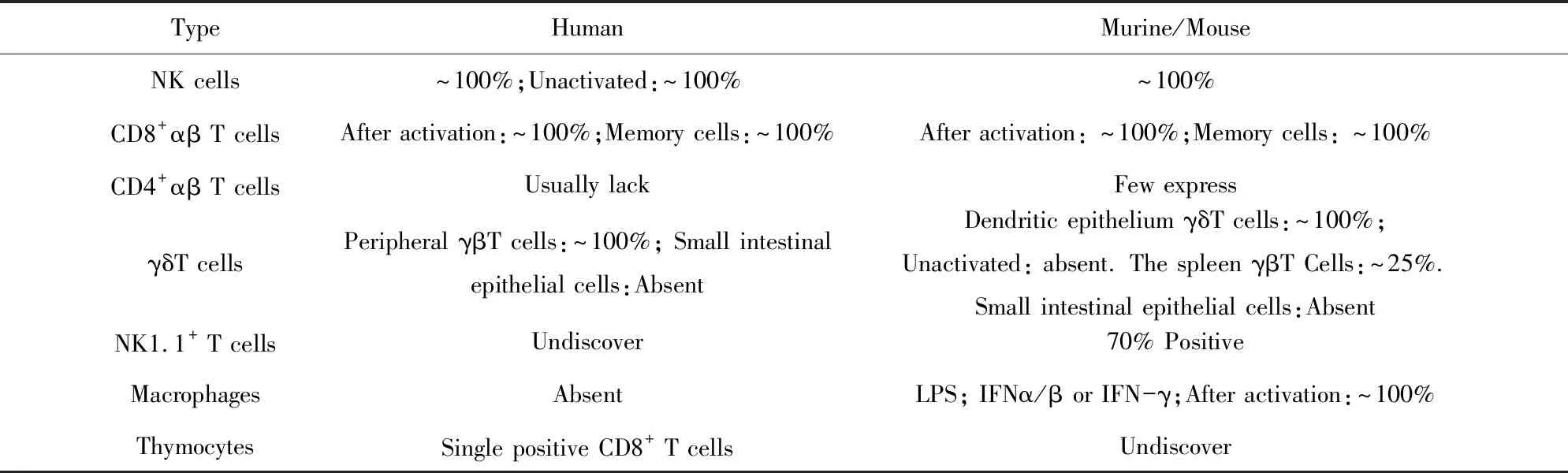
表2 人/鼠源性NKG2D表达
2.3人源性NKG2D与鼠源性NKG2D的异同点 人源杀伤细胞凝集素样受体K1(Killer cell lectin like receptor K1,KLRK1)基因,即编码NKG2D蛋白的功能基因,具有有限的多态性,只有2个等位基因存在单一氨基酸的差异,小鼠同源基因KLRK1多态性同样有限。KLRK1直系同源基因存在于所有哺乳动物和有袋类动物的基因组中,表明该基因在进化过程中高度保守。NKG2D作为活化性受体可同时表达于人源性和鼠源性NK细胞、CD8+T细胞等,但在CD4+T细胞通常缺失表达,具体见表2[13]。
3 NKG2D的基因结构和功能
3.1鼠源性NKG2D的基因结构和功能 早在1998年,Glienke等[14]发现小鼠NKG2D具有相对保守的基因序列,含10个外显子。小鼠NK细胞凝集素样受体的基因(NK lectin-like receptor,NKLLR),亦称NKR-P2。序列分析表明,它与人源性NKG2D基因有高度的同源性,并且这两个分子形成了独特的NKLLR家族,和其他小鼠NKLLR相比,与NKG2家族中的A、B、C和E没有更多相关性[15]。NKR-P2不仅是包含7个内含子的单拷贝基因,而且反映了小鼠NK基因的复杂性。小鼠NKR-P2与人类同源基因的不同之处在于其胞质尾部包含由一个单独的外显子编码的13个氨基酸。NK细胞能够强烈表达NKR-P2,但在T细胞或NK细胞中未检测到缺乏此外显子的剪接变异体。
3.2人源性NKG2D的基因结构和功能 人源性NKG2D基因由10个外显子和9个内含子组成。外显子2~4编码胞内、跨膜结构域,外显子5~8编码与配体结合的结构域(图3示),是一个突出于细胞外空间的膜结合结构域。人源性的NKG2D虽然具有特定的单核苷酸变异性,但与鼠源性NKG2D受体有70%同源性。
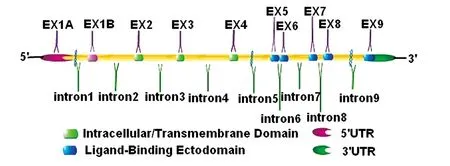
图3 人源性NKG2D基因结构Fig.3 Gene structure of human NKG2DNote: The gene structure of human NKG2D is composed of 10 exons and 9 introns. The exon 2 to exon 4 encode the intracellular and transmembrane domain. The exon 5 to exon 8 encodes the domain, which is prominent in the extracellular and can combine with a ligand.
Shum等[16]提取14例志愿者外周血单个核细胞中的总RNA,经PCR扩增技术确定人源性NKG2D的等位基因,发现其中至少有5个志愿者为NKG2D杂合子。对每一个供者的每一种等位基因进一步分析,依据人类基因研讨会的专家共识,发现人类NKG2D至少表达三个不同的等位基因,分别用NKG2D01、NKG2D02、NKG2D03表示,它们的登记号依次为NM-007360、AF260135、AF260136,其中“NM”表示参考序列,但三种等位基因的基因序列均表示为D12S2489E。NKG2D01基因序列最初由Houchins等[17]研究发现,与另外2种等位基因的同源性很高,仅有214和624两个位点的核苷酸不同,其中一个是同义核苷酸,另一个是反义核苷酸。214位点的碱基分别是G、G、A,624位点的碱基为A、G、G。此外,还对比分析了人类和黑猩猩CD94、某些NKG2家族基因的转录异构体,其中三种人源性NKG2D和黑猩猩的pt-NKG2D的核苷酸同源性为98.9%,证实NKG2D是一种高度保守的基因。
3.3人源性NKG2D与鼠源性NKG2D基因结构和功能差异 早在2002年Diefenbach等[18]提出,小鼠NKG2D的mRNA剪接可产生两种剪接体:长(NKG2D-L)和短(NKG2D-S)的剪接体。除5′端外,两个开放阅读框(Open-reading frames,ORFs)是相同的:NKG2D-L与NKG2D-S相比,包含一个额外的上游AUG密码子,从而使NKG2D-L在相关蛋白胞浆区的氨基端要长出13个氨基酸。通过mRNA半定量PCR分析表明,这两种亚型在不同的细胞类型中均有不同程度的表达,并受到细胞活化的调节。流式细胞术和免疫共沉淀实验表明,NKG2D-S能与DAP10、DAP12结合,而NKG2D-L仅能与DAP-10结合。DAP12基因与DAP10基因相邻,二者之间染色体定位仅相距300 bp,为含有86个氨基酸的Ⅰ型跨膜蛋白,主要为NKG2C、E的接头蛋白。
由此可知,不同物种之间NKG2D基因结构和功能存在一定的差异。人源性NKG2D与鼠源性NKG2D分别定位在12号、6号染色体上,其包含的外显子和内含子数也不同,鼠源性NKG2D胞质尾部包含一个单独的外显子,可编码13个氨基酸。而人源性NKG2D至少表达三个不同的等位基因,有关鼠源性NKG2D等位基因尚未见报道。
4 NKG2D的蛋白质结构和功能靶位
4.1鼠源性NKG2D的蛋白质结构和功能靶位 2008年Guerra等[19]在探讨NKG2D缺陷型小鼠NK细胞特征时,发现在NK细胞发育过程中,NKG2D缺陷型小鼠的NK细胞表面成熟标志与正常小鼠没有显著差异,即表明NKG2D对NK细胞的正常表型发育不是必需的。小鼠可表达两种NKG2D选择性剪接异构体于NK细胞和持续活化型CD8+T细胞表面,NKG2D-L亚型也以二硫键形成二聚体的形式表达,并且与DAP10结合。活化后,小鼠NK细胞表达的NKG2D-S亚型可与DAP10或DAP12结合。DAP10含有可招募P85 PI3K激酶、Vav-1、Grb2 信号复合体的YINM基序,而DAP12含有可招募 Syk和ZAP70的ITAM基序。
4.2人源性NKG2D的蛋白质结构和功能靶位 NKG2D是在人类NK细胞和活化的细胞毒性T淋巴细胞(CTL)上均能表达的活化性受体,属跨膜性受体,分子量大约为42 kD,是重要的免疫活性分子[20]。NKG2D单聚体蛋白质的三维结构包括2个α螺旋、2个β片层、4个二硫键,其胞外域含有1个C型植物血凝素样受体的β片层(β-stand)结构。NKG2D的跨膜区域含有带正电荷的氨基酸,胞浆区不含传递信号的基序,主要依靠接头蛋白DAP来传递活化信号。NKG2D的主要接头蛋白是DAP10,可以通过静电作用与DAP10跨膜区富含负电荷的氨基酸残基结合,这是NKG2D表达和激活下游信号PI3K和Grb2所必需的,并能进一步促进细胞增殖、刺激细胞因子产生、激活免疫细胞、激发NK细胞和T细胞的细胞毒性潜力[21]。人源性DAP10定位于19q13.1,是由74个氨基酸组成的Ⅰ型跨膜蛋白,可以通过胞外区半胱氨酸残基的二硫键形成同源二聚体,继而表达于NK细胞表面。
4.3人源性NKG2D与鼠源性NKG2D蛋白质结构和功能靶位差异 NKG2D在多种人源性和鼠源性细胞表面呈差异表达,如在几乎所有CD8+T细胞、NK细胞、单阳性CD8+T细胞等表达情况是不一样的,但似乎只与NK细胞和T细胞中的DAP10相结合,这可能是NK细胞和T细胞具有细胞毒效应的原因之一。人类所有的CD8+T淋巴细胞能够表达NKG2D,而在小鼠内仅表达活化的CD8+T淋巴细胞。此外,在小鼠体内存在NKG2D两个长、短不同的亚型。在人类中,只有较长的NKG2D受体亚型。人源性NKG2D与鼠源性NKG2D蛋白质结构和功能位点差异见表3。
5 NKG2D介导的信号传导
NKG2D作为一个关键的活化受体,导致DAP10的磷酸化反应,它可以激活丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)和Janus激酶(Janus kinase,Jak)/信号转导器和转录活化因子(Activators of transcription,STAT)实现多种途径的信号传导[22]。NKG2D细胞质中缺少传导信号的结构,但是,NKG2D在人体内通过转接蛋白分子DAP10和在小鼠内的DAP10和DAP12结合,激活信号传导,诱导细胞毒性效应细胞的脱粒和/或细胞因子的产生。2009年Segovis等[23]提出NKG2D介导的信号传导途径首先需要PI3K及其亚单位P85和转接蛋白CrkL的参与,随后激活下游因子,如Ras家族的小GTP酶Rap1,从而实现细胞毒作用(图4、5)。而DAP12可以通过自身基于酪氨酸的免疫受体活化基序招募ZAP70和Syk,进而可以直接发挥细胞毒作用,或者通过PI3K、STAT5产生效应细胞因子。因此,在小鼠体内,NKG2D可通过PI3K和Syk/ZAP70两条信号通路发挥功能。
Sagiv等[24]在探讨NKG2D配体介导衰老细胞的免疫调节作用中,采用组织培养、细胞毒性实验、SA-β-gal染色、基因敲除、流式细胞术及免疫荧光等多种实验方法证实,在复制性衰老、DNA损伤导致的衰老、癌基因诱导的衰老过程中,衰老细胞表面的MICA、ULBP2上调是介导NK细胞NKG2D识别和消除衰老成纤维细胞所必需的,值得注意的是,这些配体的连续表达受ERK信号通路调控。在敲除NKG2D基因的小鼠模型中,衰老活化星状细胞的积累增加,肝损伤中的衰老细胞难以消除,从而加重肝纤维化,提示NKG2D 受体通过与配体相互作用能够延缓或阻断肝纤维化的进程。
6 NKG2D介导的生物学功能
活化的NK细胞受体NKG2D和它的多种配体共同组成的一个强大的压力诱导监测系统,可以对受感染、发炎和恶性转化的细胞产生一定的抵抗作用,并且在抗肿瘤免疫监视中起决定性作用。
乙型肝炎病毒(Hepatitis B virus,HBV)感染是一种免疫介导的肝病。为研究NKG2D活化NK细胞参与抗乙型肝炎病毒的分子机制,Wang等[25]通过阻断或不阻断NKG2D进行两组实验,将NK细胞和正在发生HBV复制的HepG2细胞共培养后,通过流式细胞术、免疫组织化学(Immunohistoch-emistry,IHC)分别检测NKG2D、IFN-γ的mRNA和蛋白质表达水平。结果显示, HBV感染患者外周血NKG2D+、IFN-γ+NK细胞增多,肝组织内NKG2D、IFN-γ的mRNA和蛋白质含量都显著增高,体外培养NKG2D、IFN-γ的mRNA和蛋白水平明显高于被NKG2D单克隆抗体阻断的培养组。提示NKG2D通过激活HBV感染过程中的NK细胞,部分调节免疫炎症和增强抗病毒效应。

表3 人/鼠源性NKG2D蛋白质结构和功能靶位
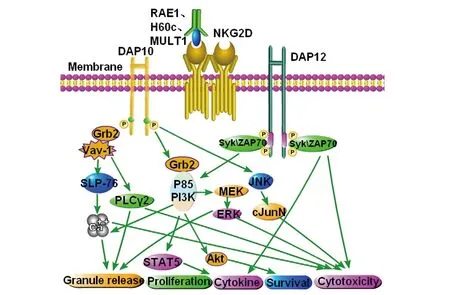
图4 鼠源性NKG2D介导的信号通路Fig.4 Signal transduction pathway mediated by NKG2D in miceNote: When mouse NKG2D homodimer is combined with its ligands (RAE1, H60, and MULT1) and connects with DAP10 on the surface of the cell membrane, which makes DAP10 residues phosphorylate, and activates the downstream PI3K and the regulatory subunit P58. It promotes the increase of calcium influx and the release of granzyme. Otherwise, It further promotes cell proliferation by activated STAT5 signal transduction pathway. Cytotoxic effect is played through the pathway of JNK-cJunN axis. DAP12 can recruit ZAP70 and Syk by its tyrosine receptor activation motifs, which can directly exert cytotoxic effect, or produce effector cytokines through PI3K and STAT5. Therefore, there are two signaling pathways, PI3K and Syk/ZAP70, in mice for NKG2D.
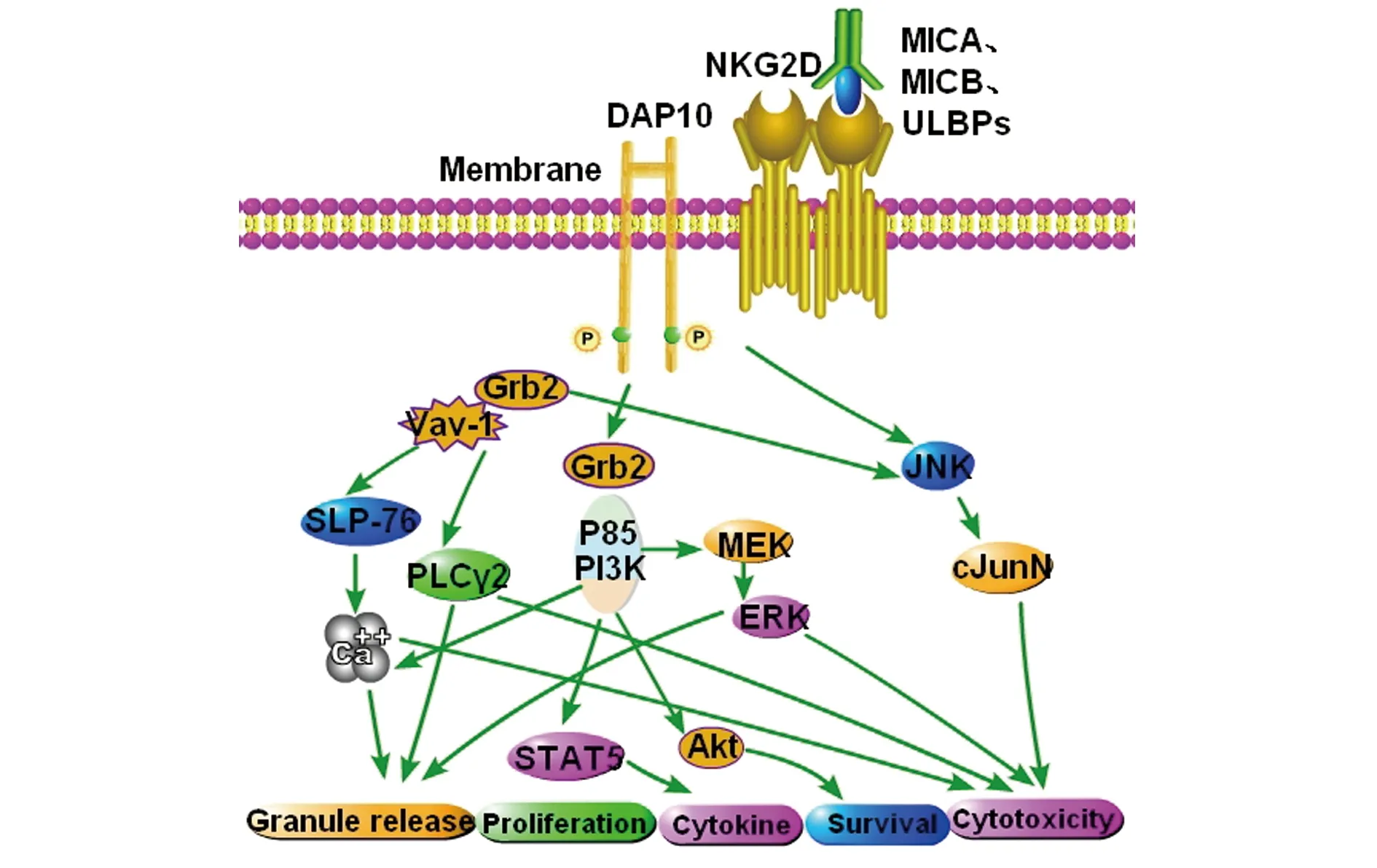
图5 人源性NKG2D介导的信号通路Fig.5 Signal transduction pathway mediated by NKG2D in humanNote: When human NKG2D homodimer is combined with its ligands (MICA, MICB, ULBPs) and connects with DAP10 on the surface of the cell membrane, which makes DAP10 residues phosphorylate, and activates the downstream PI3K and the regulatory subunit P85. It promotes the increase of calcium influx and the release of granzyme. Otherwise, It further promotes cell proliferation by activated STAT5 signal transduction pathway. Cytotoxic effect is played through the pathway of JNK-cJunN axis.
慢性乙型肝炎免疫清除期,外周血和肝组织中NK的频率和分布均明显增加,尤其是NKG2D+NK细胞增加尤为明显,可有效抑制病毒的复制,减少由HBV引起肝硬化、肝癌的风险[26]。NKG2D配体特异表达于肿瘤细胞,与NKG2D结合后可以触发强烈的抗肿瘤效应,提示NKG2D介导的途径可能是治疗癌症的强有力的靶点[27]。
肾缺血-再灌注损伤(Renal ischemia-reperfusion injury,RIRI)可导致急性肾功能衰竭,死亡率高达50%。NK细胞是早期天然免疫应答的重要参与者,但其在肾小管上皮细胞(Tubular epithelial cell,TEC)损伤中的作用尚不清楚。Zhang等[28]研究发现,NK细胞可以杀死体外同系TEC,而TEC在体外凋亡死亡与其表面NKG2D配体早期视黄酸可诱导蛋白(Retinoic acid early transcript-1,RAE-1)上调以及NK细胞上的NKG2D表达有关。肾细胞制剂的FACS分析表明,在 IRI后肾脏内NKG2D显著增加,与RAE-1结合后增强NK细胞杀细胞效应。但是在野生型C57BL/6小鼠模型中,NK细胞耗竭对其生存有利,因为NK细胞的过继治疗加重了NK、T和B细胞缺失的Rag2(-/-)gamma(c)(-/-)小鼠的IRI损伤。在某些疾病中,如肾缺血-再灌注损伤,NKG2D与配体结合后,活化NK细胞,增强杀肾小管上皮细胞效应,可加重病情。
综上所述,NKG2D是NK细胞表面最重要的活化性受体,其基因结构复杂,蛋白质结构具有多个功能位点。可通过激活PI3K、PLCγ2、JNK-cJunN等信号通路,使NK细胞TNF-α、IFN-γ、颗粒酶释放分泌增加,FasL、TRAIL表达上调,在非宿主MHC限制条件下,发挥对肿瘤细胞的细胞毒性效应。尤其在抗病毒感染、延缓癌症进展、促进组织损伤等方面发挥重要作用[29-32]。
