抗人PD-L1单克隆抗体制备及其在肿瘤病理诊断中的意义①
2019-04-12廖伟聪黄建芳向军俭冯沛然何亚运
廖伟聪 黄建芳 向军俭 冯沛然 何亚运 张 宇
(暨南大学抗体工程研究中心,广东省分子免疫与抗体工程重点实验室,广州510632)
细胞程序性凋亡配体(Programmed cell death ligand-1,PD-L1)在肿瘤微环境中的异常高表达被认为是肿瘤免疫逃逸的作用之一。PD-L1通过与表达在免疫细胞上的PD-1相互作用,往往可导致免疫细胞上PD-1抑制性信号的活化与转导,从而发挥强有力的免疫抑制作用。而相关研究报道,在某些肿瘤环境中PD-L1的异常高表达,能抑制免疫系统清除功能,促进肿瘤进展并导致肿瘤免疫逃逸[1-4]。
PD-1/PD-L1抗体药物是当前肿瘤免疫疗法中最受瞩目的抗体靶向药物,其作用机理主要是通过阻断T细胞PD-1与肿瘤细胞PD-L1的结合来削弱T细胞上PD-1介导的抑制作用,从而增强免疫系统对肿瘤的杀伤作用[5,6]。目前已有PD-1抗体药物Keytruda和Opdivo,PD-L1抗体药物Tecentiq、Imfinzi和Bavencio等5个PD-1/PD-L1抗体药物在国外上市。
PD-1/PD-L1免疫疗法在多种难治愈的癌症上都具有良好的治疗效果,但其总体治疗的客观反应率偏低[7,8]。Topalian等[9]通过观察42名患有多种实体瘤的患者,发现有36%PD-L1阳性患者对使用Nivolumab存在客观反应,而PD-L1阴性患者则无一例产生客观反应,提示实体瘤的PD-L1表达量与PD-1/PD-L1抗体药物疗效呈正相关。Balar等[10]发现经典霍奇金淋巴瘤(Classical hodgkin lymphoma,CHL)是普遍高表达PD-L1/2的癌症,而临床试验发现PD-1/PD-L1免疫抑制剂疗法对CHL患者有很好的疗效(CHL患者经Nivolumab治疗后,66%的患者的肿瘤出现萎缩,甚至有7例患者的肿瘤完全消失[11])。综上提示,PD-1/PD-L1抗体药物疗效与PD-L1表达量呈正相关,然而并非所有类型的肿瘤均高表达PD-L1,且临床上肿瘤患者的PD-L1表达也呈现多样性,因此在PD-1/PD-L1靶向药物治疗前对患者进行PD-L1表达强度分析显得尤为重要。
综上所述,对肿瘤患者的PD-L1表达量检测分析能一定程度上判断PD-1/PD-L1靶向药物的治疗效果,为临床上PD-1/PD-L1靶向药物的个体化及最佳化治疗提供一定的参考价值。
目前,大部分PD-L1单抗的研究主要集中于研究其抑瘤效果,而从其检测效果出发研究的很少,本研究主要侧重于其对肿瘤PD-L1表达水平的检测。本研究通过单克隆细胞株的制备及对单克隆抗体的鉴定和肿瘤细胞、组织验证,筛选出高亲和力、高特异性的抗人PD-L1单抗的杂交瘤细胞株,该株抗体为患者个体化使用PD-1/PD-L1靶向药物以及患者最佳疗法筛选的后续研究提供重要的参考价值。
1 材料与方法
1.1材料
1.1.1主要试剂 人PD-L1重组蛋白(Novop-rotein,Catalog# C315),HAT/HT、弗氏佐剂(完全、不完全)、PEG2000均购自Sigma,胎牛血清(Gemini,Catalog# 900-108),单抗亚类检测试剂盒SBA Clonotyping System-HRP ( Southern-Biotech,Catalog #5300-05),酶标二抗(KPL,Catalog # 074-1086),Protein G亲和层析柱(GE,5 ml),恶性肿瘤组织芯片(西安艾丽娜生物科技有限公司)。
1.1.2实验材料 SPF级BALB/c纯系雌性小鼠,周龄为6周,购自南方医科大学实验动物中心;SP2/0小鼠骨髓瘤细胞株(丹麦株)、K562、OV2008、C13、H1299等肿瘤细胞株(本实验室保存)。
1.2方法
1.2.1抗PD-L1单克隆抗体的制备 使用重组PD-L1胞外段蛋白以腹部皮下多点免疫的方法免疫7周龄BALB/c小鼠,免疫剂量为50 μg/只[12]。采用常规细胞融合和间接ELISA等方法筛选出4株阳性克隆株。小鼠腹腔注射杂交瘤细胞制备腹水,腹水经饱和硫酸铵沉淀和Protein G亲和层析纯化后冻干备用。
1.2.2PD-L1单抗Ig类及亚类的鉴定 使用SBA Clonotyping System-HRP试剂盒对筛选的单抗的Ig类及亚类进行测定,所有操作严格依照试剂盒说明书操作。
1.2.3PD-L1单抗特异性的鉴定 PD-L2蛋白以0.5 μg/ml包板,采用5%脱脂奶粉封闭;检测单抗以OD450值约为2的稀释倍数进行稀释加样,其余步骤参照常规间接ELISA操作。
1.2.4PD-L1单抗亲和常数的测定 非竞争酶免疫实验测定其亲和常数( Affinity constant,Ka)。参考Beatty等[13]的方法,按照公式Ka=(n-1)/2(n[Ab′]-[Ab]t)计算亲和常数Ka值。
1.2.5Western blot检测肿瘤细胞PD-L1的表达 使用强裂解液将肿瘤细胞裂解提取总蛋白[14],总蛋白经SDS-PAGE电泳后再电转到PVDF膜上,5%脱脂奶粉封闭膜后加入浓度为1 μg/ml的Ab3单抗,4℃过夜孵育后取出膜并用PBS-T洗涤3次,加入HRP酶标二抗(1∶8 000) 室温孵育1 h,PBS-T洗涤5次,加入ECL化学发光液反应,胶片曝光后进行显影和定影,并扫描胶片,灰度软件分析其灰度差异。
1.2.6免疫组化检测肿瘤组织PD-L1的表达 选择高中低PD-L1表达水平的膀胱癌和黑色素瘤病理组织芯片为检测样本,免疫组化采用常规的S-P法,用本研究制备的Ab3单抗为一抗(工作浓度10 μg/ml),其余步骤严格按照试剂盒操作步骤进行;肿瘤组织切片厚度约为2 μm。用DAB显色和苏木紫复染;在倒置显微镜下观察,拍照并进行图像分析。判断标准:细胞膜或细胞质被染上棕黄色的肿瘤细胞为PD-L1阳性细胞;阳性率<25%为低表达,阳性率在25%~50%为中度表达,阳性率>50%为高表达。
1.3统计学分析 采用Graph Pad Prism 5.0软件进行作图,并分析不同数据间统计学差异。
2 结果
2.1PD-L1单克隆制备 以重组人PD-L1胞外段蛋白为免疫原,BALB/c小鼠经3次免疫后,取最高滴度免疫血清的小鼠进行细胞融合,通过有限稀释法筛选阳性细胞株,共获得4株可稳定分泌抗人PD-L1单克隆抗体的杂交瘤细胞株,分别命名为Ab1、Ab2、Ab3、Ab4。经体内诱生制备腹水,腹水经饱和硫酸铵沉淀和Protein G纯化后,用SDS-PAGE凝胶电泳鉴定其纯度,结果如见图1所示,在分子量为50 kD和25 kD位置左右清晰可见抗体重链、轻链条带,无杂带,抗体纯化效果良好。
2.2PD-L1单抗特异性鉴定 结果如表1所示,使用单抗亚类检测试剂盒测定单抗亚类,除Ab2是IgG2a类外都是IgG1类抗体。纯化后的单抗ELISA效价为4.1~20.0 ng/ml之间;制备的单抗与PD-L2蛋白均无交叉反应;采用非竞争酶联免疫实验测定4株单抗亲和常数,其中Ab3单抗的亲和常数最高,为7.85×109M-1。
2.3Western blot检测肿瘤细胞PD-L1表达水平 用Western bolt检测不同肿瘤细胞裂解液中的PD-L1,结果如图2A所示,Ab3抗体能与多种肿瘤细胞(OV2008、C13、K562、H1299、MCF-7)中PD-L1蛋白结合,无明显杂带,说明抗体特异性良好。WB条带应用Quantity One软件,通过比较WB条带的灰度分析肿瘤细胞间PD-L1的相对表达量,结果如图2B所示, OV2008细胞株的PD-L1表达水平相对最高,
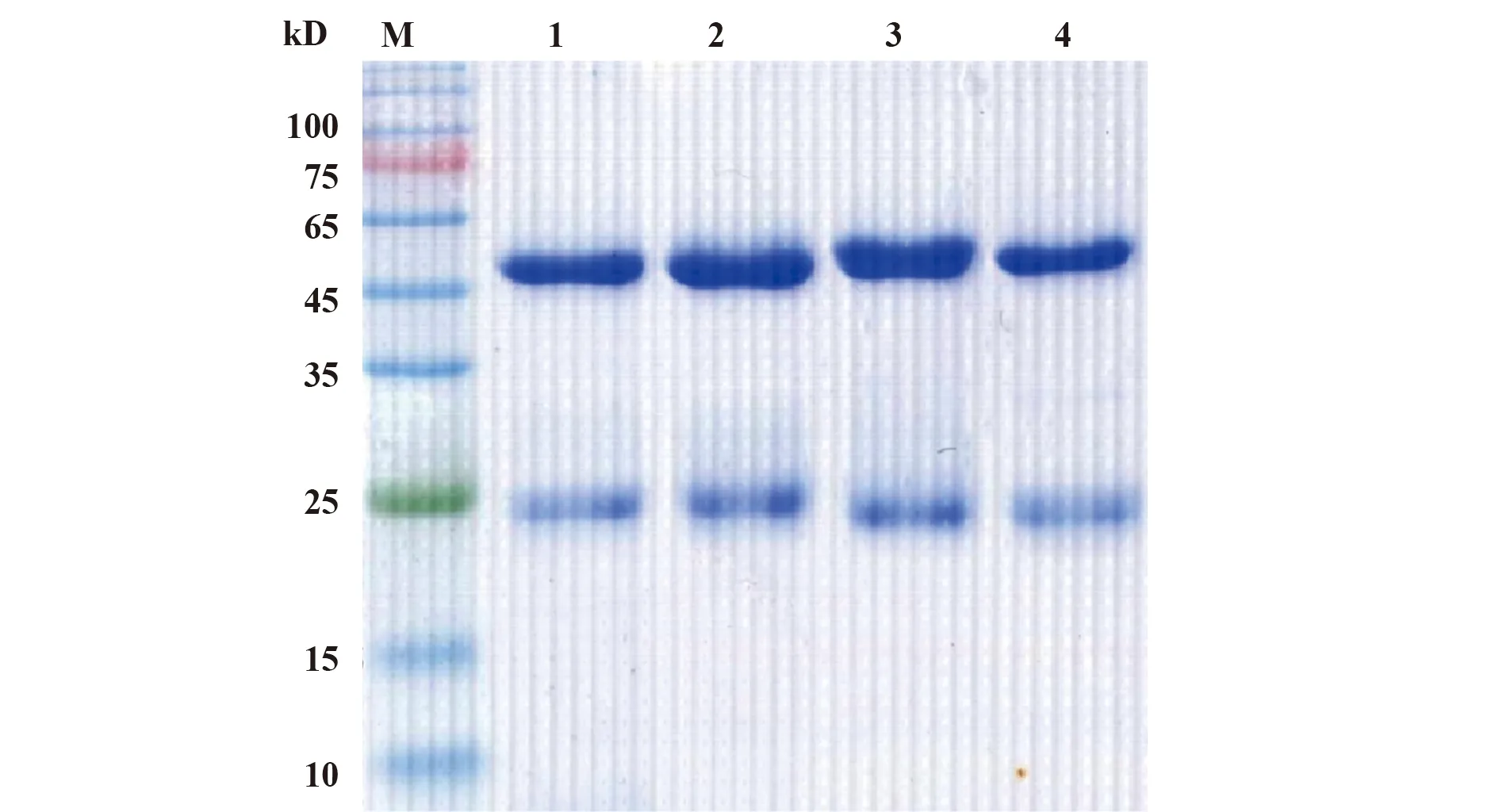
图1 抗人PD-L1单克隆抗体的SDS-PAGE分析Fig.1 SDS-PAGE analysis of anti-hPD-L1 MabsNote: M.Protein Marker;1.Ab1;2.Ab2;3.Ab3;4.Ab4.

表1 单抗特异性鉴定
Note:"-"Indicating that the OD450 value is less than twice the negative value,proved no cross-reaction with the PD-L2 protein.
C13细胞株的PD-L1表达水平相对最低。结果表明,Ab3抗体能与天然PD-L1蛋白结合,并能通过WB方法检测肿瘤细胞PD-L1蛋白的相对表达量。
2.4免疫组化检测膀胱癌和黑色素瘤组织PD-L1的表达水平 用免疫组化和Ab3单抗检测不同分期的膀胱癌和黑色素瘤组织切片;采用高倍镜下人工阅片的方式统计病理切片PD-L1阳性细胞率(PD-L1阳性细胞/总细胞数)。其中不同PD-L1表达水平的膀胱癌组织切片的PD-L1阳性率分别为8.3%、47.7%、97.5%(见图3),其PD-L1阳性率符合高中低PD-L1表达水平的膀胱癌组织芯片的预期结果。而黑色素瘤组织切片PD-L1阳性率分别为11.4%、40.5%、100%(见图4),其PD-L1阳性率符合高中低PD-L1表达水平的黑色素瘤组织芯片的预期结果。膀胱癌和黑色素瘤组织芯片PD-L1阳性率的结果表明,Ab3单抗能检测出不同分期的膀胱癌和黑色素瘤组织中 PD-L1的不同表达水平。

图2 Western blot分析不同肿瘤细胞PD-L1表达水平Fig.2 Expression level of PD-L1 in different kinds of tumor cell lines were analyzed by Western blotNote: A.Western blot;B.Relative grayscale level.
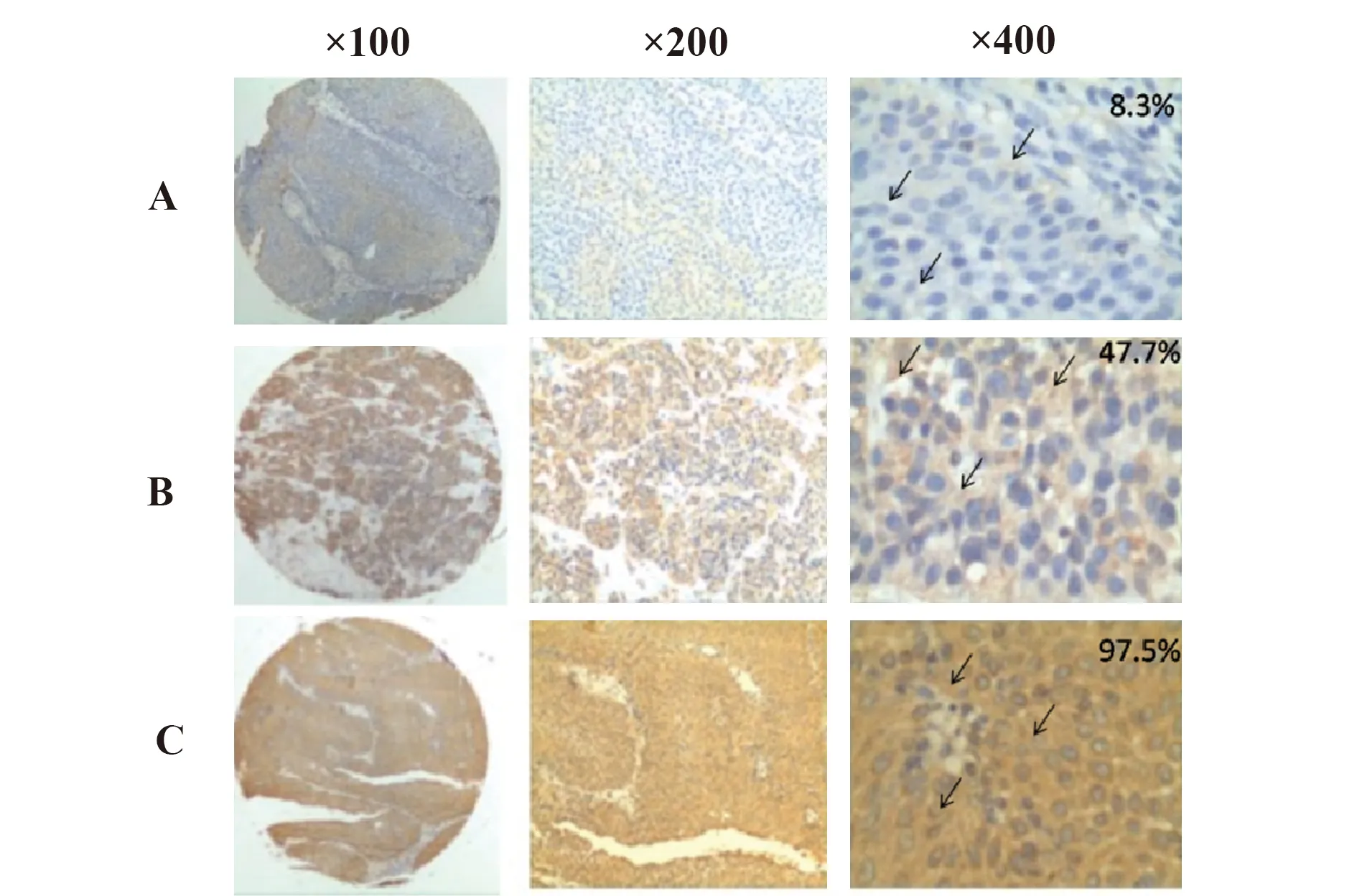
图3 Ab3单抗免疫组化检测膀胱癌组织PD-L1表达水平Fig.3 PD-L1 expression level of bladder cancer by using ICH and Ab3 MabNote: →.The arrows indicated the PD-L1 positive cells;A.Low expression cases(8.3%);B.Moderate expression cases(47.7%);C.High expression cases(97.5%).
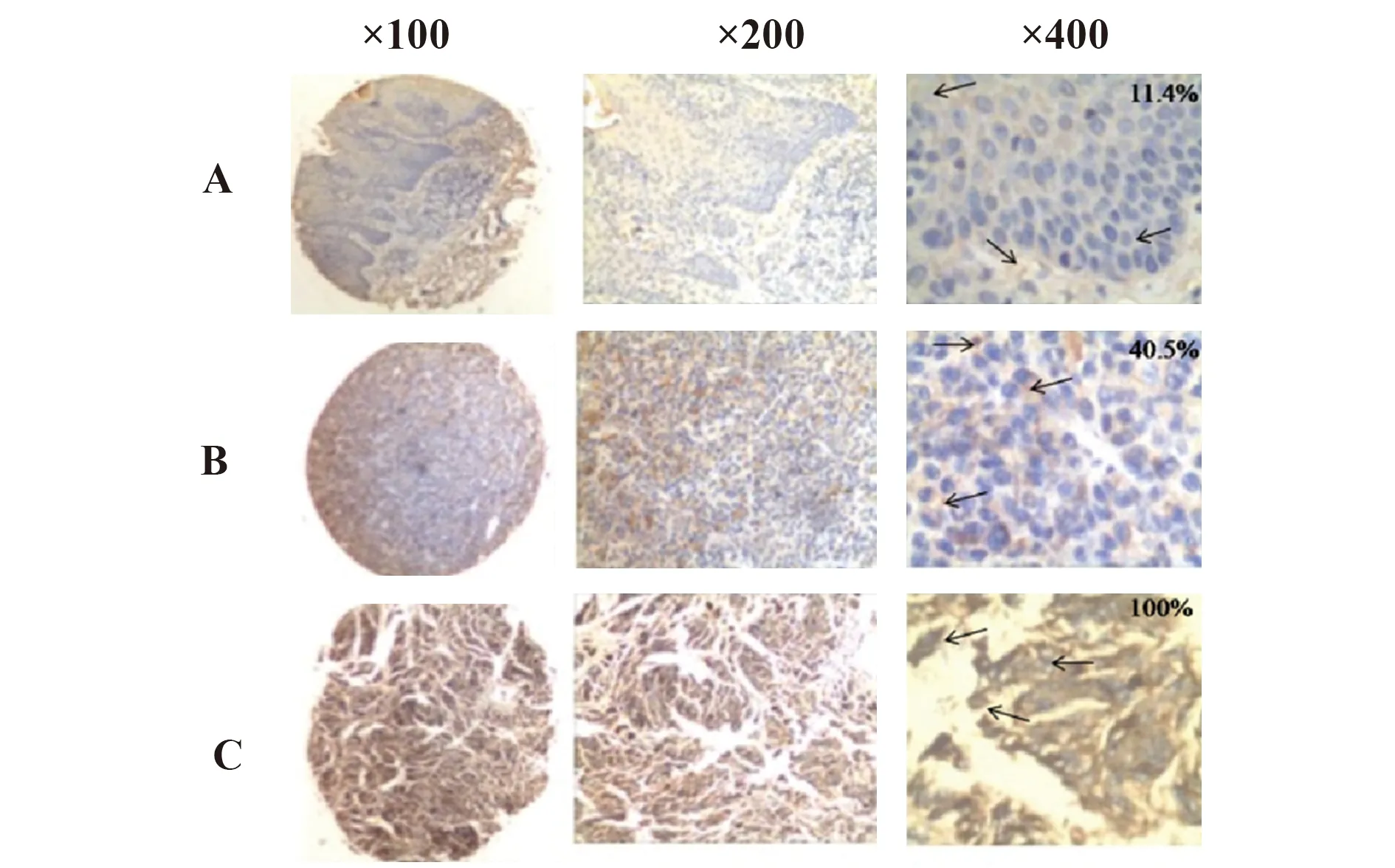
图4 Ab3单抗免疫组化检测黑色素瘤PD-L1表达水平Fig.4 PD-L1 expression level of Melanoma cancer by using ICH and Ab3 MabNote: →.The arrows indicated the PD-L1 positive cells;A.Low expression cases(11.4%);B.Moderate expression cases(40.5%);C.High expression cases(100%).
3 讨论
在肿瘤微环境中,肿瘤细胞上调PD-L1表达,当肿瘤细胞的PD-L1与T细胞上的PD-1相互结合,从而抑制了T细胞的活化增殖,导致T细胞失能。这是由于肿瘤细胞不能像正常免疫调节那样,通过单核吞噬细胞等免疫细胞上PD-L1与T细胞上PD-1识别结合激活PD-1/PD-L1信号通路,进而导致肿瘤免疫逃逸[15,16]。临床试验数据显示患者的PD-L1表达水平与PD-1/PD-L1抑制剂免疫疗法的收益存在明显正相关性,PD-L1对患者使用PD-1/PD-L1抗体药物的预后评价具有重要意义。
免疫组化检测肿瘤患者免疫检查点PD-L1的表达水平作为肿瘤患者精准治疗的重要推荐判断标准[8]。临床上免疫组化检测患者肿瘤组织切片上PD-L1表达水平,有助于优化PD-1/PD-L1抑制剂免疫疗法治疗肿瘤患者的预后,提高患者用药受益。本研究获得Ab3单抗具有较高亲和力,Ab3单抗的效价和亲和力常数分别为4.1 ng/ml、7.85×109M-1。Western blot结果表明Ab3单抗能特异性识别肿瘤细胞上的天然PD-L1,并能检测不同分期的膀胱癌、黑色素瘤组织切片的PD-L1表达水平的差异,表明Ab3单抗可开发成肿瘤病理诊断抗体。
致谢:感谢暨南大学第一临床学院病理科陆元志教授给予免疫组化实验技术的热情指导和大力帮助。
