超声波对碳酸锂反应结晶过程的影响
2019-04-12刘玉强张志强毕秋艳张一瑶
刘玉强,张志强,毕秋艳,张一瑶
(青海大学化工学院,青海西宁810016)
碳酸锂(Li2CO3)是锂化合物中最基础的锂盐,是制备其他锂化合物和锂合金的主要原料。近年来,随着高纯锂盐在新能源和新材料等高新技术领域尤其是电动汽车领域扮演着越来越重要的作用,使其表现出诱人的应用前景[1-2]。碳酸锂作为锂电池正极材料的重要原料和重要的电解液添加剂,对锂电池的性能及寿命有很大的影响,不仅要求碳酸锂具有很高的纯度,而且对其粒度也有严格要求。
目前,以盐湖卤水为原料的碳酸锂生产过程均采用碳酸钠与氯化锂的反应结晶制备碳酸锂,是碳酸锂生产工艺中最重要的过程之一。由于氯化锂与碳酸钠反应速度很快,碳酸锂的溶解度又非常低,生产过程中反应体系会迅速进入结晶的不稳定区,造成爆发成核,使得碳酸锂晶体小、表面能大,因此碳酸锂晶体有很强的团聚倾向[2]。晶体形成团聚体的过程容易产生母液夹带,不但会影响产品纯度,还使得晶体粒度和粒度分布很难达到电池级碳酸锂行业标准的要求(d10≥1.0 μm,3 μm≤d50≤8 μm,9 μm≤d90≤15 μm),同时还会影响碳酸锂的洗涤、过滤及干燥性能。
通常认为晶体团聚过程是由碰撞、粘附和搭桥固化3个连续的基本步骤组成的[3],抑制晶体团聚的有效方法是在结晶过程中使用超声波[3-4]。此技术已经被众多学者证实,包括减少亚稳区宽度,获得窄的粒度分布和均匀的晶体形态[5-7]。虽然这些现象的确切机制尚未被证实,但目前普遍接受的观点是超声的空化作用,空化气泡在溶液中的作用包括微米级气泡的形成和破裂及其伴随的机械效应[3]。研究表明,超声在结晶过程中可以有效地抑制团聚,产生具有光滑表面的单晶[4]。 Z.Guo 等[8]通过高速成像观察超声波对悬浮在乙醇中的团聚体的混合和断裂过程的影响,证实了晶体之间的碰撞与空化气泡的振动和破裂有助于对团聚体的破坏。S.K.Bhangu等[6]研究了超声对扑热息痛溶析结晶过程的影响,结果表明加入超声后诱导期变短为原来的1/12,晶体的平均粒径从170 μm减小到13 μm,同时粒度分布变窄。B.Gielen等[7]利用超声对活性药物成分(API)结晶过程进行控制,研究了不同时刻超声加入对结晶过程的影响,结果表明,超声可以有效抑制晶体团聚,反应开始时加入超声有利于成核并可以抑制团聚而超声作为后处理虽然可以破坏一部分团聚体但是会导致晶体破裂。尽管许多报告显示了超声处理对最终晶体形态有不错的效果,但在碳酸钠与氯化锂反应结晶制备碳酸锂方面目前国内外并没有相关文献报道。因此,笔者拟通过对碳酸锂反应结晶中不同超声功率、超声时间和超声施加时刻对晶体团聚和粒度分布的研究,优化反应结晶条件,以期得到符合电池级碳酸锂要求的产品,对碳酸锂产业链工艺优化提供一定的参考依据。
1 实验部分
1.1 试剂与仪器
试剂:Na2CO3(分析纯);LiCl(分析纯);HNO3(优级纯);高锂卤水(组成见表1)。

表1 高锂卤水中主要化学组成 g/L
仪器:Optimax1001型全自动合成工作站;FBRM D600型聚焦光束反射测量仪;PVM V819型颗粒录影显微镜;DHL-A型电脑数显恒流泵;BioSafer1000型超声波发生器;JSM-5610LV型扫描电子显微镜;ICAP 6300型电感耦合等离子体发射光谱仪。
1.2 实验方法
本实验使用LiCl溶液和Na2CO3溶液进行反应

实验中结晶器采用Optimax1001全自动合成工作站。首先,配制一定浓度的LiCl溶液和Na2CO3溶液,用砂芯漏斗过滤后存入塑料瓶中备用。量取一定量的LiCl溶液加入到结晶器中,精确控制结晶器中的温度及搅拌速度,超声波按相应的程序和功率开启。待温度达到反应温度后,用数显恒流泵以固定流量向结晶器内加入Na2CO3溶液。反应开始后用FBRM D600聚焦光束反射测量仪实时在线监测结晶器内的颗粒数及粒度分布、用PVM V819颗粒录影显微镜在线观察不同时刻下的晶体形貌,加料完成后继续反应30 min。反应结束后迅速过滤、烘干,使用扫描电镜测其形貌,得到最优实验条件,在最优条件下利用高锂卤水进行反应。实验装置见图1。结晶,反应方程式如下:

图1 常规实验和超声实验的实验装置
2 结果与讨论
2.1 温度的影响
反应温度分别为 20、40、60、80、90℃做无超声情况下的对照实验,其他固定实验条件为:LiCl溶液为3 mol/L、400 mL,Na2CO3溶液为 1.5 mol/L、440 mL,Na2CO3的加料速度为 5 mL/min,搅拌器转速为400 r/min,加料方式为向LiCl溶液中加入Na2CO3溶液。结果如图2所示。
由图2可看出,随着温度的升高平均粒径呈现先减小后增大的趋势,但减小趋势不明显,60℃时平均粒径最小。超过60℃以后,随着温度的升高平均粒径增大。随着温度的升高粒度分布逐渐变宽,大颗粒数量明显增加,从而导致了平均粒径增大。这是由于温度低时体系黏度较大,不利于传质,使得晶体向单方向生长形成片状晶体。随着温度的升高体系的黏度减小,更加有利于晶体生长,同时晶习也发生了改变(如图3所示),由片状晶体转化为棒状晶体的过程中粒径也随之减小,而当温度进一步升高后晶体生长迅速,使得粒径进一步增大。

图2 反应温度对Li2CO3平均粒径和粒度分布的影响

图3 温度对Li2CO3晶体形貌影响的SEM图
从图3可以看出,在未加超声波的情况下生成的晶体都存在聚结现象。这些聚结体具有显著的星形态,即从一个中心向外定向生长,基本粒子的形状为片状或棒状,意味着晶体沿着这些片状或棒状的长轴定向生长速率是最快的。一般来说,快速生长的晶面与生长缓慢的晶面相比面积较小,并形成更强的吸引力[9-10],结果快速生长的晶面将通过液体桥接彼此接触,并且围绕一个核心将晶体粘合在一起。在这个基础上,通过进一步的增长和聚集过程来维持聚结体,从而形成了星形态。虽然不同温度下都存在团聚,但是低温下得到的是片状聚结体,而高温下得到的是棒状聚结体。片状的聚结体由于表面能较大易夹带母液,会导致纯度降低。综上所述,实验选择60℃为最适宜的实验温度。
2.2 超声波功率的影响
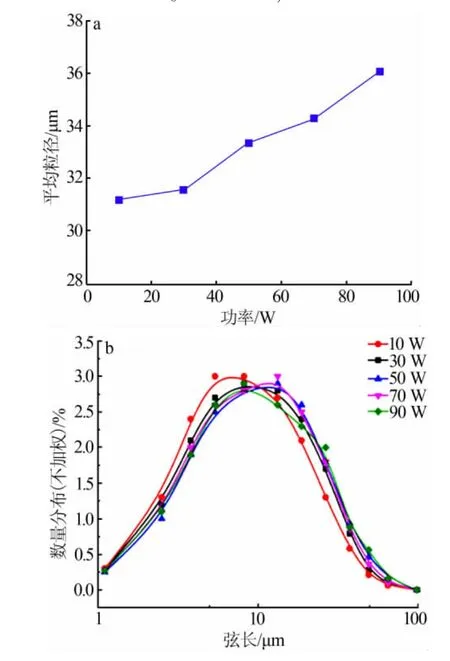
图4 超声功率对Li2CO3平均粒径和粒度分布的影响
分别在超声功率为 10、30、50、70、90W 下进行实验,其他实验条件固定不变,反应温度为60℃。结果如图4、图5所示。由图4可知,随着超声功率的增强,平均粒径略微增大。各个超声功率下产品粒度分布相差不大,随着功率的增加粒度分布曲线向右偏移,与平均粒度变化趋势相符。有文献报道,随着功率的增大,最终产品的粒径是减小的[4,6],而本实验中实际的情况却相反。这是由于随着超声功率的增大,超声波的破碎作用也随之增强,形成的晶核在未达到临界尺寸之前便溶解[11],导致体系中的晶核数量减少,同时体系的过饱和度增大,这样少量的晶核消耗相同的过饱和度就会导致最终晶体粒径变大。从图5可见,在超声的条件下Li2CO3晶体几乎没有明显的团聚现象。随着超声功率的增强,Li2CO3的粒度也增大,90W的条件下几乎没有细小的晶粒,晶体为较为均匀的棒状体。综合考虑,10W为最佳超声功率。

图5 超声功率对Li2CO3晶体形貌影响的SEM图
2.3 超声施加时刻的影响
由于本实验为连续加料且加料时间为88 min,所以实验拟定超声施加的时刻为反应开始0 min处、22min处、44min处和66min处,超声功率为10W,其他实验条件固定不变。结果见图6、图7。由图6可以看出,反应开始时施加超声最终得到的Li2CO3产品的平均粒径最小。随着超声施加时刻的后移Li2CO3产品的粒度随之增大。随着超声施加时刻的后移,粒度分布曲线向右偏移,大颗粒数量增多。
当反应一开始就加入超声,由于Li2CO3过饱和度很大,加上超声的破碎作用[12]和诱导成核作用(空化气泡可以直接作为成核位点)[3,13], 体系必然会形成大量的晶核,这些小的晶核虽然具有较大的表面能,但是在超声波产生的高频振动下使得体系中固液相均匀混合,同时空化气泡的长大与破裂瞬间释放出巨大的能量,使得固体表面发生强烈微射流[14],这些能量的作用显著改变了表面张力,从而有效地抑制了晶体团聚。
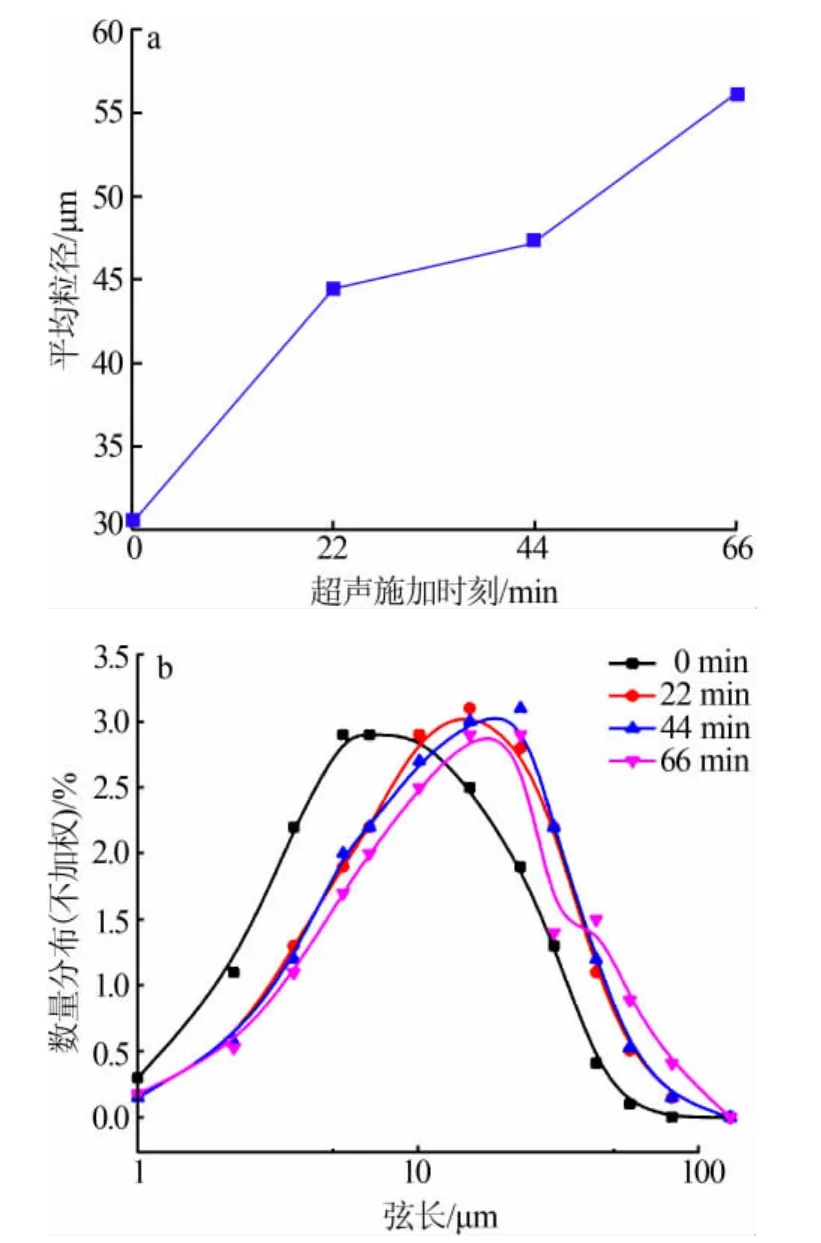
图6 超声施加时刻对平均粒径和粒度分布的影响
事实上,团聚体的形成经历了3个步骤。首先,小晶体在加有搅拌的系统中由于流体运动发生碰撞;随后由于吸引力和粘附力使这些颗粒聚集;最后,由于传质作用和分子生长聚集体转化成团聚体[4]。聚集体由于粘附不充分,结构较为疏松,在转化成团聚体前如果受到强烈的外力作用就会发生分解。而团聚体结构密实在强烈的外力(流体剪切力和超声)作用下也不会完全破碎。
当超声施加位置后移,反应开始时爆发成核形成的大量晶核由于表面能较大,为了降低自身能量,这些小晶体就会形成聚集体。随着反应的进行,聚集体会逐渐转化成团聚体。当超声加入后,由于超声的破碎作用,聚集体会被打碎成细小的颗粒,同时团聚体也会一定程度上被破坏。在强超声场中,晶体碎裂成了细小的晶粒,而按照Gibbs-Thompson效应,在晶体的粒度小于临界直径时,晶体可在达到溶解平衡后继续溶于饱和溶液中[11]。由于团聚体被破坏后的晶体表面不平整使得比表面积增大,就给新形成的晶核在其上面生长提供了许多位点。另外由于反应是连续加料,随着Na2CO3溶液的不断加入,体系中的LiCl被不断消耗,过饱和度逐渐降低,此后晶体的生长速率大于成核速率,使得最终晶体粒径增大且表面高低不平并有明显缺陷(如图7b、7c和7d)。综上所述,选择在反应开始时加入超声。

图7 超声位置对Li2CO3晶体形貌影响的SEM图
2.4 超声时间的影响
因为本实验的反应时间为125 min,所以实验拟设定超声持续的时间分别为 25、50、75、100、125 min,反应开始加入超声,其他实验条件固定不变。结果如图8、图9所示。
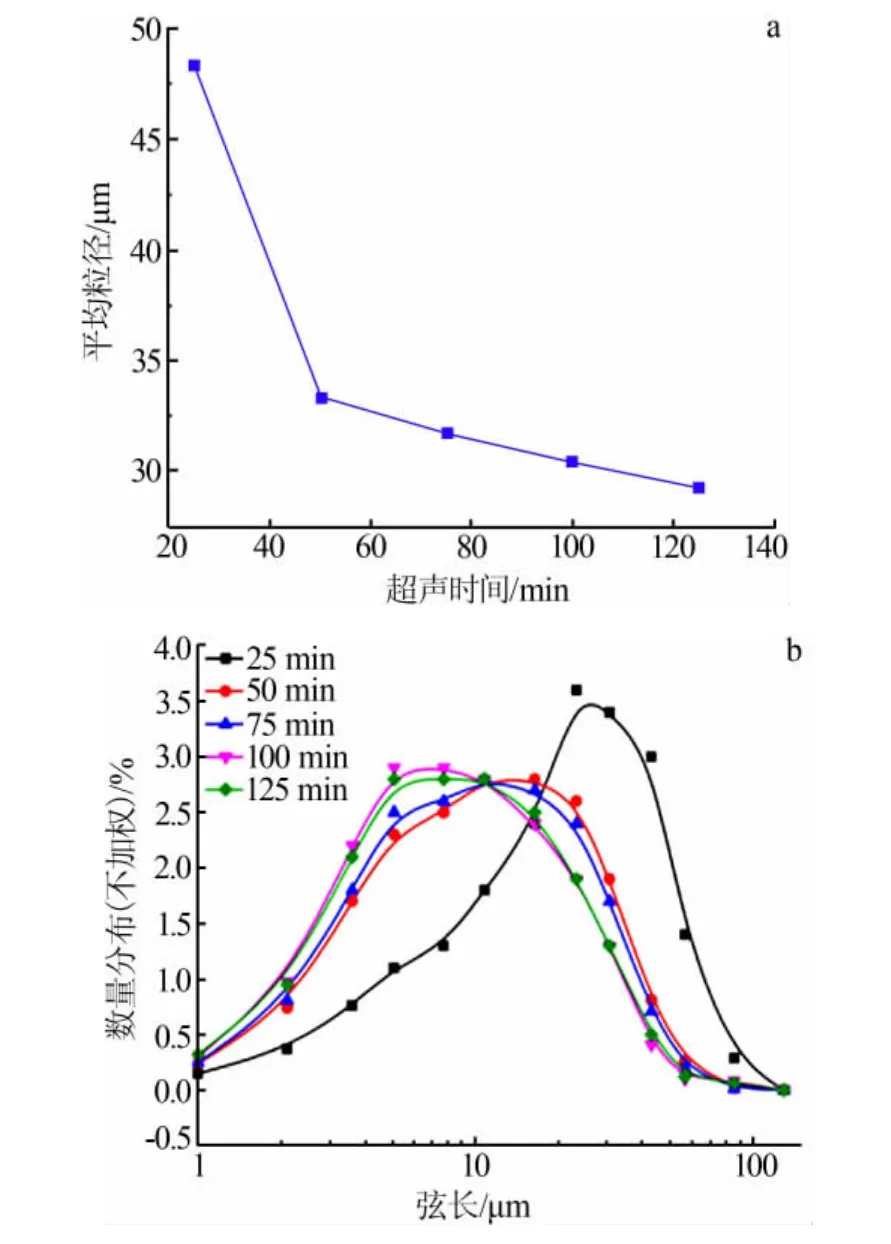
图8 超声时间对Li2CO3晶体平均粒径和粒度分布的影响
由图8可知,随着超声时间的延长平均粒径减小,超声时间在50 min以上时平均粒径减小的幅度较小。随着超声时间延长粒度分布曲线向左偏移,超声时间为100 min和125 min的粒度分布曲线基本重合,表明超声时间在100 min以上时粒度分布基本稳定。这是由于反应开始进行时,体系的过饱和度很高,容易爆发成核,再加上超声波诱导成核的作用,体系内会产生更多的晶核。当超声波存在的情况下这些晶核不会发生团聚,一旦超声停止这些细小的晶粒由于具有很高的表面能就很容易团聚在一起。因此超声时间较短时粒径大,随着超声时间的延长粒径逐渐减小。如图9a所示,超声时间为25 min时,可以看出晶体是由许多细小的晶粒团聚成的大团簇,这是由于超声存在的情况下体系中细晶的数量远大于未加超声的情况[13],而一旦超声停止,这些细小的晶粒必然会团聚在一起,最终形成比未加超声条件下更大的晶体。图9b中晶体还存在一定程度的团聚,相比图9a粒径明显减小。如图9c所示,超声时间为100 min时,最终晶体的粒径较小且不存在团聚。这是因为当反应进行到100 min时加料已经完成,晶体的整个生长过程基本是在超声存在的体系中完成的。综合考虑,选择100 min为适宜的超声时间。

图9 超声时间对Li2CO3晶体形貌影响的SEM图
2.5 最优条件下的卤水实验
在最优的实验条件下,即反应温度为60℃、超声功率为10 W、反应开始加入超声且持续时间为100 min,利用高锂卤水进行实验,所得实验结果与最优条件下LiCl试剂所得结果和行业标准YS/T582—2013《电池级碳酸锂》进行比较,结果见表2。由表2可以看出,两种原料生产的碳酸锂产品在纯度上均符合电池级碳酸锂的行业标准,粒度方面d10和d50均符合标准,d90略大于电池级碳酸锂的行业标准。与LiCl为原料相比,以高锂卤水为原料制备的碳酸锂纯度略低,粒度略微偏大,但总体相差不大。

表2 两种原料制备的碳酸锂与电池级碳酸锂行业标准的对比
3 结论
1)通过对Li2CO3反应结晶过程进行超声处理,有效地抑制了晶体团聚。2)反应温度较低时得到的是片状团聚体而温度较高时得到的是棒状团聚体;随着超声功率的增大,晶体粒径略微增大;此外超声时间和超声施加时刻的选择对最终的晶体形貌和平均粒径有显著影响。得出最适宜的反应条件为:反应温度为60℃、反应开始加入超声、功率为10 W、超声时间为100 min。3)LiCl和高锂卤水两种原料制备的碳酸锂产品纯度能达到电池级碳酸锂的行业标准;粒度方面,d10和d50均符合标准,d90略大于电池级碳酸锂的行业标准。
