成年火龙果植株茎段愈伤组织诱导、增殖及分化研究
2019-04-11邓仁菊范建新王永清金吉芬
邓仁菊,范建新,王永清,刘 涛,金吉芬
(1. 贵州省农业科学院 生物技术研究所,贵州 贵阳 550006;2. 贵州省农业科学院 亚热带作物研究所,贵州 贵阳 550006;3. 四川农业大学 园艺学院,四川 成都 611130;4. 贵州省农业科学院 果树科学研究所,贵州 贵阳 550006;5. 贵州省农业科学院 品种资源研究所,贵州 贵阳 550006)
【研究意义】火龙果,属仙人掌科三角柱属植物,原产于南美、北美及中美州热带地区,是集观赏、食用、保健等于一身的名优水果。目前主要生产国有越南、哥伦比亚、墨西哥、哥斯达尼加、尼加拉瓜、中国等,澳大利亚、以色列、美国有少量种植。火龙果大田生产主要采用15~20 cm茎段扦插繁殖或直接采用50 cm以上大苗定植[1-2],然而长期采用该方法容易导致体内感染多种病毒并不断累积,致其品种逐渐退化,严重影响产量和品质;另外,扦插繁殖或大苗定植需要原材料较多,繁殖速度相对较慢,自然变异率较低,对新品种的创制培育也相当不利。而植物组织培养作为一种高效的繁殖方法,可以在相对较小的空间和相对较短的时间,利用非常有限的资源获得大量健康的再生苗,且组织培养还能通过与生物技术等手段相结合进行新种质的培育和创制。【前人研究进展】目前,国内外已有关于火龙果茎段快速增殖、愈伤组织诱导等方面的报道[3-11]。但绝大数有关这方面的研究都是通过种子萌发幼苗、茎段等直接诱导成苗[3, 4, 6, 12-13]或进行植株再生培养研究[14],这样得到的无菌苗可能因种子基因型不同而存在较大差异。【本研究切入点】迄今,通过火龙果成熟茎段进行愈伤组织诱导、增殖及分化的相关报道较少。因此,笔者等以火龙果成年植株的茎段为试材,通过改进和优化培养条件,建立相对完善的火龙果再生体系。【拟解决的关键问题】为火龙果今后的生物技术育种及遗传转化研究提供参考和奠定基础。
1 材料与方法
1.1 试验材料
防止外植体污染及褐化的研究以贵州主栽火龙果品种紫红龙、晶红龙和粉红龙成年植株的枝条为试材;愈伤组织的诱导、增殖及分化研究以火龙果品种紫红龙成年植株的枝条为试材。
1.2 试验设计与方法
1.2.1 防止外植体污染及褐化研究 ①不同表面灭菌时间。采取紫红龙成年植株新萌发的幼嫩茎段和1年生成熟茎段,用少量洗洁精水将其表面脏物洗净后,流水冲洗1 h。于超净工作台上用75 %的酒精和0.1 %的升汞分别处理不同时间。幼嫩茎段酒精消毒时间设3个水平(10、20和30 s),升汞灭菌时间设4个水平(4、6、8和10 s);成熟茎段酒精消毒时间设定为30 s,升汞灭菌时间设7个水平(4、6、8、10、12、15和18 s)。消毒灭菌完成后,用无菌水冲洗5次,将外植体表面水分吸干,切成1cm×1 cm 左右的茎段,接种在相同的培养基MS+6-BA 2.0 mg/L+NAA 0.1 mg/L上,每处理接种180个外植体,30 d统计污染率、褐化率及成活率。②外植体不同成熟度的影响。取成年植株上不同成熟度(新梢0~5 cm、新梢5~10 cm、新梢10~20 cm和1年生成熟茎段)的火龙果茎段,用少量洗洁精水将其表面脏物洗净,流水冲洗1 h后,均采用75 %乙醇30 s+0.1 %升汞8min消毒,无菌水冲洗5次。外植体切割方法、接种培养基、统计方法均同本节1)。③外植体不同基因型的影响。以不同基因型的紫红龙、晶红龙和粉红龙成年植株上新萌发的幼嫩茎段和1年生成熟茎段为试材,用少量洗洁精水将其表面脏物洗净后,流水冲洗1h后。幼嫩茎段采用75 %乙醇30 s+0.1 %升汞6 min消毒,无菌水冲洗5次;成熟茎段采用75 %乙醇30 s+0.1 %升汞12 min消毒,无菌水冲洗5次。外植体切割方法、接种培养基、统计方法均同本节①。④ 不同取样时间。以紫红龙、晶红龙和粉红龙成年植株上新萌发的幼嫩茎段为试材,分别于3月15日、5月4日、7月9日、10月13日和12月10日取样。幼嫩茎段的消毒方式同本节3),外植体切割方法、接种培养基、统计方法同本节①。
1.2.2 愈伤组织的诱导、增殖及分化研究 (1)愈伤组织的诱导:①不同成熟度及取材部位对愈伤组织诱导的影响。取‘紫红龙’当年新萌发的长15~20 cm幼嫩枝条和1年生成熟枝条,分别按顶部、中部、基部切割成约1 cm×1 cm左右茎段,接种在MS+TDZ 0.4 mg/L+KT 0.8 mg/L的培养基上,每个取材部位接种60~120个外植体,观察并记录愈伤组织的诱导情况及愈伤组织的质量,30 d统计愈伤组织的诱导率。②不同生长调节剂浓度及配比对愈伤组织诱导的影响。以‘紫红龙’当年新萌发的长10~20 cm幼嫩茎段为试材,取中间部位将其切割成约1 cm×1 cm左右茎段,接种在MS附加不同浓度的6-BA (0.1、0.2和0.4 mg/L)和2, 4-D (0.25、0.5和1.0 mg/L),以及不同浓度的TDZ (0.2、0.4和0.8 mg/L)和KT (0.2、0.4和0.8 mg/L)的培养基上,完全组合设计,共18个处理,每处理接种60~120个外植体,观察并记录愈伤组织的诱导情况及愈伤组织的质量,30 d统计愈伤组织的诱导率。③不同生长调节剂浓度及配比对愈伤组织诱导的影响。以‘紫红龙’当年新萌发的长10~20 cm幼嫩茎段为试材,取中间部位将其切割成约1 cm×1 cm左右茎段,接种在MS附加不同浓度的6-BA (0.1、0.2和0.4 mg/L)和2, 4-D (0.25、0.5和1.0 mg/L),以及不同浓度的TDZ (0.2、0.4和0.8 mg/L)和KT (0.2、0.4和0.8 mg/L)的培养基上,完全组合设计,共18个处理,每处理接种60~120个外植体,观察并记录愈伤组织的诱导情况及愈伤组织的质量,30 d统计愈伤组织的诱导率。④不同基本培养基浓度对愈伤组织诱导的影响。以‘紫红龙’当年新萌发的长10~20 cm幼嫩枝条为试材,取其中间部位切割成约1 cm×1 cm左右茎段,接种在不同MS浓度 (MS、1/2MS、1/4MS和1/8MS)附加TDZ 0.4 mg/L+KT 0.8 mg/L的培养基上,试验共计4个处理,每处理接种60~120个外植体,观察并记录愈伤组织的诱导情况及愈伤组织的质量,30 d统计愈伤组织的诱导率。⑤糖类及浓度对愈伤组织诱导的影响。以‘紫红龙’当年新萌发的长10~20 cm幼嫩枝条为试材,取其中间部位切割成约1 cm×1 cm左右茎段,接种在以MS+TDZ 0.4 mg/L+KT 0.8 mg/L为基本培养基,分别添加不同浓度的蔗糖(15、30、45和60 g/L)和葡萄糖(15、30、45和60 g/L)。试验共8个处理,每处理接种60~120个外植体,观察并记录愈伤组织的诱导情况及愈伤组织的质量,30 d统计愈伤组织的诱导率。⑥不同培养条件对愈伤组织诱导的影响。以‘紫红龙’当年新萌发的长10~20 cm幼嫩枝条为试材,取中间部位将其切割成约1 cm×1 cm左右茎段,接种在MS+TDZ 0.4 mg/L+KT 0.8 mg/L的培养基上,分别置于黑暗条件下培养7、15和30 d及完全光照培养,共4个处理,每处理接种60~120个外植体,观察并记录愈伤组织的诱导情况及愈伤组织的质量,30 d统计愈伤组织的诱导率。
(2)愈伤组织的继代与增殖。将初代培养诱导出来的愈伤组织切割成约0.5 cm×0.5 cm大小,接种到含不同生长调节剂的增殖培养基中,设12个处理,每处理接种60块愈伤组织,30 d后转接1次。观察并记录愈伤组织的生长状态,60 d统计愈伤组织增殖系数。
(3)愈伤组织的分化。愈伤组织增殖2~3次后,将其切割成直径约1 cm的小块,分别转入含不同生长调节剂的芽苗分化培养基,试验釆用四因素四水平正交试验设计,因素及水平:TDZ(0.2、0.4、0.8和1.2 mg/L)、2, 4-D(0.5、1.0、1.5和2.0 mg/L)、NAA(0.1、0.2、0.4和0.6 mg/L)及椰子水(0、10 %、20 %和30 %),共16个处理。每处理接种60块愈伤组织。60 d后统计愈伤组织分化率。
1.3 数据处理与统计分析
褐化率(%)=(发生褐化的外植体数/接种的外植体数)×100;污染率(%)=(发生污染的外植体数/接种的外植体数)×100; 成活率(%)=(成活的外植体数/接种的外植体数)×100;愈伤组织诱导率(%)=(出愈外植体数/接种外植体数)×100;愈伤组织增殖系数=统计时愈伤组织的重量/接种时愈伤组织的重量;愈伤组织分化率(%)=(分化的愈伤组织块数/接种愈伤组织块数)×100。
所有数据均采用DPSv7.05进行统计分析,LSD法检验不同处理间的差异显著性。
2 结果与分析
2.1 防止外植体污染及褐化的研究
2.1.1 不同表面灭菌时间对外植体污染及褐化的影响 从表1看出,不同成熟度的枝条采用不同表面灭菌时间处理后,外植体在污染率、褐化率及成活率方面均表现出较大差异。不同处理中茎段的褐化率随消毒时间的延长而增加,而污染率则随消毒时间的增加而降低。同一处理下,成熟茎段的褐化率显著低于幼嫩茎段,而污染率则相反。适宜火龙果当年生幼嫩茎段的表面灭菌方式为75 %酒精消毒30 s+0.1 %HgCl2消毒6~8 min。适宜火龙果1年生成熟茎段的表面灭菌方式为75 %酒精消毒30 s+0.1 %HgCl2消毒12~15 min。
2.1.2 不同成熟度取样对火龙果外植体污染及褐化的影响 从表2可知,相同灭菌条件下,1年生火龙果成熟茎段的污染率显著高于新萌发的幼嫩茎段,而褐化率则刚好相反。在幼嫩茎段中,褐化率以0~5 cm新梢最高,5~10 cm次之,10~20 cm最低;3种取样类型的污染率之间无显著差异。

表1 不同表面灭菌时间火龙果茎段的污染、褐化及成活情况
续表1 Continued table 1
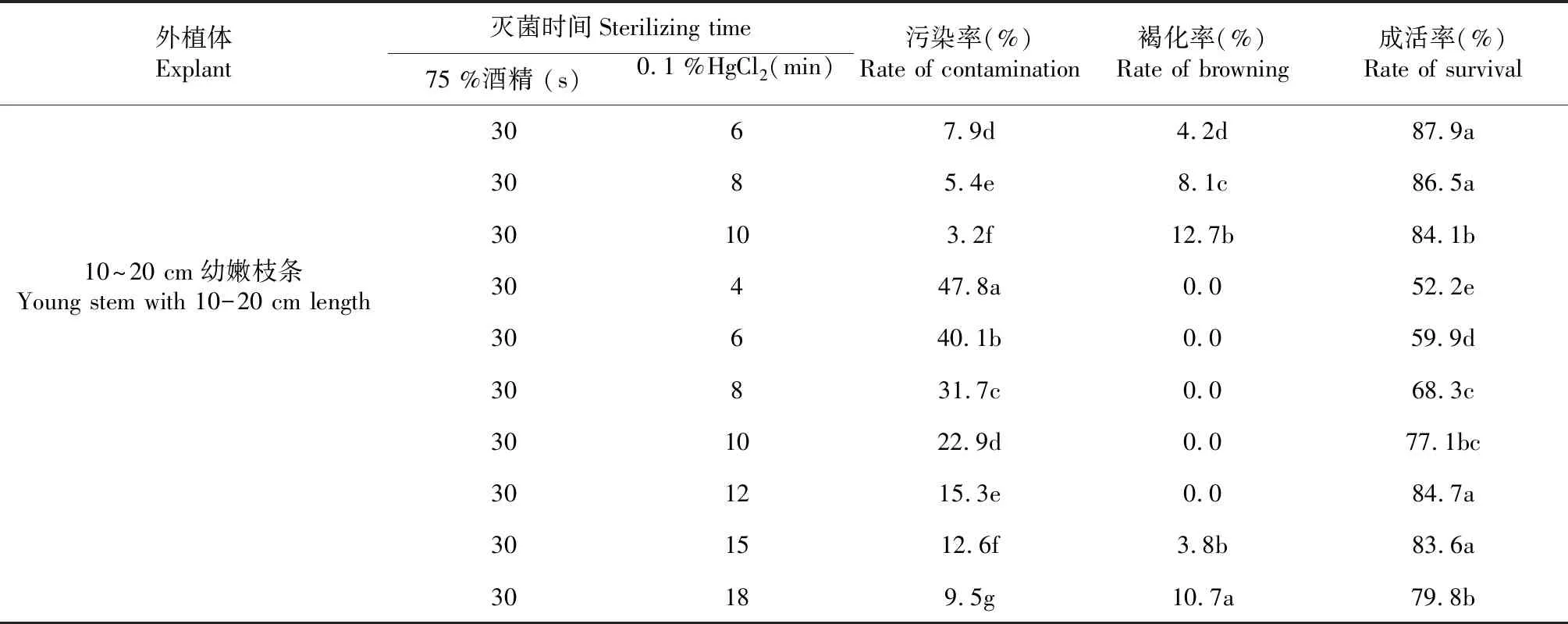
外植体Explant灭菌时间Sterilizing time75 %酒精 (s)0.1 %HgCl2 (min)污染率(%)Rate of contamination褐化率(%)Rate of browning成活率(%)Rate of survival3067.9d4.2d87.9a3085.4e8.1c86.5a30103.2f12.7b84.1b10~20 cm幼嫩枝条Young stem with 10-20 cm length30447.8a0.052.2e30640.1b0.059.9d30831.7c0.068.3c301022.9d0.077.1bc301215.3e0.084.7a301512.6f3.8b83.6a30189.5g10.7a79.8b
注:同列不同小写字母表示差异达显著水平(P<0.05),下同。
Note: Different lowercase letters in tha same column indicate significance of difference atP<0.05 level. The same as below.
2.1.3 不同基因型对外植体污染及褐化的影响 从表3看出,无论是幼嫩茎段还是成熟茎段,污染率均以紫红龙最高,其成活率最低;晶红龙和粉红龙间的污染率、褐化率及成活率差异均不明显。
2.1.4 不同取样时间对外植体褐化及污染的影响 从表4看出,外植体的污染及褐化受取样时间的影响较大。同等条件下,春季取样的外植体,其污染率极显著低于夏、秋、冬季;冬季取样的外植体,其污染率虽较秋季显著降低但仍明显高于春季;秋冬两季取样的外植体褐化率相对较高。总体而言,春季取材的外植体组培污染率相对较小,褐化率相对较低,进而有较高的成活率。
2.2 茎段愈伤组织的诱导
2.2.1 不同成熟度及取材部位对愈伤组织诱导的影响 从表5看出,紫红龙成熟茎段的不同部位愈伤组织的诱导率均较低,边缘周围产生少量愈伤组织,生长缓慢,在培养过程中易褐化死亡,说明成熟茎段不适宜作为诱导愈伤组织的外植体;采用当年萌发的新梢(长10~20 cm)作外植体出愈率较高,且以茎段中部诱导效果最好,产生的愈伤组织多,质量较好。

表2 不同成熟度取样火龙果外植体的污染、褐化及成活情况

表3 不同基因型火龙果外植体的褐化、污染及成活情况

表4 不同取样时间火龙果外植体污染、褐化及成活情况

表5 茎段不同成熟度及取材部位的愈伤组织诱导情况
2.2.2 不同生长调节剂及配比对愈伤组织诱导的影响 从表6看出,两两不同生长调节剂组合及浓度配比对火龙果茎段愈伤组织的诱导存在较大差异。当2, 4-D浓度一定时,以1.0 mg/L的6-BA愈伤诱导率最高;当6-BA浓度一定时,愈伤组织的诱导率则随2, 4-D浓度的增加而增加。另外,当TDZ浓度一定时,愈伤组织的诱导率随KT浓度的增加有所增加。当KT浓度一定时,愈伤组织的诱导率随TDZ浓度的增加呈先增加后降低趋势。总体而言,茎段愈伤组织的诱导率生长调节剂TDZ+KT组合明显高于6-BA+2, 4-D组合。当TDZ浓度为0.4 mg/L,KT浓度为0.8 mg/L时,外植体的愈伤诱导率最高,为81.1 %;愈伤组织为黄绿色、致密状,外表有颗粒状突起。
2.2.3 不同基本培养基浓度对愈伤组织诱导的影响 从表7看出,在生长调节剂相同的情况下,4种不同的培养基浓度对愈伤诱导的影响差异明显,以MS培养基愈伤诱导率最高,愈伤组织质量较好,呈淡绿色,致密、颗粒状,长势较好。
2.2.4 糖类及浓度对愈伤组织诱导的影响 从表8看出,同种糖类不同浓度诱导愈伤组织差异明显,诱导率随糖浓度的增加呈先升高后降低趋势。同一浓度下,添加葡萄糖的培养基较添加蔗糖的培养基能诱导出更多的愈伤组织。从表中还可以看出,无论是蔗糖还是葡萄糖,当其浓度在45 g/L及以上时,愈伤组织的诱导率呈下降趋势;而当浓度为30 g/L时,愈伤组织的诱导率最高,愈伤组织的质量也较好。

表6 不同生长调节剂浓度及配比下茎段愈伤组织的诱导情况
续表6 Continued table 6
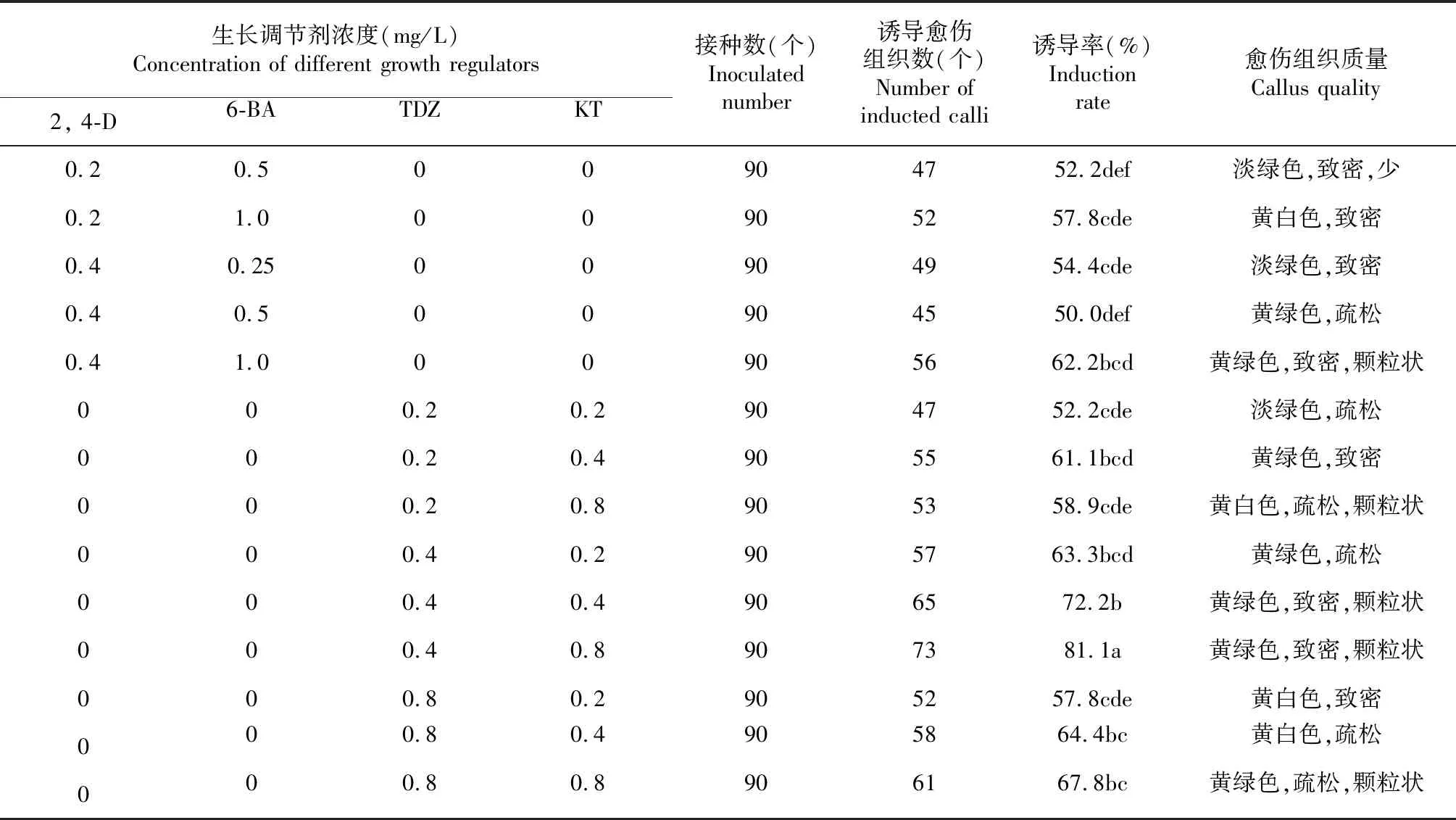
生长调节剂浓度(mg/L) Concentration of different growth regulators2, 4-D6-BATDZKT接种数(个)Inoculated number诱导愈伤组织数(个)Number of inducted calli诱导率(%)Induction rate愈伤组织质量Callus quality0.20.500904752.2def淡绿色,致密,少0.21.000905257.8cde黄白色,致密0.40.2500904954.4cde淡绿色,致密0.40.500904550.0def黄绿色,疏松0.41.000905662.2bcd黄绿色,致密,颗粒状000.20.2904752.2cde淡绿色,疏松000.20.4905561.1bcd黄绿色,致密000.20.8905358.9cde黄白色,疏松,颗粒状000.40.2905763.3bcd黄绿色,疏松000.40.4906572.2b黄绿色,致密,颗粒状000.40.8907381.1a黄绿色,致密,颗粒状000.80.2905257.8cde黄白色,致密000.80.4905864.4bc黄白色,疏松000.80.8906167.8bc黄绿色,疏松,颗粒状
2.2.5 培养条件对愈伤组织诱导的影响 从表9看出,不同处理下茎段出愈的时间和诱导率均存在较大差异。整个过程完全采用光照培养,出愈的时间最早,愈伤诱导率为75.6 %;暗培养时间越长,出愈时间越推迟,愈伤诱导率也越低。综合比较,经7 d暗培养再转至光照培养的外植体,其愈伤组织诱导率最高,形态、质地也较好。

表7 不同基本培养基浓度下火龙果愈伤组织的诱导情况

表8 糖类及浓度对茎段愈伤组织的诱导情况
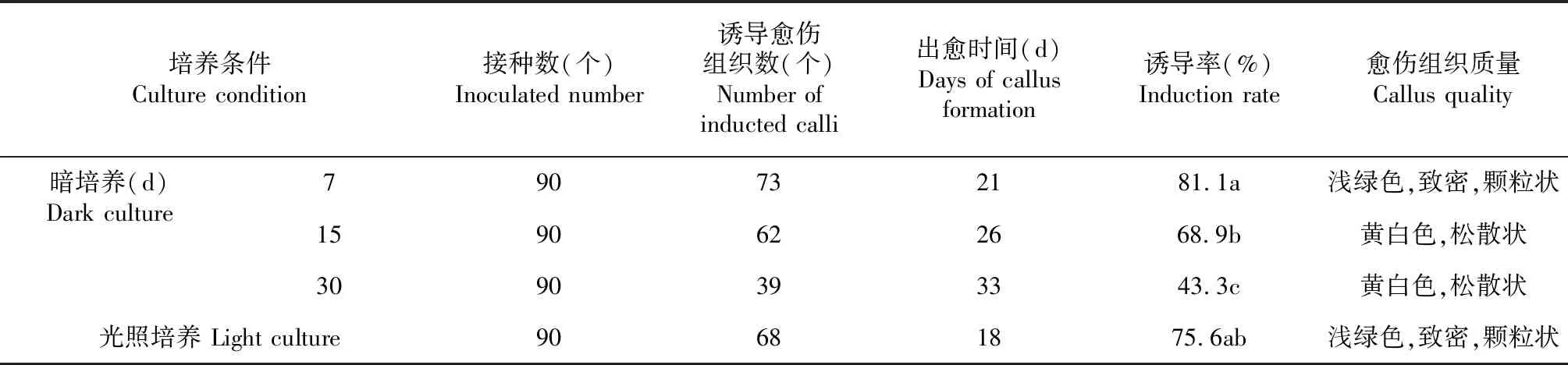
表9 不同培养条件下茎段愈伤组织的诱导情况
2.3 愈伤组织的增殖
从表10看出,TDZ 浓度不变的情况下,在MS培养中分别添加 0.8 mg/L KT或 0.8 mg/L ZT,其愈伤组织增殖系数都较高,分别为8.815和8.769倍,愈伤组织生长良好。其次为1/2MS培养基上只添加ZT 0.8 mg/L,其增殖系数为7.049。在1/8MS培养基上添加KT 1.0 mg/L+6-BA 1.0 mg/L,愈伤组织的增殖系数最低,为1.572,且愈伤组织长势较差。
2.4 愈伤组织的分化情况
从表11看出,以成年火龙果植株上的茎段为外植体,诱导愈伤组织后再进行分化比较困难,不定芽的分化率较低。各处理中,愈伤组织最高分化率仅为13.3 %,最低分化率为0。当TDZ浓度为0.4 mg/L,2,4-D浓度为0.5~1.0 mg/L,NAA浓度为0.4~0.6 mg/L时,加入20 %~30 %椰子水对愈伤的分化具有一定促进作用(图1)。
3 讨 论
3.1 防止外植体污染及褐化的研究
火龙果属攀援性肉茎植株,叶片退化成刺,因此与其他植物相比,消毒方式存在一定差异。本研究以成年植株的火龙果茎段为试材,发现茎段的成熟度、消毒方式、取样时间、是否带刺座及不同品种的火龙果枝条对外植体的褐化、污染及成活情况均有影响,这与前人研究存在相似之处。如周传明等[15]研究发现,采用0.1 %的升汞对火龙果茎段进行表面消毒15 min,组培过程中污染率较少,但褐化率较严重,这可能由于消毒时间太长导致茎段组织细胞被毒害,出现组织褐变坏死,部分组织甚至变成暗黑色。彭绿春等[10]对是否带刺座和绒毛的2种外植体类型进行研究表明,同一灭菌消毒方式下,茎段污染率以带有刺座和绒毛的明显高于不带刺座和绒毛的,且污染主要出现在刺座处,这可能由于火龙果刺座一般都木栓化,消毒剂不容易从刺座处渗入,造成灭菌不彻底。不同品种相同处理下,以紫红龙茎段的污染率最高,晶红龙和粉红龙之间无显著差异,这可能由于后两者较前者而言,枝条宽大肥厚,且形成木栓化的棱边对各种菌的浸染有一定保护作用所致。另外,研究还发现,以春季萌发的枝条作外植体,其污染率显著低于夏、秋、冬季,这可能由于新生枝条本身带菌较少,而后期生长过程中由于长期暴露在空气中容易感染各种病菌。

表10 不同基本培养基及生长调节剂浓度配比下火龙果愈伤组织的增殖情况
注:“+”、 “++” 和“+++”分别表示愈伤组织生长较差、一般和良好。
Note: +,++ and +++ represent poor growth, common growth and good growth respectively.
表11不同生长调节剂浓度及配比和椰子水浓度与火龙果愈伤组织分化
Table 11 Differentiation ofHylocereusundatuscalli cultured on different media with different concentration and ratio of different growth regulators and different concentration of coconut water

TDZ(mg/L)2, 4-D(mg/L)NAA(mg/L)椰子水(%)Coconut water愈伤组织分化率(%)Callus differentiation rate不定芽数(个)Number of adventitious buds不定芽长势Growth vigor of adventitious buds0.20.50.1000-0.21.00.2106.72.3++0.21.50.4208.33.5+++0.22.00.6303.31.2+0.40.50.63013.33.7+++0.41.00.42012.42.8+++0.41.50.1108.32.2++0.42.00.205.02.4+0.80.50.61000-0.81.00.401.72.1+0.81.50.23000-0.82.00.1205.01.9++1.20.50.2203.32.5++1.21.00.1306.71.6+++1.21.50.6000-1.22.00.41000-
注:表中“+”为不定芽生长较差,“++”为不定芽生长一般,“+++”为不定芽生长较好。
Note: +,++ and +++ represent poor growth,common growth and good growth, respectively.

图1 火龙果愈伤组织的分化情况Fig.1 Differentiation of Hylocereus undatus calli
3.2 成熟茎段再生体系建立与优化研究
建立完善的再生体系是植物进行育种改良的前提和基础。而前人对火龙果再生体系建立的研究多以种子作为外植体,并以此萌发的幼苗、胚或子叶进行愈伤组织诱导、增殖及分化[12, 16-17]。尽管火龙果种子的发芽率较高,但以此扩繁进行商业用途是不可行的,这是因为用种子获得的实生苗有一个较长的童期,不利于火龙果提早结果。此外,因火龙果种子数量较大,以此获得的器官组织可能存在基因型千差万别,离体培养产生的后代性状并不能与母本保持一致水平。另外,采用火龙果成熟茎段作外植体的相关报道也较多,但大多数研究是直接利用茎段进行不定芽诱导和快速增殖[4, 8, 10, 15, 18],少有利用成熟茎段作外植体进行愈伤组织诱导和分化的相关报道[3, 6]。本研究以贵州主栽品种紫红龙枝条作外植体,虽已成功建立起再生体系,但总体来讲,以火龙果成年植株的茎段作外植体,诱导出愈伤组织后进行再分化比较困难,最高分化率仅为13.3 %,因此下一步针对分化难的问题需要作进一步探讨和优化。
4 结 论
利用成年火龙果植株茎段进行愈伤组织诱导、增殖及分化的研究表明,适宜幼嫩茎段表面灭菌的方式为75 %的酒精消毒30 s+0.1 %的HgCl2消毒6~8 min;适宜成熟茎段表面灭菌的方式为75 %的酒精消毒30 s+0.1 %的HgCl2消毒12~15 min。诱导愈伤组织以春季萌发的长10~20 cm枝条中部茎段效果较好,最适愈伤组织诱导的培养基为MS+TDZ 0.4 mg/L+KT 0.8 mg/L,暗培养7 d,再转入光照培养,愈伤组织为黄绿色、致密状,外表有颗粒状突起。愈伤组织增殖培养基以MS+TDZ 0.4 mg/L+KT(或ZT) 0.8 mg/L效果较好,增殖系数在8倍以上。在愈伤组织分化过程中,添加20 %~30 %的椰子水对不定芽的形成具有一定促进作用,但总体分化率仍然较低。
