哺乳期小鼠人工喂养初探*
2019-04-10程如越
程如越 何 方 石 磊 李 鸣
(1. 四川大学华西公共卫生学院,成都 610041)(2. 四川大学华西医院临床营养科,成都 610041)
新生动物的人工喂养是研究生命早期营养调控、生长发育的重要前提[1]。大,小鼠是实验动物中常用的重要的品种,成功的大小鼠人工喂养模型是营养、代谢、免疫等研究领域的重要基础。在Reyniers等首次建立了无菌大鼠后[1],Gustafsson、Pleasants等也建立了无菌大鼠[2-3]。Messer等在1969年首次采用在大鼠胃中安置胃管的方法进行人工喂养[4],而Hall在1975年改进了这一方法,并成功建立了大鼠人工喂养的模型[5]。
相比之下,关于小鼠的人工喂养则起步较晚。近年来学者开始研究小鼠的人工喂养。West、Beierie等采用自制的喂养乳头实现了哺乳期内小鼠的人工喂养[6-7]。Zeng等参考Hall的大鼠胃造瘘的方法在新生小鼠胃中安置胃管,并喂养至14日龄[8]。尽管已有学者报道了哺乳期小鼠的人工喂养方法以及人工乳的配制,但由于新生小鼠的食管细小脆弱,哺乳工具难以制得,人工乳配方不适合等使得哺乳期小鼠的人工喂养方法仍需改进。为此,本研究的目的是通过总结前人的经验并进一步探索哺乳期小鼠人工喂养的方法,以期为后续的研究提供方法与思路。
1 材料与方法
1.1 材料
实验动物及饲养:5只SPF级近交系BALB/c孕鼠,孕龄10~12 d,购自四川省成都市达硕实验动物有限公司[许可证号:SCKY(川)2015-030]。BALB/c孕鼠均饲养于四川大学华西公共卫生学院实验动物中心[实验动物使用许可证号:SYXK(川)2013-011]IVC塑料笼中待产,由于孕鼠的营养需要较普通鼠高,故给予繁殖饲料[9],自由摄食与饮水。环境温度:(24±1)℃,湿度:(55±10)%。
BALB/c孕鼠自然分娩所得新生小鼠,待其3日龄时,随机分为母乳喂养组(maternal rearing,MR)和人工喂养组(artificial rearing,AR)。MR组小鼠由母鼠带仔,饲养环境同母鼠。AR组小鼠由人工饲养,给予人工乳,环境温度:(32±1)℃,随日龄增加每天降低1 ℃,直至26~28 ℃;湿度:70%~80%,随着日龄增加逐渐降低至50%。
1.2 实验方法
1.2.1人工乳的配制:人工乳的配制参考了BALB/c鼠乳,Smart等、Yajima等采用的人工乳配方[10-11],由市售婴儿配方奶粉、乳清蛋白粉和中链甘油三酯(medium chain triglyceride,MCT)粉配制而成(见表1)。
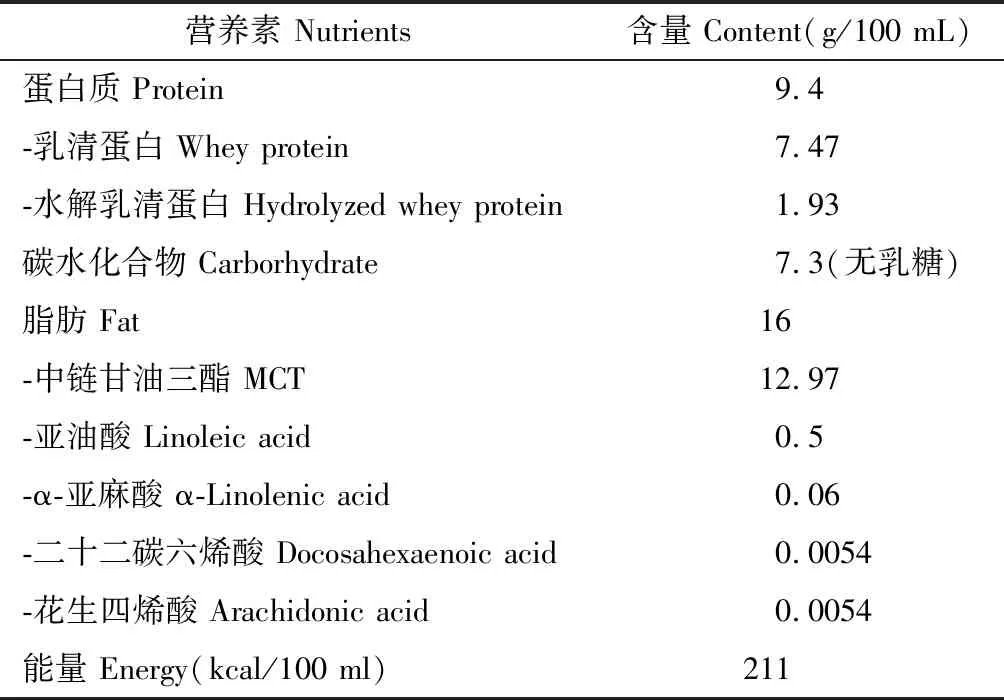
表1 小鼠人工乳组成及营养水平Table 1 Composition and nutrient levels of basal diets
1.2.2人工乳头的制作: 人工乳头以市售鱼肝油胶囊的外壳为原材料改造而成。该外壳遇水即变软,可保护小鼠口腔。制作方法:首先将外壳尖端剪开一小口,挤出鱼肝油;然后将1 mL注射器的针筒与灌胃针相接,吸取30~40 ℃保温的人工乳,灌入胶囊外壳。这样便制成了一个简易的人工乳头。经试验,一个外壳可装0.3 mL的人工乳。
1.2.3喂养方案:5只孕鼠共分娩27只小鼠,将3日龄的所有小鼠随机分为MR组13只和AR组14只(见表2)。MR组由各自的母鼠哺乳,不做其他干预。AR组采用自制的人工乳和人工乳头哺乳,一天4次,分别于09:00,12:00,14:00,16:00时喂养。每天一只小鼠总的哺乳量为体质量的20%,根据实际情况调整。哺乳过程是先挤一滴乳汁滴在小鼠嘴唇上,诱导其张口,后将外壳尖端送入小鼠口中,随吞咽动作轻轻挤压乳头底部,使小鼠吸吮乳汁并吞咽入胃。从3日龄开始每日称体质量并记录至10日龄,在14日龄时终止研究,在观察小鼠精神状态、体质量、生长发育、活动能力、排便、毛色等情况后,解剖受试小鼠,观察小鼠脏器的发育情况。
1.3 统计学方法
实验数据采用均值±标准差表示,并采用统计软件SPSS 19.0分析。两组间比较采用Student’s-t检验;多组间比较采用方差分析,两两比较采用Dunnett-t检验。均为双侧概率检验,P<0.05为差异有统计学意义。

表2 实验分组Table 2 Pups grouped into AR and MR
注:小鼠编号指在喂养时的编号(1-1表示孕鼠1号分娩的1号小鼠)
Note:The lactating mice No. refers to the No. at the time of rearing (1-1 indicates the pup No.1 delivered to the mother No.1).
2 结果
2.1 AR组小鼠的生存率
本实验采用自制的喂养乳头和小鼠人工乳实现了哺乳期BALB/c小鼠的人工喂养。本实验共喂养14只3日龄小鼠,5只小鼠成功喂养至14日龄。AR组小鼠从3日龄到10日龄,生存率达100%,11日龄生存率为92.9%,12日龄为78.6%,13日龄为50%,14日龄为35.7%。3~14日龄哺乳期内MR组小鼠全部存活。
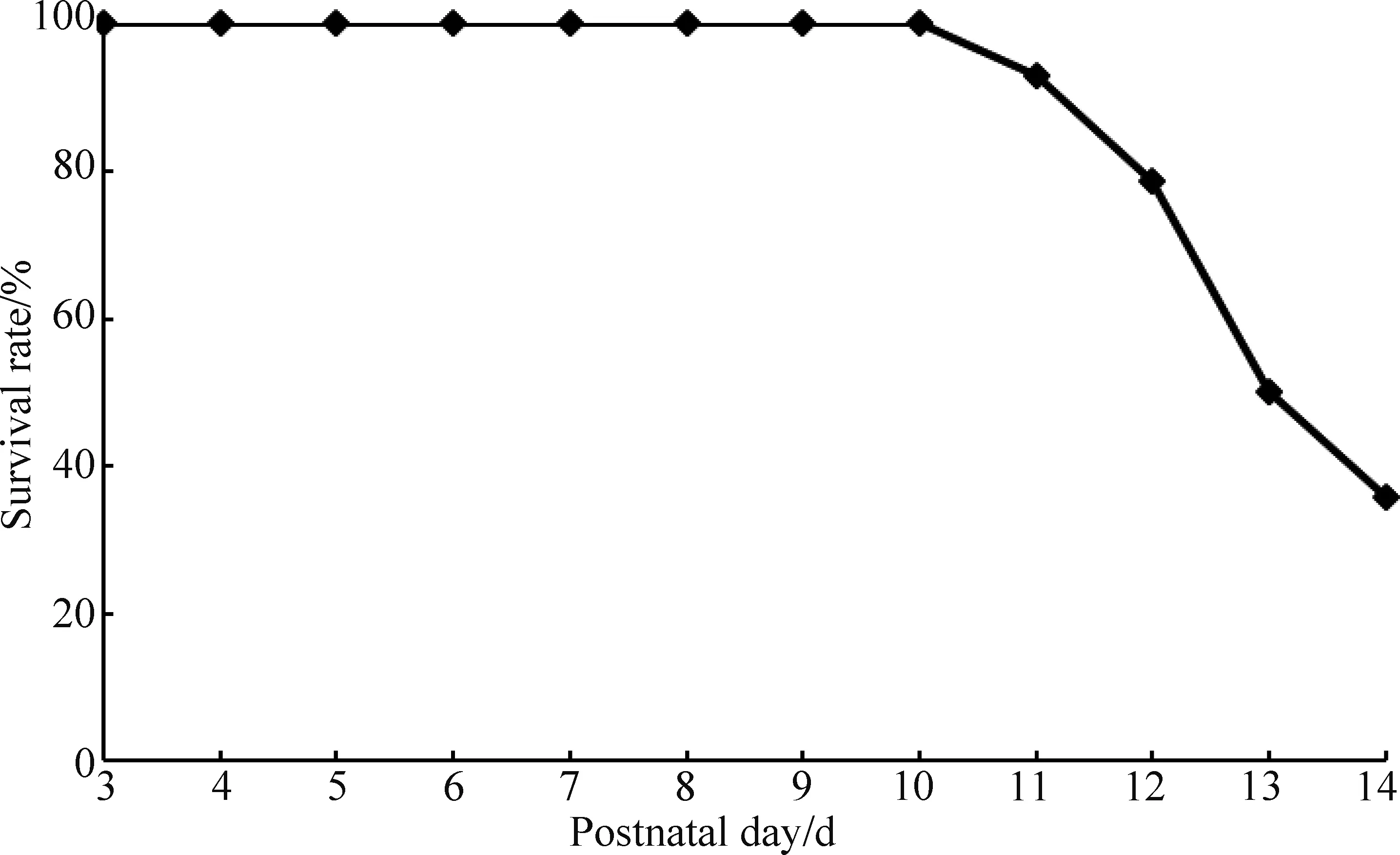
图1 3~14日龄内AR组小鼠的生存率曲线Fig.1 Survival rate curves of 3 to 14 days of AR mice
2.2 喂养期间内两组小鼠体质量及其他指标的变化
AR组和MR组小鼠在开始人工喂养时体质量无明显差异(3.89±0.87 vs 3.26±0.32,AR vs MR;P>0.05)。4日龄时,AR组体质量低于MR组(3.74±0.83 vs 4.39±0.42,AR vs MR;P<0.05)。到10日龄时,AR组体质量仍低于MR组(3.02±0.67 vs 9.00±0.70,AR vs MR;P<0.01)。AR组喂养期间内体质量未增长,呈缓慢下降趋势,而MR组喂养期间内体质量持续增长。
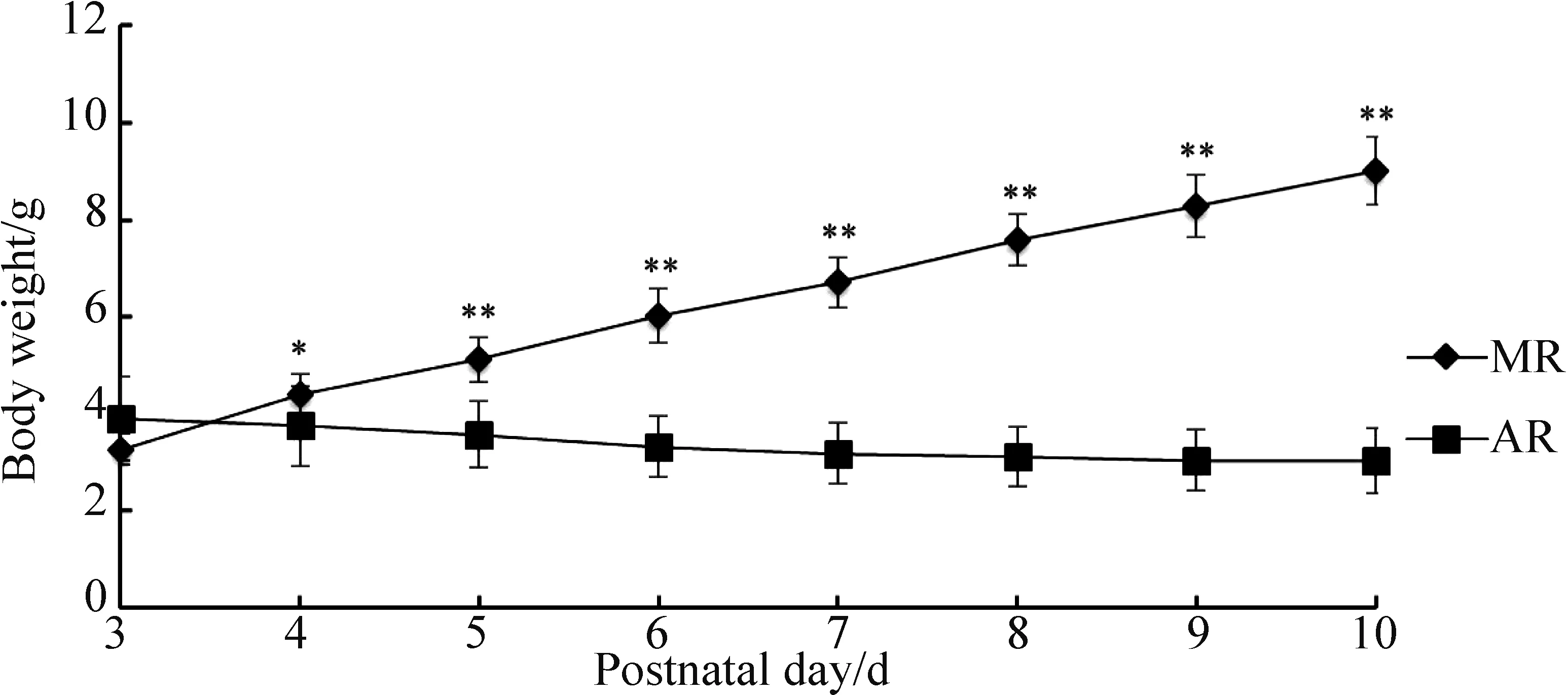
图2 MR组和AR组小鼠3~10日龄内的生长曲线注:*P<0.05;**P<0.01Fig.2 The growth curves of the mice in the MR and AR groups during 3 to 10 daysNote:*P<0.05;**P<0.01
除体质量外,AR组和MR组在长须、立耳、长牙、被毛、睁眼的日龄基本一致,但AR组睁眼的小鼠只有2~3只,MR组全部睁眼(见表3)。另外,AR组小鼠的精神状态、活动能力与MR组相比均较差;粪便较黏稠(见图3),但无腹泻、便秘等胃肠道不适症状;解剖死亡小鼠发现胃肠道有明显胀气,并充满整个腹部(见图4);但毛色均为白色,系正常发育。
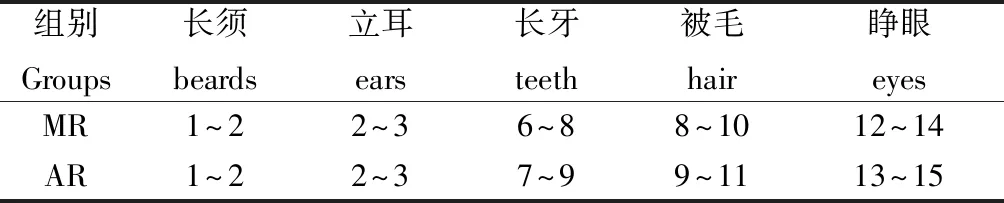
表3 MR组和AR组小鼠生长发育等情况(天)Table 3 Growth and development of AR and MR mice(d)
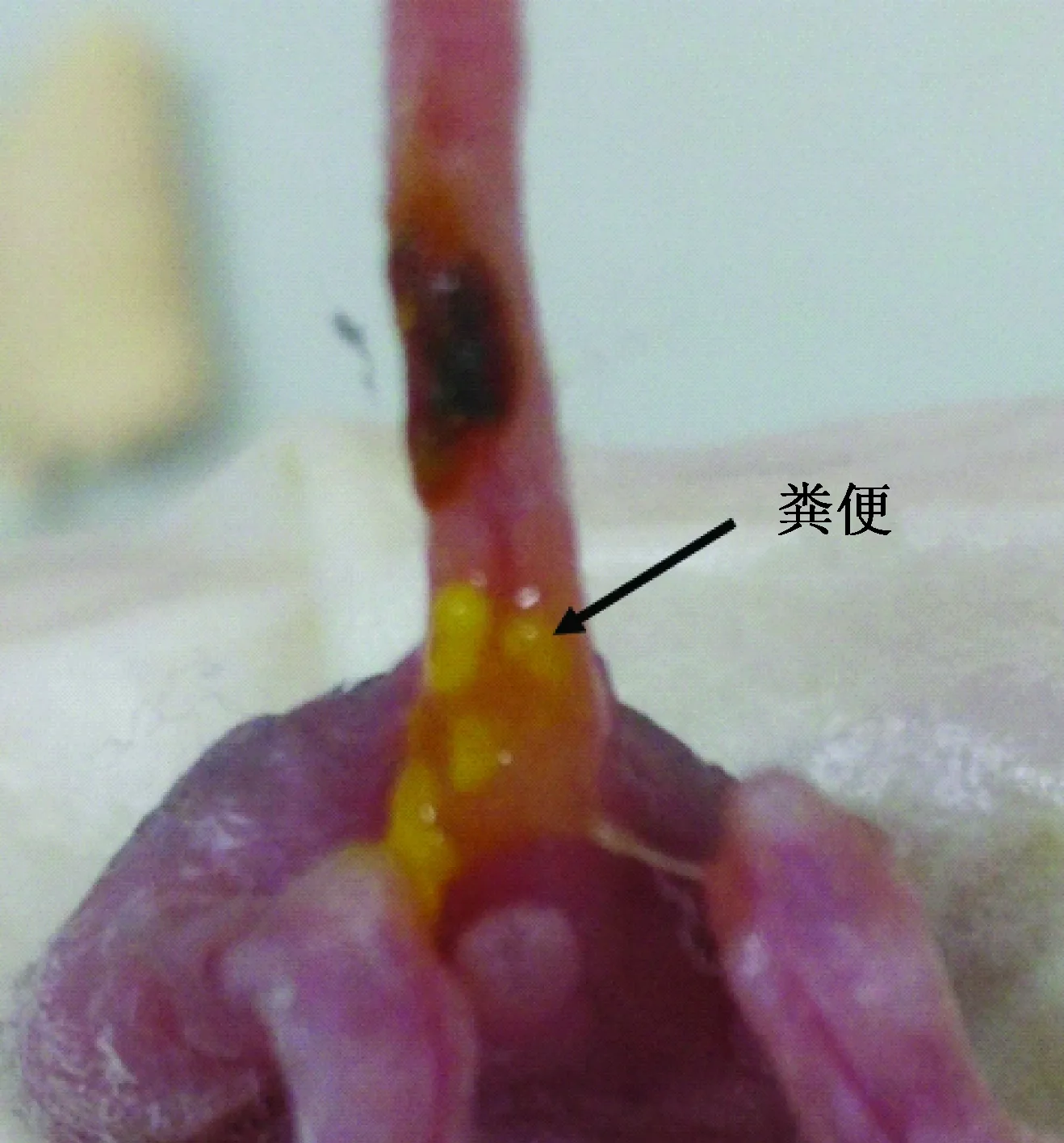
图3 AR组小鼠粪便情况Fig.3 Fecal condition of mice in AR group
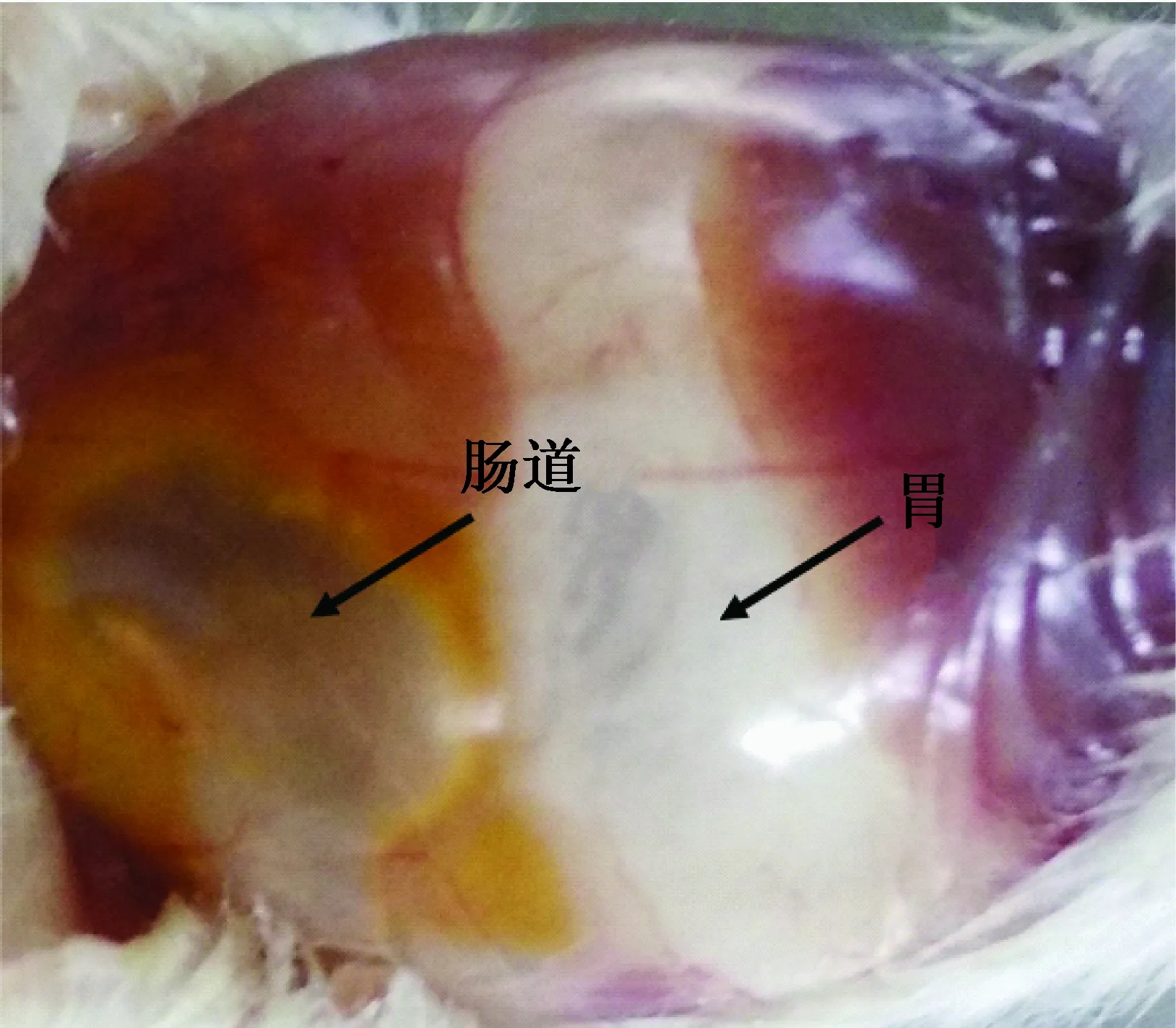
图4 AR组小鼠胃肠道胀气Fig.4 Gastrointestinal flatulence of mice in AR group
3 讨论
正常生长发育的小鼠,21日龄左右断乳。睁眼后,即13~14日龄,可开始进食固体饲料,后哺乳量逐渐下降,直至完全断乳。哺乳期小鼠生长发育迅速,对营养要求较高,营养不良会影响体格、智能发育以及导致各种疾病的发生。本实验的目的是探索14日龄小鼠的人工喂养方法。本次实验通过采用自制的人工乳和人工乳头喂养14只自然分娩后3日龄的新生小鼠,到14日龄时存活5只,存活率为35.7%,在一定程度上实现了哺乳期小鼠的人工喂养,为今后的研究打下了良好的基础并取得了珍贵的经验。
本次实验主要观察了哺乳期小鼠的生存率和体质量。生存率是评价小鼠在哺乳期内生存状况的重要指标,而体质量是衡量生长发育和营养状况的主要指标。本次实验中,小鼠从10日龄后生存率逐渐下降,到14日龄时为35.7%,与多数报道差距较大。最终存活至14日龄的5只小鼠中,3日龄时体质量均大于4 g;而在14日龄前死亡的9只小鼠中,其中8只3日龄时的体质量小于4 g。由此我们推测开始AR时的小鼠体质量可能影响AR组小鼠在喂养期间的生存率。Hoshiba也提到出生体质量越大的小鼠越易喂养[12]。而4~10日龄内AR组小鼠体质量不增反减,低于MR组,差异有统计学意义。体质量的降低是生存率下降的重要因素。
我们推测本次实验中AR组小鼠人工乳营养组分不合理及哺乳量不足可能是导致其体质量降低,生存率下降的主要原因。本实验的人工乳是根据Yajima等的小鼠人工乳配方改进而来。Hussein等采用Yajima的配方实现了小鼠的人工喂养[13]。同时该配方能量及三大营养素的含量及供能比与BALB/c鼠乳接近。本次实验AR组小鼠在喂养期间内未出现腹泻、便秘、恶心、呕吐等胃肠道不适症状,但有明显的胃肠道胀气。涂新明等提到人工乳中的酪蛋白是必需的,可使人工乳到胃中并凝固,如果不含酪蛋白,人工乳到胃中后,很快排到肠道, 充满肠管,导致消化不良[14]。Yajima等也提出人工乳中酪蛋白和乳清蛋白的比例与大鼠肠道发育有关,坚硬的酪蛋白乳凝块可能是肠道黏膜肥大的重要因素[15]。Kanno等提到如果小鼠奶中的酪蛋白和乳清蛋白比例为6∶4时,其胃内乳凝块比较柔软,形态和质地与母乳类似[16]。此次实验中自制的人工乳不含酪蛋白,推测这可能与小鼠胃肠道胀气有关。关于哺乳量的不足,主要由喂养方法与喂养频率所决定。喂养方法包括强饲法和吸吮法,两种方法均能成功哺育小鼠。本次实验采用的是吸吮法,即靠小鼠自己吸吮,而非强饲法。许多学者认为吸吮法给小鼠喂的人工乳太少而不提倡该法。涂新明等、易萍还提出吸吮法耗时长,小鼠可因吸入空气造成胃肠道胀气和呛咳,而采用了灌胃强饲法[14,17]。王建国、仉慧敏则认为灌胃强饲法容易损伤小鼠食道上皮,甚至插破胃管致死,所以需要较高的技术经验。而吮吸是小鼠的本能反应,刚出生就会吮吸,只要耐心细致地调节人工乳的黏稠度、流速、饲喂姿势、小鼠的自身状态等便可达到每日的哺乳量[18-19]。Hoshiba采用自制的人工乳头和吸吮法,使1日龄的ICR小鼠成功喂养至14日龄,生存率达86.7%。Yasuda等也采用经Hoshiba自制的人工乳头改造而来的喂养装置进行人工喂养,使3日龄的小鼠全部存活至14日龄[20]。本次实验中由于实验条件的限制,未能在夜间哺乳。两次喂养的时间间隔较短,往往是上一次喂养的人工乳还没消化完就要进行下一次的哺乳。小鼠没有足够的时间对人工乳进行消化,易导致腹胀及喂养量的下降,这样便形成了恶性循环,难以达到小鼠每日的计划哺乳量,导致体质量下降,生长发育迟缓,生存率降低。
本实验采用自制的喂养乳头和小鼠人工乳实现了哺乳期BALB/c小鼠的人工喂养,35.7%的人工喂养小鼠成功地存活至目标的14日龄。但哺乳期内AR组小鼠体质量低于MR组,其主要原因可能是人工乳营养水平不合理及哺乳量不足。故如何提高哺乳期内人工喂养小鼠的生存率及增加体质量还需进一步探索。
