六种核酸提取试剂盒对粪样中小鼠肝炎病毒核酸 提取效率的比较*
2019-04-10杨伟伟俞利平戴方伟杜江涛宋晓明
桂 飞 杨伟伟 俞利平 戴方伟 杜江涛 宋晓明
(1. 杭州师范大学实验动物中心, 杭州 310036)(2. 浙江省医学科学院实验动物中心, 杭州 310013)
小鼠肝炎病毒(murine hepatitis virus, MHV)属于冠状病毒科、冠状病毒属,基因组为线性不分段的单股正链RNA[1]。MHV感染是一种严重危害小鼠生产的病毒性传染病,不仅严重影响实验动物的质量,还对科学研究结果造成潜在的干扰,影响实验的准确性和重复性。正常情况下呈隐性感染,应激激发时会诱发致死性病变,是一种广泛传播且顽固的病原,也是国标GB 14922.2《实验动物微生物等级及检测》[2]中所需排除的病原之一。近年来,随着遗传工程小鼠制备技术的迅速发展,携带MHV的遗传工程小鼠在不同实验动物设施间被广泛交流和传播,且难于被发现和有效控制,MHV已是遗传工程小鼠微生物控制中最难于生物净化的病原之一[3],因此,快速准确地检测MHV是有效防制该病的前提,加强对MHV诊断的研究对提高实验动物质量具有重要意义。
MHV的诊断方法有病毒分离与鉴定、血清学试验、组织病理学诊断和分子生物学诊断等,实时荧光定量PCR检测技术[4-5]即为其中一种。该技术具有特异性强、灵敏度高、稳定性好等优点,但影响其检测效果的因素有很多,除引物序列、反应体系、扩增条件等,病毒RNA的提取效率也十分关键。本研究针对市售的6种病毒RNA提取试剂盒开展提取效率、操作简便性及重复性等比较,探索更有效的粪便病毒核酸提取方法,为提高MHV的分子生物学检测准确性提供基础。
1 材料与方法
1.1 材料
1.1.1实验动物: 14只6~8周龄C57BL/6小鼠,由杭州师范大学实验动物中心提供,生产许可证:SCXK(浙)2016-0004,经PCR鉴定为MHV阳性。小鼠饲养在隔离器中,每笼饲养1只,使用许可证:SYXK(浙)2016-0006,自由采食和饮水。
1.1.2试剂: TIANamp RNA Kit for Virus Detection(TIANGEN SD101)、DNA/RNA Isolation Kit(TIANGEN DP422)核酸提取试剂盒以及Fast Quant RT Kit(With gDNase)(TIANGEN KR106)反转录试剂盒购自天根生化科技有限公司;QIAamp Viral RNA Mini Kit(QIAGEN 52904)购自QIAGEN公司;Power Microbiomewer MicrobioNA Mini(MO BIO 26000)购自深圳安必胜生物技术有限公司;MagMAX必胜生物技术有限公司;Mini Kit Detection 酸提取方法(ABI AM1840)以及TaqMan© Gene Expression Master Mix(ABI 4369016)购自ABI公司;小鼠肝炎病毒实时荧光定量PCR检测试剂盒(XS VRL)购自苏州西山生物技术有限公司;Gel Extraction Kit(D2500-01)胶回收试剂盒购自OMEGA公司。
1.1.3主要仪器与设备: 水平电泳仪(Tanon)、微量紫外分光光度计(Thermo Nanodrop 2000)、凝胶成像处理系统Gel Image System(Tanon)、普通PCR扩增仪(Bio-RAD)、实时荧光PCR仪(ABI One step plus)、生物安全柜(Thermo)、全自动样品快速研磨仪(上海净信实验发展有限公司)。
1.2 方法
1.2.1引物与探针的设计: 从NCBI的FTP中下载两株MHV基因组序列,分析比对结果,发现基因28879-29145 Murine hepatitis virus strain JHM,29142-29828 Murine hepatitis virus strain JHM, 29843-31210 Murine hepatitis virus strain JHM有非常好的种内特异和种间的差异性。选择了此3个基因作为候选基因,用Primer Premier 5.0 软件设计荧光定量PCR引物对和探针,经过筛选和验证,本研究最终选取29843-31210 Murine hepatitis virus strain JHM作为靶基因。引物、探针由上海捷瑞生物工程有限公司合成(见表1)。

表1 MHV TaqMan荧光定量PCR引物及探针序列Table 1 MHV TaqMan fluorescent quantitative PCR primers and probe sequences
1.2.2样品的收集及前处理:连续无菌采集小鼠新鲜粪便,充分混匀,分别用液氮研磨法、磁珠匀浆法以及PBS溶解离心法3种前处理方法处理,重复提取3次。液氮研磨法:取新鲜粪便在液氮环境下充分研磨,20 mg/份分装,分装3份,加入600 μL裂解液,涡旋混匀后,按试剂盒操作步骤提取。磁珠均浆法:取新鲜粪便20 mg/份分装,分装3份,分别于磁珠混合后加入600 μL裂解液,使用磁珠匀浆仪55 Hz,10 min充分研磨后,按试剂盒操作步骤提取。PBS溶解离心法:取新鲜粪便20 mg/份分装,分装3份,分别溶于140 μL无菌PBS缓冲液,涡旋混匀后12 000 r/min离心5 min后,取上清液于另一RNase-Free的离心管中,加入600 μL裂解液,充分混匀后,按试剂盒操作步骤提取。
同时采集血清样本,用于检测抗体情况。另取小鼠粪便,在液氮环境下充分研磨, 20 mg称量分装,用于固体组试剂盒提取;取20 mg粪便溶于140 μL RNase-Free的PBS缓冲液中,充分混匀后,用于液体组试剂盒提取。
1.2.3核酸提取: 根据6种不同试剂盒所针对提取样本的差异,可将试剂盒分为固体样本提取组和液体样本提取组,TIANGEN DP422、MO BIO 26000、XS VRL 3个试剂盒为固体样本提取组,TIANGEN SD101、QIAGEN 52904、ABI AM1840 3个试剂盒为液体样本提取组。按照试剂盒说明书,手动提取病毒RNA,并进行核酸浓度测定,常规方法反转录成cDNA,-20 ℃保存备用,重复提取3次。
1.2.4实时荧光定量TaqMan-PCR检测:用TaqMan试剂盒对不同方法提取的病毒RNA进行检测,反应体系如下:2×TaqMan Fast Advanced Master Mix 12.5 μL,上下游引物(10 μmol/L)各 0.5 μL,探针(5 μmol/L)1 μL,模板cDNA 2.0 μL,补水至 25 μL。扩增程序为: 50 ℃培育 2 min,95 ℃预变性10 min; 95 ℃变性 15 s,60 ℃退火延伸 1 min,共 40 个循环,收集荧光信号并读取数据。
1.3 统计方法
2 结果
2.1 样本前处理方法比较
分别用磁珠匀浆法、液氮研磨法以及PBS溶解离心法,对3份MHV阳性小鼠的粪便进行处理,使用TIANGEN DP422核酸提取试剂盒提取病毒RNA,通过实时荧光定量TaqMan-PCR进行检测,结果显示,液氮研磨法对病毒RNA提取效率显著高于另外两种,见表2。同时,实时荧光定量TaqMan-PCR 检测结果显示,针对小鼠肝炎病毒,液氮研磨法提取效率也是最高的,见表3。
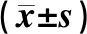
表2 3种样本前处理方法比较的结果Table 2 Results of comparison of three sample pretreatment methods
注:**表示差异极显著,P<0.01
Note:**indicates that the difference is extremely significant,P<0.01

表3 TaqMan荧光定量PCR对比结果Table 3 Comparison results of TaqMan fluorescence quantitative PCR
注:**表示差异极显著,P<0.01,Undetermined表示未检出
Note:**indicates that the difference is extremely significant,P<0.01,Undetermined means not detected
2.2 6种试剂盒提取MHV核酸效率的比较
利用6种试剂盒,分别提取MHV阳性小鼠的粪便样本,通过实时荧光定量TaqMan-PCR进行检测。结果显示,在提取效率上,TIANGEN DP422、MO BIO 26000、XS VRL、QIAGEN 52094、TIANGEN SD101均具有较高的提取效率,其中 TIANGEN DP422核酸提取效率最高,且显著高于其他各试剂盒(见表4)。荧光定量TaqMan-PCR 检测,TIANGEN DP422、XS VRL、QIAGEN 52094、TIANGEN SD101以及ABI AM1836 5种试剂盒均能得到特异性的扩增条带和曲线(见图1),MO BIO 26000试剂盒未检出MHV,TIANGEN DP422和XS VRL试剂盒的Ct值较低,针对小鼠肝炎病毒提取效果较好,其余3种试剂盒无显著差异。产物测序结果与NCBI的FTP中下载2株MHV基因组序列比对一致。同步开展的重复性试验表明,QIAGEN 52904试剂盒(变异系数:0.02991)重复性最好,TIANGEN DP422试剂盒(变异系数:0.03212)次之,详见表5。
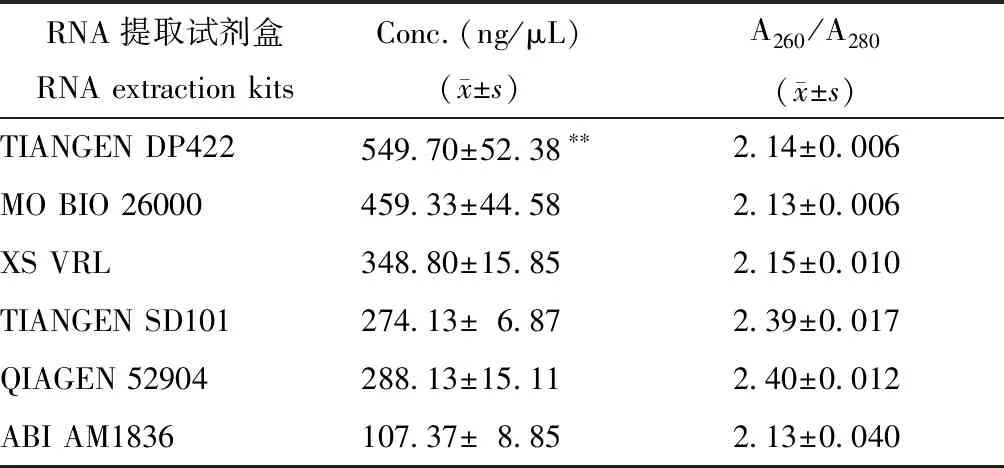
表4 6种试剂盒对粪便中病毒RNA提取效率比较结果Table 4 Comparison of the efficiency of viral RNA extraction from feces in six kits
注:**表示差异极显著,P<0.01
Note:**indicates that the difference is extremely significant,P<0.01
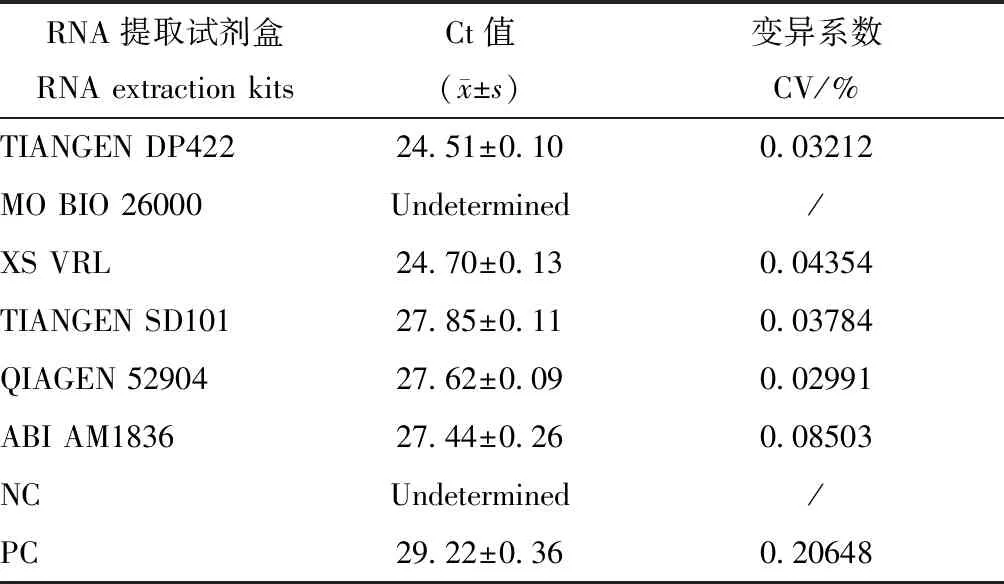
表5 6种试剂盒TaqMan-qPCR检测结果Table 5 Results of six kits TaqMan-qPCR detection

图1 六种试剂盒检测的扩增曲线Fig.1 Amplification curves detected by six kits
3 讨论
针对小鼠肝炎病毒目前诊断的方法有病毒分离与鉴定、血清学试验、组织病理学诊断、分子生物学诊断等。实时荧光定量PCR检测技术即为其中一种。本实验从粪便中提取小鼠肝炎病毒RNA检测,遵循实验动物“3R”原则的同时,尽可能减少病原检测对本动物的应激刺激或牺牲。但粪便样本复杂,病毒RNA极易被降解,很大程度上影响了MHV核酸的提取效率,因此粪便样本的前处理尤为重要。本实验选用液氮研磨法、磁珠匀浆法和PBS溶解离心法进行比较,液氮研磨法需手动研磨且需近距离的接触液氮,耗时费力,具有一定的危险性;磁珠匀浆法使用磁珠匀浆仪自动匀浆处理,操作较为简便;PBS溶解离心法操作最简便。考虑到提取效率的优势,选用液氮研磨法。与李冬民等[6]、戴方伟等[7]描述基本一致,可用于荧光定量PCR检测研究中。但针对大量样本的检测,建议可使用磁珠匀浆法提取。刘香梅等[8]在自然感染小鼠肝炎病毒的早期检测过程中,也从小鼠粪便中检测到MHV,提示PCR法在早期诊断中的优势。
据相关研究表明, 不同试剂盒的病毒核酸提取效率具有一定差异[9-11]。因此,选择提取效率高、价格低、操作方便的试剂盒,以便快速有效地进行病原检测十分重要。本研究选用了市售的6种核酸试剂盒进行比较,6种试剂盒均为手动提取,按试剂盒说明书进行操作,耗时按单个样本提取计。在提取效率上,固体样本组3种方法(TIANGEN DP422、MO BIO 26000、XS VRL)均具有较高的提取效率,TIANGEN DP422提取效率最高,且与其他几个试剂盒具有显著差异。在重复性方面,6种试剂盒均较好。从各试剂盒的提取方法、价格、提取时间、提取样本量以及所需自备试剂和辅助设备等因素综合分析,ABI AM1836为磁珠法提取,需要辅助磁力架提取,提取样本量受限于所选磁力架的规格,本实验室选用磁力架可同时提取8个样本,提取的样本量较小,不适宜大量样本提取。其余五种均为膜吸附法提取,其中MO BIO 26000试剂盒使用时,需额外附加涡旋仪适配器,以辅助提取过程,单次可提取样本量最大,但操作步骤比较繁琐,耗时较长,价格较贵(100元/份样本),且针对小鼠肝炎病毒未能检出。QIAGEN 52094和TIANGEN SD101主要针对液体样本,针对固体粪便样本操作则较TIANGEN DP422和XS VRL繁琐,且相比提取效率也具有显著差异,可能提取小鼠尿液更具优势。TIANGEN DP422试剂盒价格较便宜(28元/份样本)。
综合以上因素分析认为,粪便样本的前处理,液氮研磨法较好;粪便中小鼠肝炎病毒RNA的提取,TIANGEN DP422效率最高,价格较便宜,推荐用于小鼠肝炎病毒的分子生物学检测。
