PE联合DPMAS治疗对AFLP患者凝血功能的影响
2019-04-10
妊娠期急性脂肪肝(acute fatty liver of pregnancy,AFLP)又称妊娠特发性脂肪肝、产科急性假性黄色肝萎缩,多发生于妊娠末期(妊娠35周后)的一种极少见、特殊的急性肝脂肪变性的致命性危急重症,以肝细胞脂肪浸润、凝血功能障碍、黄疸、肝性脑病和肝衰竭等为主要临床特征,多见于初产妇和双胎妊娠孕妇,该病起病急骤,母婴死亡率极高[1-2]。血浆置换(plasma exchange,PE)和双重血浆分子吸附(dual plasma molecular adsorption system,DPMAS)均均为AFLP临床治疗效果较好的人工肝技术,但由于近年来血浆供应日益紧张情况导致PE在临床应用上受限,而DPMAS存在无法补充生物活性物质等不足。目前我院应用小剂量PE联合DPMAS治疗AFLP,取得较好效果,现将研究结果报道如下。
1 资料与方法
1.1 临床资料
选取我院2016年1月—2018年8月因AFLP需住院治疗患者46例作为研究对象。按照随机数字表法,将其分成观察组和对照组,每组各23例。观察组患者年龄22~45岁,平均年龄为(32.1±5.1)岁;孕周32~39周,平均孕周(36.5±4.1)周;发病至就诊时间3~8 d,平均时间(6.0±0.5)d。对照组患者年龄20~43岁,平均年龄(32.3±5.2)岁;孕周31~38周,平均孕周(36.6±4.2)周;发病至就诊时间2~7 d,平均时间(5.8±0.6)d。经分析,两组患者的年龄、孕周等基础资料比较,差异不具有统计学意义(t年龄=0.132,P=0.896;t孕周=0.082,P=0.824;t发病至就诊时间=1.228,P=0.226),具有可比性。本研究已经医院伦理委员会审批,患者及其家属知情同意。
纳入标准:所有患者均符合Swansea诊断标准[3-4],且凝血功能均有障碍;年龄在20~45岁;均为单胎、初产妇,且为剖宫产分娩;发病时间均为孕31~40周,均经患者和家属同意自愿参与本次研究,且签署知情同意书。排除标准:严重心、脑、肺、肾等脏器器质性病变者;精神、神经功能异常不能配合治疗者。
1.2 治疗方法
所有患者入院后均给予紧急剖宫产以终止妊娠,并严密监测患者生命体征,加强护肝、预防感染等对症支持治疗。对照组予以PE治疗,将血浆进行分离后,保留其细胞成分,混合于2 000 mL新鲜冰冻血浆,然后回输入人体。观察组予以小剂量PE联合DPMAS,将血浆分离后,先取(700±100)mL新鲜冰冻血浆进行PE,然后将血浆依次送入一次性使用离子交换树脂(BS330)胆红素吸附器,中性大孔树脂(HA330-Ⅱ)型血液灌流器进行双重吸附,与细胞成分混合后回输入人体。
1.3 观察指标
于治疗前和治疗2周后分别取静脉血5 mL,进行实验室指标检测。凝血酶原时间(PT)、凝血酶原活动度(PA)、纤维蛋白原(FIB)、活化部分凝血时间(APPT)水平应用STAGO血凝仪,采用凝固法进行测定[5];血小板(PLT)水平采用血液分析仪进行检测[6]。
1.4 统计学方法
采用SPSS 20.0软件对数据进行分析处理,计量资料以(均数±标准差)表示,采用t检验;计数资料以(n,%)表示,采用χ2检验,以P<0.05表示差异具有统计学意义。
2 结果
治疗前,两组各项凝血功能指标水平比较,差异不具有统计学意义(P>0.05)。治疗后,两组患者凝血功能均明显改善,与治疗前相比,差异均具有统计学意义(P<0.05);虽观察组患者的PT、APPT水平低于对照组,PA、FIB、PLT水平高于对照组,但组间比较,差异无统计学意义(P>0.05)。见表1。
3 讨论
AFLP是妊娠约35周后出现的妊娠期特有且少见的危重疾病,起病急骤、病情发展快,临床表现类似爆发型肝炎,预后较差,母婴死亡率高,有国外数据显示,该病孕产妇死亡率约18%,新生儿死亡率最高达58%[7-9]。该病治疗难度较大,既往临床多以早期诊断、及时终止妊娠和综合治疗为主要治疗措施,但临床经验发现,治疗后肝肾功能恢复较差,甚至转为慢性肾脏疾病风险性高,更有严重者需行肝脏移植治疗,严重影响患者预后恢复[10]。
PE技术部分替代肝脏功能,通过血浆分离,清除体内部分毒性物质,以及血管紧张素等活性成分,减轻肝脏负担,同时,在置换新鲜冰冻血浆后,大量充分白蛋白和凝血因子等体内缺少的生物活性物质,促进内环境稳定,增加机体系统抵抗力,为肝脏提供有效的支持作用[11]。但近年来我国各地血库血浆储备供应越来越紧张,很多患者因血浆供应不足而错失治疗最佳时机,而DPMAS系统在减少血浆应用的基础上,可更好的吸附胆红素,其采用HA330-Ⅱ型和BS330两种吸附器联合进行血浆吸附治疗,不仅可吸附中大分子毒素,还可依靠BS330针对胆红素、胆汁酸进行特异性吸附,两种吸附器相辅相成,提高救治成功率,有效改善预后[12]。
表1 两组治疗前后凝血功能水平比较(±s)
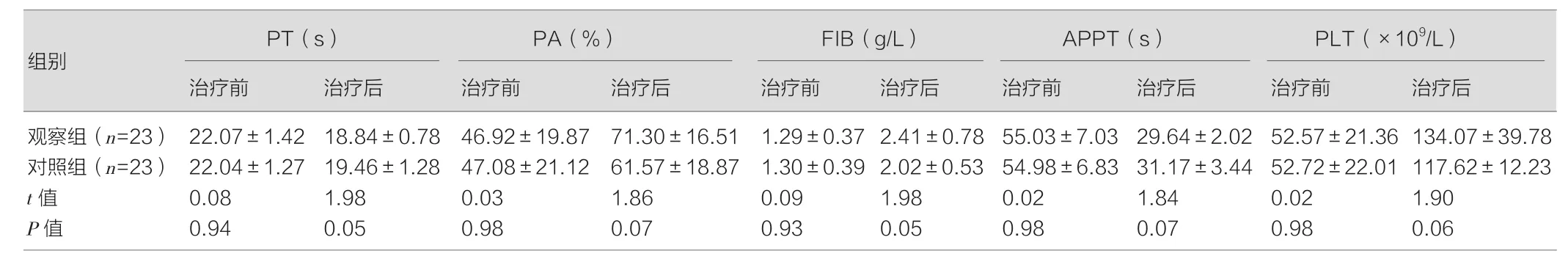
表1 两组治疗前后凝血功能水平比较(±s)
注:与本组治疗前比较,观察组:tPT1=9.56,PPT1<0.01;tPA1=4.53,PPA1<0.01;tFIB1=6.22,PFIB1<0.01;tAPP1=16.65,PAPP1<0.01;tPLT1=8.66,PPLT1<0.01;对照组:tPT2=6.86,PPT2<0.01;tPA2=2.45,PPA2=0.02;tFIB2=5.25,PFIB2<0.01;tAPP2=14.93,PAPP2<0.01;tPLT2=12.36,PPLT2<0.01。
观察组(n=23) 22.07±1.42 18.84±0.78 46.92±19.87 71.30±16.51 1.29±0.37 2.41±0.78 55.03±7.03 29.64±2.02 52.57±21.36 134.07±39.78对照组(n=23) 22.04±1.27 19.46±1.28 47.08±21.12 61.57±18.87 1.30±0.39 2.02±0.53 54.98±6.83 31.17±3.44 52.72±22.01 117.62±12.23 t值 0.08 1.98 0.03 1.86 0.09 1.98 0.02 1.84 0.02 1.90 P值 0.94 0.05 0.98 0.07 0.93 0.05 0.98 0.07 0.98 0.06
从上述结果可见,两组在治疗后凝血功能指标均得到一定改善,且联合治疗组效果与单独接受PE治疗效果相当,表明小剂量PE联合DPMAS治疗可有效改善AFLP患者凝血因子水平。这是因为PE联合DPMAS发挥了协同增效的作用,可优势互补,有助于降低患者胆红素、胆汁酸及炎性介质水平,对肝、肾等脏器功能起到保护的保护作用,同时还为患者补充了大量的白蛋白和凝血因子等体内比较匮乏的生物活性物质,故有助于改善患者的凝血功能及治疗效果。
综上所述,小剂量PE联合DPMAS在AFLP中应用临床效果较好,有效改善患者凝血功能。
