慢性乙型肝炎患者血清MIF、IL-17、IL-10变化的相关性研究
2019-04-09喻雪琴陈芳陈星戢敏梅怡晗杨旺春
喻雪琴,陈芳,陈星,戢敏,梅怡晗,杨旺春
(1.川北医学院附属医院感染科,四川 南充 637000;2.首都医科大学,北京 610041;3.岳池县人民医院感染科,四川 岳池 638300)
乙型肝炎病毒(hepatitis B virus,HBV)感染人体后结果多样,部分HBV感染者可进展为乙肝病毒携带者,慢性乙型肝炎(chronic hepatitis B,CHB),乙肝相关性肝衰竭、肝硬化、肝细胞癌,全球每年死于因HBV感染所致相关性肝脏疾病患者约65万人[1]。HBV感染后的部分患者将进展为CHB,体内存在免疫功能失衡,辅助性CD4+T淋巴细胞可调节宿主免疫细胞释放不同细胞因子并参与其致病与疾病恢复过程,多种细胞因子参与了CHB发生、发展及转归的免疫反应调节过程。目前研究发现,巨噬细胞迁移移动因子参与了CHB的发生发展过程,在CHB炎症诱导与抑制以及免疫调节方面发挥了对炎症介质的调控作用[2]。有研究结果显示,白细胞介素-10(interleukin-10,IL-10)作为一种炎性抑制因子,在阻止或减轻炎症发生的同时也可能导致感染慢性化,作为导致炎症发生的促炎性因子之一的IL-17,与机体炎症反应的发生发展关系密切[3]。本文就CHB患者血清巨噬细胞迁移移动因子(macrophage migration inhibitory factor,MIF)、IL-17、IL-10水平变化的相关性分析进行报道。
1 临床资料与方法
1.1 一般资料
选择2016年3月至2017年10月川北医学院门诊就诊并随访48周的CHB患者38例为治疗组,以2015年中华医学会肝病学分会中华医学会感染病学分会制定的“慢性乙型肝炎防治指南”诊断标准[4]进行诊断,其中男性23例,女性15例,年龄18~66岁,平均年龄(38.12±15.61)岁。根据HBV DNA载量分为高病毒载量组(≥105 copies/mL)30例,低病毒载量组(<105 copies/mL)18例;根据HBeAg状态分为HBeAg (+)组28例,HBeAg (-)组10例。以同期20例健康体检者为对照组,其中男性12例,女性8例,年龄18~64岁,平均年龄(37.98±14.42)岁。治疗组与对照组在年龄、性别构成比等方面差异均无统计学意义(P>0.05)。治疗组患者在48周的观察期间仅采用了恩替卡韦、复方甘草酸苷治疗,在肝功能正常后仅用恩替卡韦治疗。
1.2 纳入及排除标准
1.2.1研究对象排除标准 ①合并嗜肝病毒HAV、HCV、HDV、HEV感染者;②自身免疫疾病、酒精、药物、放疗等所致肝组织炎症者;③急性乙型病毒性肝炎者;④合并非嗜肝病毒感染所致的肝组织炎症者;⑤孕妇及哺乳期妇女者;⑥近6月使用过抗HBV治疗或激素、免疫抑制治疗者;⑦CHB并肝癌、脂肪肝等者;⑧原因不明的慢型肝炎者。
1.2.2 对照组纳入标准 ①年龄:18-60岁;②身体健康者;③HBsAg(-)者;④自身免疫性疾病诊断标志物阴性者;⑤血常规、血葡萄糖、甲状腺功能、肝肾功能正常者;⑥精神行为正常者。
1.3 方法
收集38例CHB患者和20名健康体检者清晨空腹外周静脉血5 mL,3 000 r/min离心3 min后,将分离的血清储存于-80 ℃环境中待检测。HBV感染标志物的检测采用化学发光法检测(选用美国雅培公司提供的试剂);采用荧光定量 PCR 法检测血清 HBV DNA(BIO-Rad公司);用ADVIA 2400全自动生化分析仪检测肝功能。采用 ELISA 法检测CHB患者血清 MIF IL-17 和 IL-10 水平(美国RD 公司提供的试剂)。
1.4 统计学分析
2 结果
2.1 治疗前两组血清MIF、IL-17、IL-10水平比较
治疗前治疗组血清MIF、IL-17水平高于对照组,IL-10水平低于对照组,差异均有统计学意义(均P<0.05)。见表1。
表1 治疗前两组血清MIF、IL-17、IL-10水平比较
2.2 治疗前后CHB患者血清MIF、IL-17、IL-10水平变化
治疗前治疗组血清MIF、IL-17水平高于治疗12周、24周、48周后水平,IL-10低于治疗12周、24周、48周后水平,差异均有统计学意义(均P<0.05)。见表2。
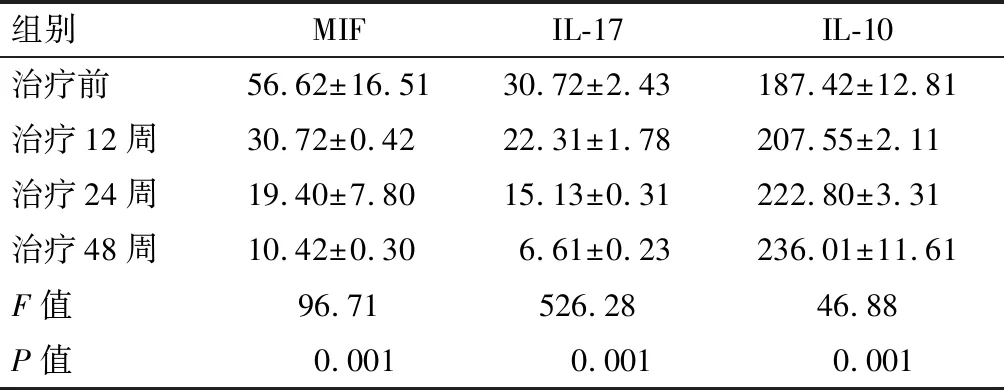
组别MIFIL-17IL-10治疗前56.62±16.5130.72±2.43187.42±12.81治疗12周30.72±0.4222.31±1.78207.55±2.11治疗24周19.40±7.8015.13±0.31222.80±3.31治疗48周10.42±0.306.61±0.23236.01±11.61F值96.71526.2846.88P值0.0010.0010.001
2.3 治疗前HBV DNA载量对CHB患者血清MIF、IL-17、IL-10水平的影响
HBV高载量组血清MIF、IL-17、IL-10水平高于HBV低载量组,差异有统计学意义(P<0.05)。见表3。
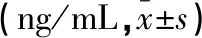
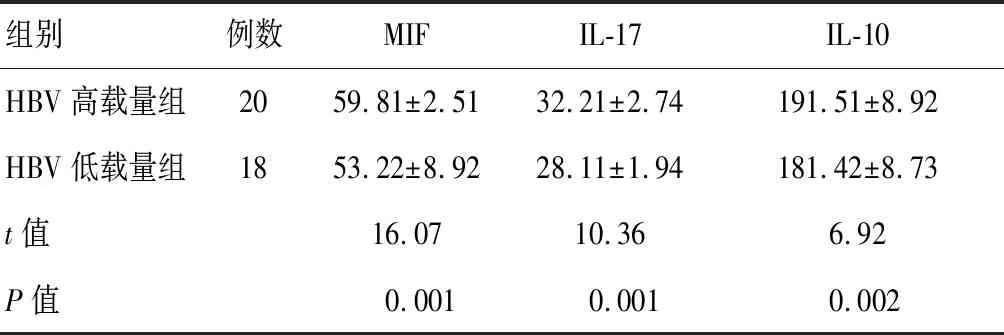
组别例数MIFIL-17IL-10HBV高载量组2059.81±2.5132.21±2.74191.51±8.92HBV低载量组1853.22±8.9228.11±1.94181.42±8.73t值16.0710.366.92P值0.0010.0010.002
2.4 治疗前HBeAg状态对CHB患者血清MIF、IL-17、IL-10水平的影响
HBeAg(+)组患者血清MIF、IL-17、IL-10水平高于HBeAg(-)组,差异有统计学意义(P<0.05)。见表4。
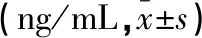
组别例数MIFIL-17IL-10HBeAg(+)组2860.52±2.5131.44±1.62191.31±5.41HBeAg(-)组1054.61±3.5228.43±0.74178.01±6.33t值11.0511.5712.55P值0.0010.0010.001
2.5 治疗前CHB患者血清MIF、IL-17、IL-10水平与ALT、AST的相关性分析
治疗前CHB患者MIF、IL-17水平与ALT呈负相关关系,与AST呈正相关关系;IL-10水平与ALT、AST均呈负相关关系。见表5。
表5治疗前CHB患者血清MIF、IL-17、IL-10水平与ALT、AST的相关性分析(r值)
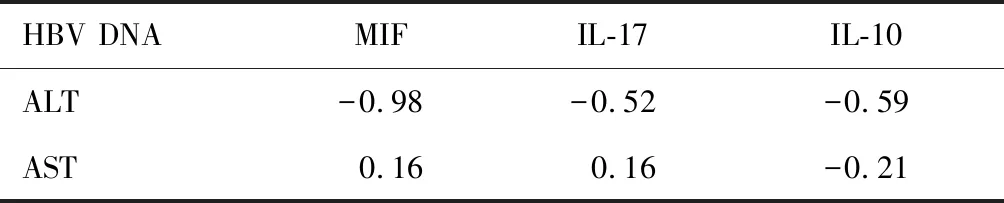
HBV DNAMIFIL-17IL-10ALT-0.98-0.52-0.59AST0.160.16-0.21
*注:表内r值,均表示P<0.05。
3 讨论
HBV感染后疾病的发生、发展、转归过程中存在病毒与宿主免疫系统之间的相互作用,是乙肝病毒、肝细胞及宿主免疫系统相互作用的动态平衡过程。免疫功能异常是乙肝病毒感染后导致肝损伤的重要发生机制。细胞免疫的发生与调控需通过T淋巴细胞来介导,是清除CHB患者体内HBV的主要免疫细胞,T淋巴细胞及其细胞因子比例失衡是导致CHB发生与病情恶化的重要原因,T淋巴细胞介导的免疫系统在HBV感染后被诱导、激活并释放多种细胞因子,进而导致促炎因子与抑炎因子失衡的肝组织炎症反应,诱导并介导肝细胞损伤,对诱导各类细胞分化增殖,导致HBV感染后肝组织炎症持续存在发挥调控作用[5]。MIF、IL-10、IL-17代表着不同的细胞因子亚群,细胞因子MIF、IL-17及IL-10等参与CHB的发生、发展过程,具有生物学功能的多样性,对肝细胞具有黏附、吞噬及诱导一氧化氮产生等功能,在炎性反应中起重要的调控作用[8]。
结果显示,HBV高载量组血清MIF、IL-17、IL-10水平高于HBV低载量组,HBeAg(+)组患者血清MIF、IL-17、IL-10水平高于HBeAg(-)组;细胞因子MIF、IL-17、IL-10与HBV水平及HBeAg状态关系密切,表明MIF、IL-17、IL-10参与了CHB的促进炎性反应与抑制炎症反应过程,对CHB的发生、发展与转归起到了一定的调控作用。在田鹏飞等[6]的研究中发现,高病毒载量组血清细胞因子MIF、IL-17和IL-10水平高于中、低两组,中病毒载量组的细胞因子水平最低;与中病毒载量组相比,高病毒载量患者MIF和IL-10水平显著升高,这与本研究结果一致,提示病毒载量水平及HBeAg状态与CHB患者肝组织内炎性反应关系密切,也可能是导致肝组织慢性化、肝纤维化的风险因子之一。
研究发现,MIF是巨噬细胞和淋巴细胞分泌的众多细胞因子之一,MIF作为一种重要的炎性因子,在肝组织炎症发生及肝组织纤维化过程中,MIF起到诱导巨噬细胞分泌IL-8并诱导和刺激释放大量的肌酸激酶而间接激活肝星状细胞,影响肝组织纤维化的发生[6]。本实验通过对治疗前后CHB患者血清MIF水平变化分析发现,血清MIF水平在经过治疗后呈现下降趋势,提示MIF水平反映了肝组织炎症程度,在肝组织炎症发生过程中起到重要作用,MIF参与CHB的发生、发展过程,其变化与肝组织损伤与炎症程度关系密切[8]。
本研究发现,治疗前CHB患者MIF、IL-17水平与ALT呈负相关关系,与AST呈正相关关系;IL-10水平与ALT与AST均呈负相关关系,提示CHB患者MIF水平变化与肝组织损害程度相关。这与田鹏飞等[6]研究发现MIF水平与ALT、AST水平呈正相关,曾钢等[9]研究发现CHB患者MIF水平明显升高基本一致。但本实验结果中与田鹏飞报道[6,9]也不完全一致,而本研究显示CHB患者MIF、IL-17水平与ALT呈负相关关系,与AST呈正相关关系,这可能与ALT主要反应肝组织的急性炎症而非肝组织实质性炎症等因素相关,AST则是肝细胞内线粒体损伤后释放的肝细胞酶,在一定程度上反映了肝实质炎症,与肝组织损伤程度一致性较高有较大关系,另外可能与样本量的筛选因素有关,即外周血细胞因子的检测并不单纯反映局部的炎症反应,而是反映循环中的总效应和总水平。
本研究结果显示,治疗前治疗组患者血清MIF、IL-17水平高于治疗12周、24周、48周后水平, IL-10水平低于治疗12周、24周、48周后水平。研究发现,IL-17 主要是由活化的Th17 细胞分泌的特异性的促炎症效应因子,可以促进机体局部产生趋化因子如IL-8、IL-6等,使单核细胞及中性粒细胞迅速增长,诱导、激活CHB患者肝组织炎症的发生[7],显示IL-17在CHB的炎性反应中可能发挥重要的促炎因子作用,与肝组织炎症程度密切相关。同时与IL-17参与诱导促炎因子、趋化因子的高表达,诱导并激活肝组织细胞通透性增加关系密切[10],这与丁庆莉等[11]研究结果相一致。与杨波等[12]研究发现CHB患者外周血Thl7细胞频率与ALT水平呈正相关,CHB患者肝组织内Thl7细胞数量与肝组织炎症活动度及AST水平呈正相关的结果一致。作者研究发现CHB患者血清IL-17与AST呈正相关系,与ALT呈负相关系。其研究结果出现差异可能与CHB患者病例的入选条件差异及样本量、检测时机及手段等有一定关系。
Treg细胞可分泌IL-10,除Treg细胞外,Th2细胞、树突细胞等亦可分泌。IL-10作为一种重要的抗炎因子,它能够通过减少局部肝组织中的中性粒细胞增值、活化,并减少其与肝内皮细胞的黏附从而抑制HBV诱导下的肝细胞损害[7]。本研究发现,治疗前CHB患者血清中IL-10水平低于对照组,这可能是因为此时肝组织炎症反应较重,与炎症反应相关的促炎因子水平占主导地位,那么此时具有抗炎作用的细胞因子处于低水平状态、加之HBV高载量、IL-10对炎症刺激反应出现较晚等因素相关。这显示IL-10可抑制肝组织炎症,抑制细胞免疫应答,但也导致机体不能有效清除HBV,从而造成乙肝病毒感染慢性化。而随着治疗进程推进与病情好转,CHB患者血清IL-10水平逐渐升高,促炎性因子MIF、IL-17水平下降,其对肝组织的损伤也就减轻,高水平表达的IL-10的抗炎以及抑制细胞免疫应答作用得到增强,使得肝组织炎症反应减轻并逐渐趋于慢性化,这种观点与于晓辉等[13]大多数学者的研究结果相一致。
本研究通过比较CHB患者血清MIF、IL-17 及IL-10 水平的变化,初步分析了MIF、IL-17 及IL-10在CHB的炎性反应中的作用及意义并有望成为CHB治疗的新靶点。
