血管生成拟态与Hif-1α、EphA2在原发性肝癌中表达关系的研究
2019-04-09李杰马晓洁杜小波谭榜宪
李杰,马晓洁,杜小波,谭榜宪
(1.绵阳市中心医院肿瘤科,四川 绵阳 621000;2.川北医学院附属医院肿瘤科,四川 南充 637000)
血管生成拟态(vasculogenic mimicry,VM) 是一种独立于内皮细胞血管生成的全新肿瘤微循环模式。在缺氧微环境中,肿瘤细胞表达部分内皮细胞表型,模拟内皮血管生成途径形成可以输送血液的微循环管道,被称为VM。过去十年针对VM的研究是肿瘤抗血管生成的热点领域,关于VM的形成机制成取得不少成果,其中缺氧诱导因子-1α(hypoxia inducible factor-1α,Hif-1α)、上皮细胞激酶(epithelial cell kinase,EphA2)被认为调控 VM形成的两个关键因子。本研究旨在探究VM与 Hif-1α、EphA2之间的关系,揭示VM形成机制。
1 材料与方法
收集川北医学院附属医院、绵阳市中心医院2010年至2014年PLC患者切除术后的蜡块标本161例,所有病例临床病理资料完整。蜡块重新切片HE染色,明确分化程度、是否合并肝硬化;免疫组化染色观察Hif-1α和EphA2的表达。镜下选取5个不重叠的肿瘤细胞视野进行计数,根据阳性细胞数/细胞总数进行评分,阳性的细胞数<5%为0分,5~25%为1分,25~50%为2分,50~75%为3分,>75%为4分;染色强弱程度计分,无色:0分;浅黄色:1分;深黄及棕红色:2分;棕褐色:3分。然后将染色强度×阳性细胞百分比对应的评分作为评分参考,0~3分为(-);4分为(+);5~8分为(++);9~12分为(+++),将≥4分者记为阳性。VM通过CD31-PAS双染进行标记,管壁细胞CD31染色阴性且管壁外附PAS阳性的细胞外基质,管腔内有红细胞为VM阳性。另外选取15例正常肝组织作为对照组,将正常肝脏组织进行CD31-PAS双染。
统计分析采用SPSS 23.0软件进行分析。计数资料采用χ2检验或Fisher确切概率法,Logistic回归模型进行多因素分析,相关性检验采用Spearman相关分析。双侧P<0.05为差异有统计学意义。
2 结果
2.1 PLC中VM表达与各临床因素的关系
PLC中VM阳性率为37.9%,正常肝脏组织中没有VM表达。患者不同年龄、性别、病理类型和HbsAg对VM表达比较,差异均无统计学意义(均P>0.05)。VM表达与肿瘤体积(>5 cm3或<5 cm3)呈正相关(χ2=4.590,P=0.032);与临床分期I-II和III-IV(AJCC/UICC第7版)呈正相关(χ2=5.022,P=0.025);与HCC edmondson分级呈正相关(χ2=7.575,P=0.006);与肝硬化呈正相关(χ2=8.284,P=0.004)。多因素回归分析提示临床分期、肝硬化是影响VM表达的独立危险因素(P=0.020,P=0.012) 。见图1、表1和表2。
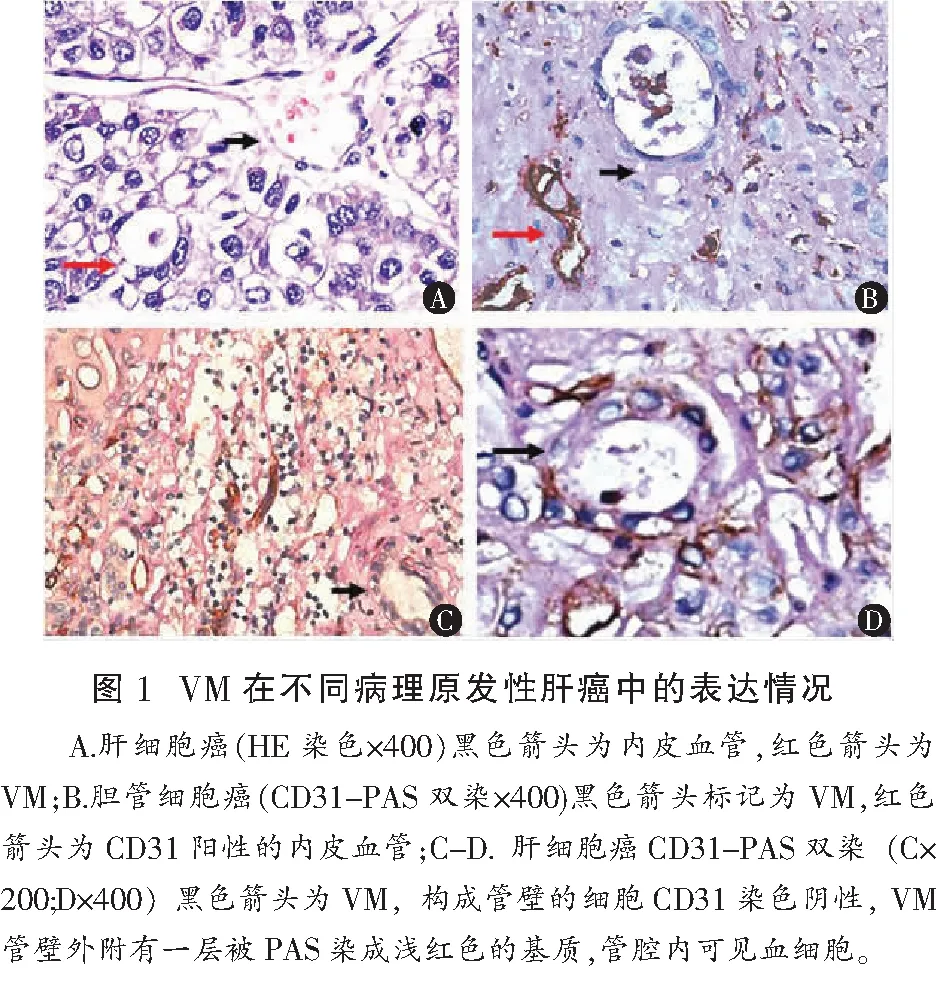
表1 PLC中VM表达与各临床因素的关系
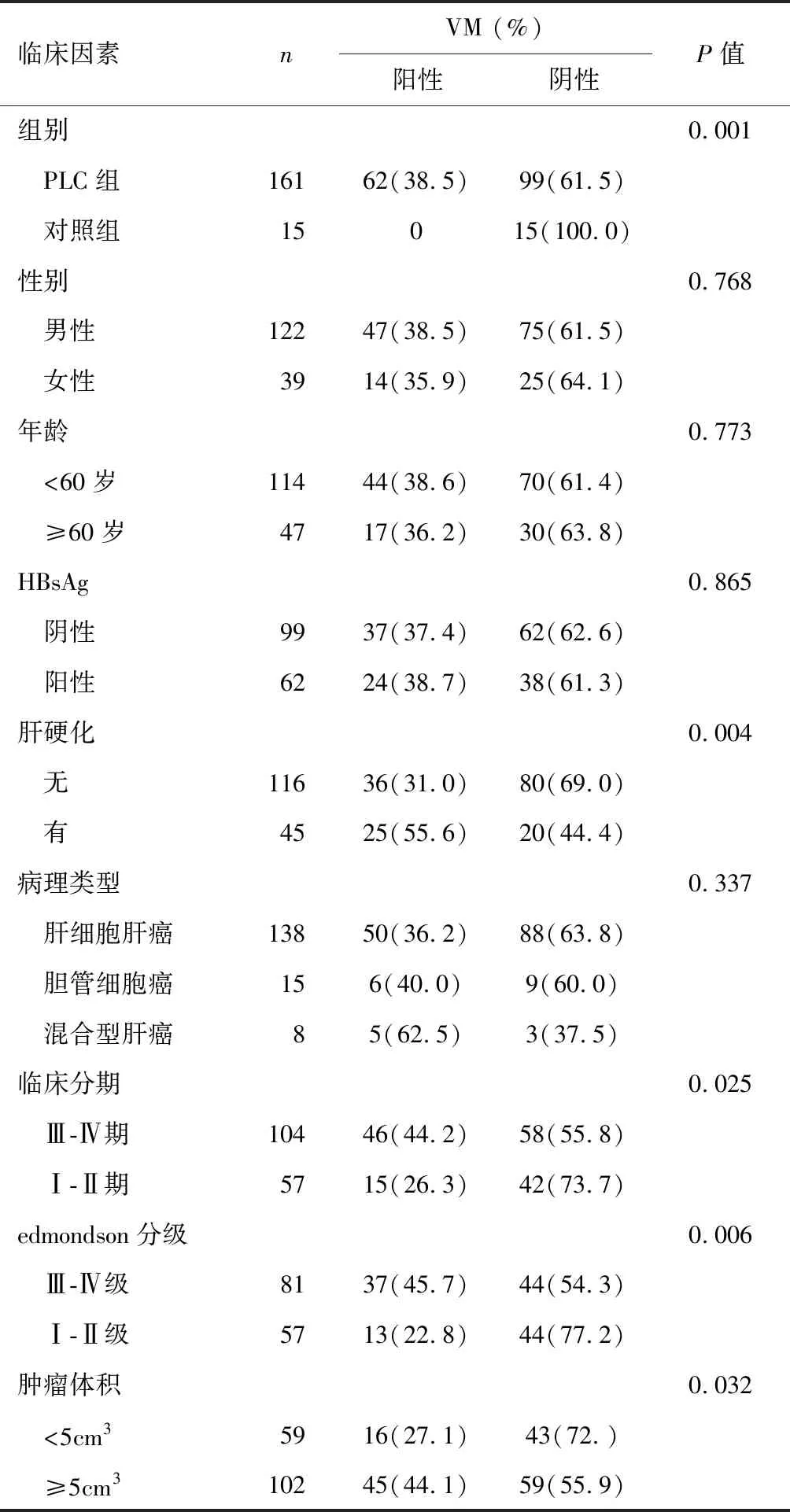
临床因素nVM (%)阳性阴性P值组别0.001 PLC组16162(38.5)99(61.5) 对照组15015(100.0)性别0.768 男性12247(38.5)75(61.5) 女性3914(35.9)25(64.1)年龄0.773 <60岁11444(38.6)70(61.4) ≥60岁4717(36.2)30(63.8)HBsAg0.865 阴性9937(37.4)62(62.6) 阳性6224(38.7)38(61.3)肝硬化0.004 无11636(31.0)80(69.0) 有4525(55.6)20(44.4)病理类型0.337 肝细胞肝癌13850(36.2)88(63.8) 胆管细胞癌156(40.0)9(60.0) 混合型肝癌85(62.5)3(37.5)临床分期0.025 Ⅲ-Ⅳ期10446(44.2)58(55.8) Ⅰ-Ⅱ期5715(26.3)42(73.7)edmondson分级0.006 Ⅲ-Ⅳ级8137(45.7)44(54.3) Ⅰ-Ⅱ级5713(22.8)44(77.2)肿瘤体积0.032 <5cm35916(27.1)43(72.) ≥5cm310245(44.1)59(55.9)
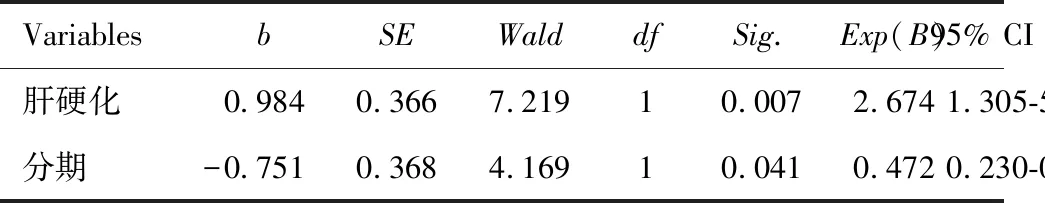
表2 Logistic回归模型进行多因素分析
2.2 Hif-1α和EphA2蛋白的表达
Hif-1α和EphA2蛋白主要在胞浆中表达,镜下可见呈巢团状分布,染色后呈棕黄色(图2)。VM阳性组Hif-1α和EphA2阳性表达率分别为75.4%和80.3%,VM阴性组Hif-1α和EphA2阳性表达率分别为60.0%和63.0%,差异有统计学意义(χ2=10.608,χ2=8.490;P=0.014,P=0.037)(表3)。Spearman法相关性分析显示EphA2与Hif-1α在PLC中的表达存在显著相关性(r=0.194,P=0.014)(表4)。

表3 VM表达与EphA2、Hif-1α的关系
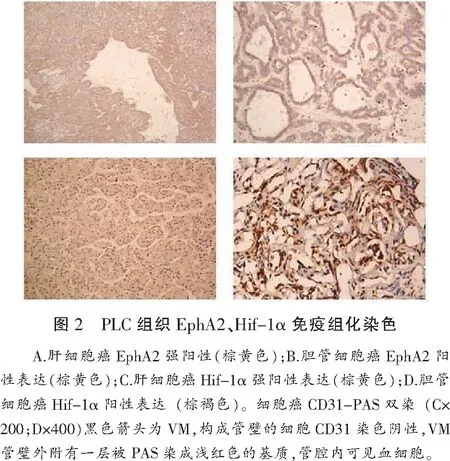
表4 EPHA2与Hif-1α相关性分析
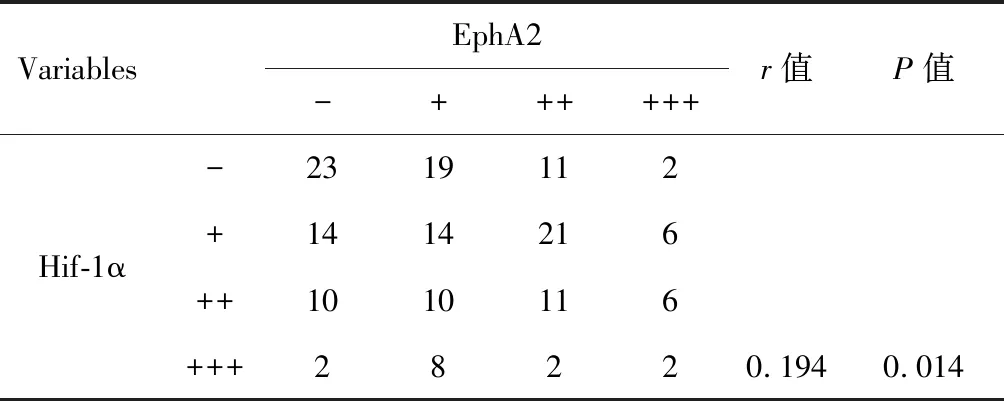
VariablesEphA2-++++++r值P值Hif-1α-2319112+1414216++1010116+++28220.1940.014
3 讨论
原发性肝癌包括肝细胞癌、肝内胆管上皮细胞癌以及两者混合发生三种病理类型,根据2015年的统计数据,世界范围内,肝癌致死率在所有恶性肿瘤中排名因第二[1],是公认的严重危害人类健康的恶性肿瘤之一。中国作为肝癌高发区,每年约有40万人死于肝癌,病死率排在我国恶性肿瘤致死原因第二位[2]。PLC治疗效果差是其高死亡率的主要原因,越来越多的研究者着力于探索新的治疗手段,近年来抗肿瘤血管生成靶向治疗成为了研究热点,研究者对抗肿瘤学血管生成治疗的领域进行了广泛的探索,研发出多种抗血管生成治疗的分子靶向药物,如贝伐单抗、索拉非尼、阿帕替尼、恩度等药物广泛运用于临床,但肝癌患者的总体疗效未得到显著改善。研究发现,恶性程度较高的侵袭性肿瘤[3-5],除了经典的内皮细胞依赖性血管生成途径以外,肿瘤细胞可以模拟内皮细胞表型形成网状管道样结构并与内皮依赖性血管相连而成的新生血管,这种血管形成途径完全不依赖内皮细胞,被称为血管生成拟态(VM)。VM由肿瘤细胞直接构成血管管壁,可为肿瘤的血性转移提供更为便捷的途径。因此探索VM的形成机制成为必要,以VM为靶标的治疗策略成为近年抗血管生成治疗研究的重点[6-7]。
15例正常肝脏组织进行CD31-PAS双染,没有观察到VM表达。PLC的三种病理类型,VM总阳性率为38.5%。其中非肝细胞癌23例,VM阳性率40%以上,肝细胞癌VM阳性率36.2%。本研究中不同病理类型VM的表达,差异无统计学意义,由于非肝细胞肝癌样本量少,不足以说明不同病理类型VM表达的是否存在差异,有待进一步研究证实。
研究表明缺氧微环境中Hif-1α的过表达是调控VM形成的重要因素[8],而EphA2则是VM形成过程中重要的起始调节物[9]。本研究结果还证实了EphA2在Hif-1a高表达区呈强阳性,且与Hif-1a呈显著正相关,肿瘤形成VM的能力显著增加。研究表明RNA干扰抑制Hif-1a基因在食管鳞癌细胞中的表达,可在一定程度上降低EphA2的表达,抑制VM的形成[10]。调控机制可能是伴随着肿瘤体积逐渐增大,肿瘤组织缺血缺氧,缺氧微环境诱导Hif-1表达增强,调节EphA2等基因的活性促进血管生成。一些可塑性强的肿瘤细胞分化和表达内皮细胞表型并模拟内皮血管结构形成VM,与正常血管连通,共同为肿瘤细胞生长提供营养,肿瘤组织重新获得血氧供应。在本研究当中,肿瘤体积越大、肿瘤分期越晚VM阳性率越高,恰恰应证这种调控机制。肿瘤体积增大、临床分期增加,肿瘤组织内部部分区域血供不足,出现缺血缺氧,缺氧微环境诱导VM的形成。此外,本研究中肝硬化能增强Hif-1α的表达,提示肝细胞癌合并肝硬化可加重低氧微环境的形成,其原因可能与肝细胞结节性增生、肝癌小梁细胞层增多和纤维结缔组织过度增殖有关。因此不难理解,合并肝硬化的肿瘤组织中VM表达更强。
在多数实体瘤中,VM的形成改变了肿瘤局部微环境,增加了对肿瘤局部浸润、微转移的途径,从而影响肿瘤患者的预后。本课题组前期回顾性研究发现证实VM表达阳性是原发性肝癌患者PLC预后不良的独立因素[11-12]。本文主要讨论VM的调控机制,关于VM对患者预后的影响需要更多的干预性研究来进一步说明。肿瘤发生发展过程中,离不开血液的供应,血液供应需要新生血管形成,而血管形成是一个多因素,多靶点的调控过程,VM的发现使研究者对肿瘤血管生成有了更全面的认识。近年的研究发现IL-6[13]、VE-cadherin[14]、Bcl-2和Twist1[15]在VM的调控机制中也发挥着重要的作用,但是目前对VM形成过程中的调控机制尚未系统的阐明,诸多疑问还需要分子水平的研究进一步回答。本研究选取石蜡标本,可能存在蛋白丢失,对结果造成影响,下一步将在术后新鲜肝癌组织进行进一步探索。
