尼莫地平激活PI3K/Akt通路对I/R老龄大鼠脑微血管生成机制研究
2019-04-09余翔梁辉曾凯敏刘昕彭熠李春花傅可
余翔,梁辉,曾凯敏,刘昕,彭熠,李春花,傅可
(湖南省人民医院神经内科,湖南 长沙 410005)
缺血性脑卒中为全球第二大致死因素、第一大致残因素,多发于老年人群[1]。及时恢复缺血组织供血是治疗脑缺血的关键,但随之而来的缺血再灌注损伤 (ischemia reperfusion injury,I/R,是指脑部缺血区通过血管再通或侧支循环建立等途径恢复血流后而引起的脑组织损伤)会导致脑组织的二次损伤。研究证实微血管生成是I/R损伤后的重要保护途径,缺血缺氧后可刺激脑组织启动自身血管生成机制,通过建立侧支循环抵御缺血缺氧对脑组织的损害,起到脑组织保护作用[2]。研究显示,磷脂酰肌醇-3激酶/丝氨酸-苏氨酸蛋白激酶(phosphoinositide-3 kinase-serine/threonine kinase,PI3K-Akt )信号通路在脑缺血半暗带区微血管的生成和侧支循环的建立中起重要作用[3-4],目前国内外对老年脑缺血损伤与微血管生成及信号转导通路的研究较少,本研究采用尼莫地平、PI3K/Akt信号通路抑制剂干预I/R损伤大鼠模型,通过检测其脑缺血半暗带区α-SMA 、PI3K、Akt的表达水平,探讨尼莫地平对缺血再灌注老龄大鼠脑微血管生成的促进机制。
1 材料与方法
1.1 材料
1.1.1 药物与仪器试剂 PI3K/Akt信号通路抑制剂LY294002(德国,Calbiochem);尼莫地平(山东新华制药股份有限公司,国药准字S1308079);α-SMA、 PI3K及Akt试剂盒及一抗、二抗(武汉博士德生物工程有限公司);10%水合氯醛注射液(分析纯,中国五联化工厂);多聚甲醛(分析纯,北京化工厂)。OLYMPUS BX5显微镜(日本奥林巴斯株式会社)。
1.1.2 动物 SPF级健康雄性SD成年大鼠,20~21月龄(450~500 g),购自苏州大学实验动物中心(生产许可证号:SCXK(苏)2009-0002)。动物在安静环境下分笼饲养,实验室饲养温度为(22±2)℃,湿度55%~70% ,每天给予清洁充足的食物和水,实验前禁食12 h,不禁水。
1.2 方法
1.2.1 脑缺血再灌注损伤模型制备 模型组、尼莫地平组及抑制剂组共144只大鼠,采用改良的大脑中动脉线栓法[5]制备局灶性脑缺血大鼠模型:(1)腹腔注射10%水合氯醛(剂量为 3.5 mL/kg)将大鼠麻醉后,仰卧位固定,常规颈部去毛、消毒;(2)沿颈部正中切开皮肤,钝性分离皮下组织,分离左侧颈总动脉,并向上钝性分离颈内、外动脉;游离颈外动脉约3~4 mm,在距离颈总动脉分叉较远处结扎颈总动脉和颈外动脉,将颈总动脉和颈内动脉拉成一直线,用微动脉夹分别夹闭颈内动脉和颈总动脉;(3)在颈总动脉上剪开一小口,在剪口处注入肝素25 U,将制备好的线栓自切口插入,并沿颈总动脉分叉处缓慢插入颈内动脉,遇有轻微阻力即停止,此时线栓的膨大顶端恰好堵塞大脑中动脉的开口处,固定并剪断线栓尾部,松开颈总、颈内动脉的微动脉夹,连续缝合手术切口;(4)线栓 3 h 后将插线拔出颅外(分2次进行),进行再灌注。假手术手术方法同上,但不用线栓堵塞中动脉。
1.2.2 实验分组与给药 采用随机数表法将30只大鼠随机分为3组:(1)假手术组和模型组:按照1 mL/100 g体重,灌胃给与生理盐水;(2)尼莫地平组:于手术前5 d开始,按1 mL/100 g体重,每天灌胃给与1 mg/mL尼莫地平悬浮液(药物剂量为6 mg·kg-1·d-1);(3)于手术前5 d开始,每天灌胃给与尼莫地平,药物剂量及灌胃量同尼莫地平组,同时经尾静脉注射LY294002(药物剂量为0.3 mg·kg-1·d-1)。各组大鼠均于不同时间点断头取脑,取缺血侧前额皮质,用4%的多聚甲醛溶液固定,待做免疫组化。
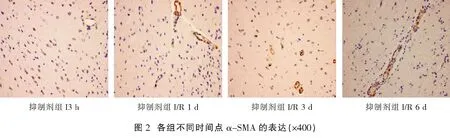
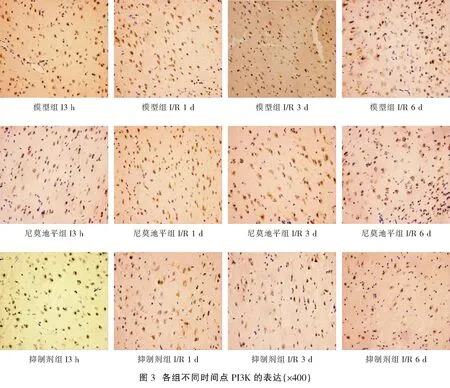
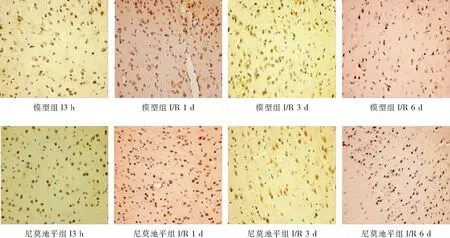
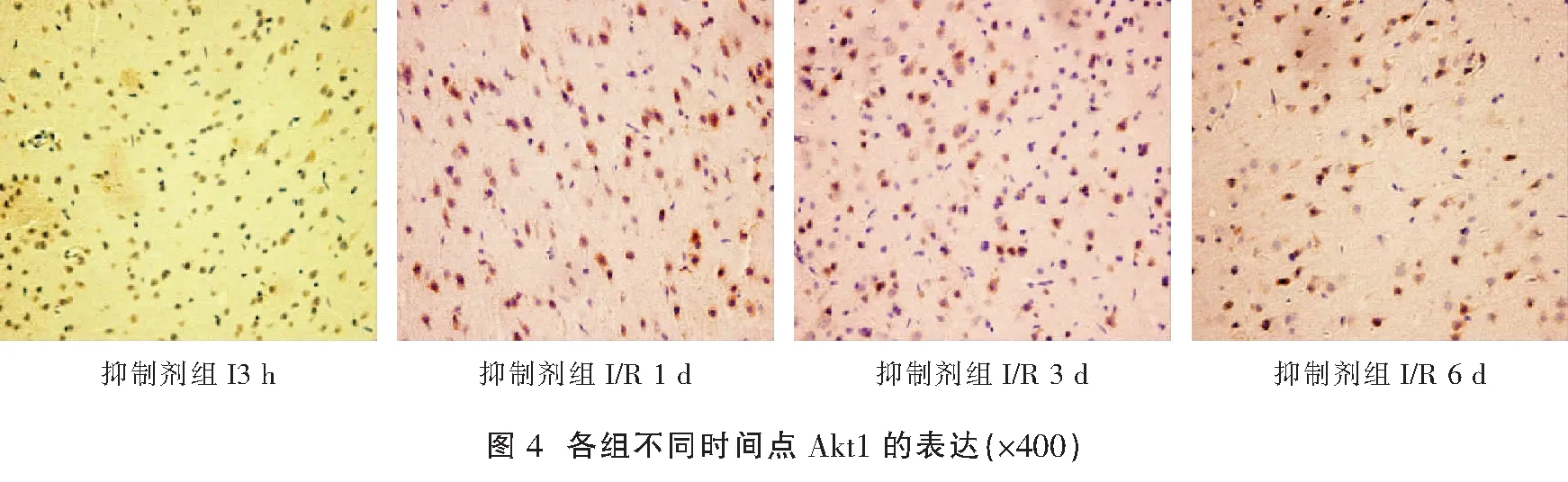
1.2.3 α-SMA、PI3K及Akt的表达情况检测 采用免疫组化法检测:(1)将缺血侧前额皮质组织石蜡切片脱蜡至水,置于3%H2O2的PBS中,室温孵育 10 min后,蒸馏水洗涤5 min×3 次;(2)用 5%正常山羊血清封闭,室温孵育10 min,倾去血清,不洗,滴加稀释的一抗工作液,保湿盒内4 ℃过夜后,PBS 洗涤切片,5 min×3 次;(3)滴加稀释的生物素化二抗,37 ℃保湿盒中孵育10~30 min,PBS冲洗切片,5 min×3 次;(4)滴加稀释的辣根酶标记链霉卵白素,37 ℃孵育 10~30 min,PBS 冲洗切片,5 min×3 次;(5)DAB显色:使用 DAB 显色试剂盒,取 1 mL 蒸馏水,加试剂盒中 A、B、C 试剂各1滴,混匀后滴至切片,反应 30 min后,自来水充分冲洗,苏木素轻度复染,脱水,透明,封片。高倍镜下(×400)随机取大脑造模侧皮层5个部位进行拍摄,采用Image Pro Plus 6.0图像处理软件计算阳性表达情况[2]。
1.3 统计学分析
2 结果
与假手术组比较,模型组、尼莫地平组和抑制剂组I3 h、I/R1 d、I/R3 d、I/R6 d各时间点的α-SMA、PI3K及Akt阳性表达水平均显著升高(P<0.05);模型组、尼莫地平组和抑制剂组在本组内后一时间点的α-SMA、PI3K及Akt阳性表达水平前一时间点明显升高(P<0.05);与模型组相同时间点比较,尼莫地平组的α-SMA、PI3K及Akt阳性表达水平均显著升高(P<0.05);与尼莫地平组相同时间点比较,抑制剂组的α-SMA、PI3K及Akt阳性表达水平均显著升高(P<0.05)。见表1,图1-图4。
表1 各组大鼠脑组织微血管α-SMA、PI3K及Akt阳性表达水平
**P<0.05,与假手术组比较;#P<0.05,与本组内的前一时间点组比较;△P<0.05,与模型组相同时间点组比较;▲P<0.05,与尼莫地平组相同时间点组比较。
3 讨论
血管生成作为I/R损伤后的重要保护途径,主要包括内源性血管生成和治疗性血管生成两方面,I/R损伤后调动内源性的血管生成机制促进缺血区微血管生成及缺血性脑卒中的治疗意义重大,研究显示组织缺血缺氧后可启动自身血管生成机制,逐渐建立起自身侧支循环,改善脑局部缺血缺氧症状[6],但其改善效果往往欠佳,临床上也可通过药物、基因治疗等方式,促使缺血组织形成新的毛细血管,此种方法称为治疗性血管生成。α-SMA是由微血管的内皮细胞周围的周细胞特异性表达的一种收缩蛋白,可作为微血管生成的表面标志物。 目前,国内外已有较多关于脑损伤后血管生成的报道:Beck等[7]研发现,在脑缺血损伤后1 d即可出现内皮细胞增值,损伤3 d后可见脑血管数量明显增加,提示脑缺血损伤后可即刻发生新血管的生成。有研究[8]显示,缺血性脑损伤患者脑组织内新生微血管密度存在不同程度的增加,且密度高血管组的预后明显好于较低密度血管组,提示提高缺血性脑损伤患者脑组织内新生微血管密度对提高患者预后具有重要意义。
与假手术组比较,模型组、尼莫地平组和抑制剂组I3 h、I/R1 d、I/R3 d、I/R6 d各时间点的α-SMA、PI3K及Akt阳性表达水平均显著升高(P<0.05);模型组、尼莫地平组和抑制剂组在本组内后一时间点的α-SMA、PI3K及Akt阳性表达水平前一时间点明显升高(P<0.05);与模型组相同时间点比较,尼莫地平组的α-SMA、PI3K及Akt阳性表达水平均显著升高(P<0.05);与尼莫地平组相同时间点比较,抑制剂组的α-SMA、PI3K及Akt阳性表达水平均显著升高(P<0.05)。
本研究采用免疫组化法对老龄I/R大鼠微血管周围α-SMA的动态表达进行研究,结果显示I3 h、I/R1 d、I/R3 d、I/R6 d的模型大鼠各时间点α-SMA的阳性表达水平均较假手术组显著升高,且在I3 h、I/R1 d、I/R3 d、I/R6 d各时间点的阳性表达率依次升高,提示大鼠脑缺血损伤后为血管生成增加,其增加数量随着缺血再灌注时间的延长而增大;尼莫地平组在I3 h、I/R1 d、I/R3 d、I/R6 d各时间点的α-SMA阳性表达水平明显高于模型组同期,提示尼莫地平可能通过药物治疗性血管生成模式促进了大鼠缺血脑组织缺血区微血管的生成;而PI3K/Akt信号通路抑制剂组在以上各时间点的α-SMA阳性表达水平较尼莫地平组同期显著降低,提示阻断PI3K/Akt信号通路可减弱尼莫地平促进缺血区微血管生成的作用,也从侧面说明尼莫地平的促进微血管生成的机制与PI3K/Akt信号通路相关。
研究表明,PI3K/Akt信号通路是一条保护机体应对各种刺激的重要通路,该通路激活后可通过调节其下游因子而调控细胞凋亡、生存及增殖,同时参与了脑缺血半暗带区微血管生成和侧枝循环的建立及脑I/R的生理病理过程[3-4]。PI3K作为一种具有脂类激酶和蛋白激酶双重活性的酶,可被各种细胞因子激活,而进一步诱导下游信号分子Akt 的活化[9],在促进心血管生成、调控细胞增殖与凋亡种起重要作用[10]。脑缺血后,机体大量上调PI3K和Akt的阳性表达,启动PI3K/Akt信号转导通路,从而促进多种促内皮生成因子的表达,诱导血管新生和重塑,使缺血脑组织建立适应性自我保护机制。
本研究结果显示,模型组I3 h大脑皮层PI3K蛋白表达量开始显著升高,且I/R3 d、I/R3 d、I/R6 d 的阳性表达量逐渐升高,PI3K蛋白的表达水平均高于假手术组,说明脑组织在缺血急性期即启动 PI3K/Akt 信号转导通路以对抗缺血缺氧环境。尼莫地平组大鼠在I3 h、I/R1 d、I/R3 d、I/R6 d的PI3K蛋白阳性表达水平均较模型组显著升高,而加用PI3K/Akt信号转导通路抑制剂后,PI3K蛋白阳性表达水平均较尼莫地平组显著下降,提示尼莫地平干预可提高 PI3K蛋白阳性表达水平,起到脑保护作用,而这种保护作用可被抑制剂阻断,说明启动PI3K/Akt信号转导通路可能是尼莫地平保护缺血脑组织的机制之一。同时,Akt在I3 h、I/R1 d、I/R3 d、I/R6 d各时间点的表达趋势与 PI3K表达基本一致,此结果提示,尼莫地平可能通过诱导 PI3K的高表达进一步激活下游Akt的表达,通过PI3K/Akt信号转导通发挥促血管生成和缺血脑组织保护作用。
综上,老龄大鼠I/R后,脑组织内可见微血管生成标记物 α-SMA 蛋白的表达,且随着脑 I/R 时间的延长,α-SMA 蛋白的表达量逐渐升高;尼莫地平对缺血脑组织的保护作用可能与提高脑缺血区α-SMA 、PI3K、Akt1的表达水平,激活PI3K/Akt 信号转导通路有关。
