神经导航结合术中神经电生理监测在治疗脑干肿瘤的疗效分析
2019-04-09王利清王宇李达胡安明孙炜
王利清,王宇,李达,胡安明,孙炜
(中国康复研究中心北京博爱医院神经外科,北京 100068)
脑干肿瘤是临床中手术难度较大的肿瘤之一,由于肿瘤生长位置特殊,外科手术切除对于神经外科医师是一种挑战。脑干的结构较为复杂,其中有影响人体生命中枢活动的重要的神经结构和连接高级神经中枢和躯体运动感觉的神经传导术,既往被认为是神经外科医师的手术禁区[1]。近年来,由于手术器材的不断发展和手术理念的更新,使脑干肿瘤的治疗不仅局限于放化疗,外科手术成为治疗脑干肿瘤的重要方式之一[2]。脑干肿瘤的外科治疗的严重并发症是手术过程中损伤肿瘤周围的重要神经核和神经传导术,因此术前对于肿瘤位置的评估和与周边结构的关系对于减少手术相关的严重并发症至关重要[3]。随着影像技术的不断进步,神经导航逐渐成为神经系统术前重要的评估手段,可与目前常用的影像学资料相互融合得出更为直观、准确的模型,在神经外科术前评估肿瘤的可切除性和制定科学的手术入路等方面具有重要的意义。由于常规手术切除脑干肿瘤对于周围重要神经核的干扰和损害发生率较高,因此正确评估肿瘤的精确位置至关重要[4-5]。然而,虽然神经导航能精确地评估患者术前的肿瘤位置,但术中由于手术原因导致脑脊液流失、神经组织水肿,常常会造成肿瘤相对移位,一定程度地增加了手术带来的神经损伤。因此,术中应用电生理监测能实时监控重要神经核的功能,对预防术中重要神经组织的损伤具有实时反馈的作用[6-7]。本研究为探究采用神经导航和术中神经电生理监测对于脑干肿瘤手术临床疗效,以期为临床中手术方式的选择提供参考。
1 资料与方法
1.1 一般资料
分析北京博爱医院2015年1月至2017年12月收治的诊断为脑干肿瘤的患者资料,根据患者临床表现、入院体格检查和CT或MRI检查诊断为脑干肿瘤。纳入标准:(1)年龄>18岁,男女不限;(2)有手术指证如占位效应、进行性加重的精神系统症状或肿瘤出血等;(3)术前评估肿瘤有可切除性。排除标准:(1)合并有其他器官、组织的恶性肿瘤;(2)有其他原发性神经系统疾病;(3)有免疫性疾病或使用免疫制剂者;(4)合并严重的肝肾功能障碍或严重的心肺功能不全者;(5)临床资料不全者。
本研究根据患者手术方式的不同,将患者分为观察组和对照组,观察组患者采用神经导航联合术中神经电生理监测,共纳入37例。对照组患者单纯采用神经电生理检测,共纳入25例。两组患者在性别、平均年龄、平均体质指数(BMI)、术前评估的肿瘤大小、部位及肿瘤性质方面比较,差异无统计学意义(P>0.05)。见表1。
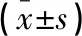
表1 两组患者一般临床资料的比较
1.2 治疗方法
所有患者入院前行常规术前检查,排除手术禁忌,调整术前血压、血糖等后给予手术治疗。所有患者术前行MRI成像,包含T1WI、T2WI、T2 Flair、T1增强和DTI成像图像。观察组患者术前将影像资料数据传入导航计划工作站中,制定手术入路计划。采用DTI纤维束示踪技术建立皮质脊髓束和内侧丘系神经纤维走形图像,DTI采用单次激发自旋回波平面成像,从25个方向实施扩散敏感梯度(b值取0,1 000 s/ram2,厚3 mm,无间距),将DTI原始数据输入至GEAW工作站,处理后生成DTI成像。将术前影响数据输入至导航计划工作站,制定术前计划。借助导航工具和体表标志制定出病灶的体表投影、手术计划入路和去除骨瓣等,将术前讨论的患者个体化方案传入至导航工作站用于术中神经功能导航。本研究的所有患者术中均给予连续监测诱发电位(evoked potentials,EPs)检测脑干功能,采用EpoachXP(美国Axon system公司)系统检测体感诱发电位(SSERs)、脑干听觉诱发电位(BAEPs)和脑干听觉诱发电位(BAEPs)或运动诱发电位(MEPs)。术中严密观察,当超过警报标准应及时告知术者并给予干预。所有患者术后即可入住ICU进行心肺功能监护和术后常规处理。
1.3 诊断标准和观察指标
患者手术前后神经功能的评估采用美国国立卫生研究院卒中量表(NIHSS)评分;评估患者术后生活质量采用日常生活能力量表(ADL)评分。比较两组患者平均住院时间和术后症状变化情况;分析比较两组患者术前24 h及术后3个月的NIHSS评分和ADL评分;比较两组患者术后并发症的发生率。
1.4 统计学分析
2 结果
2.1 两组患者症状变化情况及住院时间的比较
观察组患者术后症状好转人数比例高于对照组,比较差异具有统计学意义(P<0.05);两组患者术后症状无变化、症状加重和出现新发症状的比例比较,差异无统计学意义(P>0.05);观察组患者平均住院时间显著低于对照组,差异有统计学意义(P<0.05)。见表2。
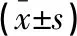
表2 两组患者出院时症状变化情况及住院时间的比较
2.2 两组患者NIHSS和ADL评分的比较
两组患者术前的NIHSS评分比较,差异无统计学意义(P>0.05);术后3个月,两组患者NIHSS评分均降低,但观察组患者降低程度高于对照组,差异有统计学意义(P<0.05)。两组患者术前的ADL评分比较,差异无统计学意义(P>0.05);术后3个月,两组患者ADL评分均升高,但观察组患者升高程度较对照组更加显著,差异有统计学意义(P<0.05)。
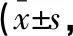
表3 两组患者手术前、后NIHSS和ADL评分的比较分)
**P<0.05,与组内术前比较;#P<0.05,与对照组比较。
2.3 两组患者术后并发症比较
两组患者术后出现皮下积液、脑水肿、脑积水和肺部感染等并发症的比例比较,差异无统计学意义(P>0.05)。
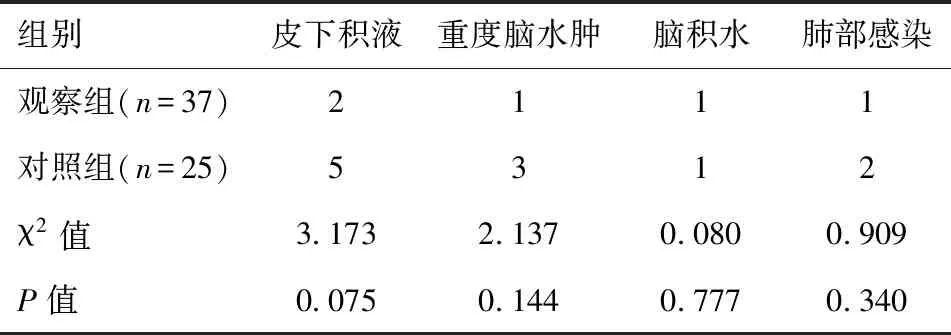
表4 两组患者术后并发症的发生情况的比较
3 讨论
脑干包含维持人体生命中枢的神经核和具有丰富的传导神经纤维,因此对于脑干肿瘤的外科治疗常具有较高的风险,对医生和患者是一种巨大的挑战[8]。理想的手术入路应是以最短的距离到达病灶,并避开重要的神经结构,但由于常规CT、MRI不能精确的显示神经核和纤细的神经纤维,增加了术前对手术入路选择的困难,导致手术过程中存在着一定的盲目性[9]。手术的操作常需要依赖经验丰富的医师,不仅增加外科医师的学习时间,还会引起神经损伤等并发症,因此术前直观精细的制定手术入路对于手术最终是否成功至关重要[10]。近年来,影像技术显著进步,神经导航技术逐渐应用在神经系统疾病的外科治疗的术前评估中,该技术不仅对疾病的诊断具有重要的意义,对患者术前评估肿瘤大小、与周围神经关系及制定科学安全的手术入路发挥着巨大的作用。但由于该模型的是参照患者术前病情制定的,术中手术的操作常因脑脊液流失导致周围压力减少、操作引起的神经组织水肿导致肿瘤偏位和去除肿瘤后引起的位置偏移等造成肿瘤位置改变,术中容易引起神经损伤[11]。术中使用神经电生理监测可对术中操作是否干扰、损伤正常周围神经核有一定的反馈性。当操作点靠近重要神经核时,通过检测的电信号变化及时了解是否靠近神经核,并反馈到主刀医师以避免损伤[12-13]。神经导航联合术中神经电生理监测理论上可显著减轻患者手术并发症,并提高手术疗效。因此,本研究探讨该手段的引用对脑干肿瘤外科手术的临床应用效果,以期为临床中手术方式的选择提供参考。
本组研究数据表明,观察组患者术后症状好转人数比例高于对照组,比较差异有统计学意义;两组患者术后症状无变化、症状加重和出现新发症状的比例比较,差异无统计学意义;观察组患者平均住院时间显著低于对照组,对比差异具有统计学意义。这提示神经导航联合应用神经电生理监测可提高患者术后症状的缓解率,说明该手术期间能精确、较大程度地切除肿瘤,接触压迫症状,不增加出现心症状的风险,是一种安全有效的手术方式。同时,能减少患者住院时间,说明该手术在良好的临床疗效的前提下能减轻对周围组织的损伤及操作引起的神经水肿等,加快患者术后恢复。研究数据表明,两组患者术前NIHSS评分无明显差异,术后3个月两组患者NIHSS评分均降低,但观察组患者降低程度高于对照组。两组患者术前ADL评分无明显差异,术后3个月两组患者ADL评分均升高,但观察组患者升高程度高于对照组。这提示神经导航联合应用神经电生理监测能提高患者术后远期神经功能恢复和日常生活质量,可能是由于术中对周围损伤较小,患者术后恢复较快,增加患者本人的恢复信心,患者愿意主动行康复锻炼。同时,精确的肿瘤切除增加了患者的病情缓解率,患者的治疗程度较大,增加了患者神经功能及术后生活质量。两组患者在术后常见并发症的发生比例上未见明显显著差异。因本文由于纳入样本量有限,结果可能存在一定的偏倚,今后工作中需要大样本、多中心研究加以验证。
综上,神经导航联合应用术中神经电生理监测在治疗脑干肿瘤中具有较好的临床疗效,能增加远期生活质量,值得临床中推广应用。
