miR-21调控PTEN/AKT通路影响LPS诱导下足细胞中MMP-2和MMP-9表达
2019-04-09陈翔黄莹龙春艺廖品琥
陈翔,黄莹,龙春艺,廖品琥
肾脏是脓毒症发生发展过程中损伤的主要靶器官,其中足细胞损伤是导致脓毒症并发急性肾损伤(AKI)的主要原因,而足细胞损伤的主要机制为内毒素和炎症介质作用导致基底膜(glomerular basement membrane,GBM)的降解与重塑,并进一步造成足细胞从GBM 上脱落[1],但具体机制尚未完全阐明。基质金属蛋白酶(MMP)-2、MMP-9可以通过分解GBM 主要成分Ⅳ型胶原参与GBM 重塑[2]。MMP-2、MMP-9在血清中的表达水平与脓毒症患者预后有关,提示两者可能通过调控GBM重塑影响预后[3]。同源性磷酸酶张力蛋白(phosphatase and tensin homology deleted on chromosome ten,PTEN)及磷酸化蛋白激酶B(phosphorylated protein kinase B,p-AKT)信号通路在足细胞损伤和GBM重塑中起着重要作用[4]。miRNA 是一类非编码调控RNA,通过与靶基因mRNA的3′非翻译区(3′UTR)结合负调节靶基因表达[5]。其中miR-21 在心脏成纤维细胞中表达上升,通过调控细胞外基质(ECM)及相关基因的表达,参与脓毒症时心脏损伤[6]。然而miR-21在脓毒症时足细胞损伤GBM 重塑中的作用和潜在机制尚不清楚。本研究通过探讨miR-21 对脂多糖(LPS)刺激下足细胞损伤模型中MMP-2、MMP-9表达的影响,并进一步探讨miR-21在PTEN/AKT 信号通路中对MMP-2、MMP-9 的调控机制,为临床诊断和治疗脓毒症并发AKI提供理论依据。
1 材料与方法
1.1 实验材料、仪器及试剂 小鼠足细胞购自上海中国科学院细胞库。DU530超微量紫外分光光度计(德国Beckman公司),ABI 7500 实时荧光定量聚合酶链反应仪(美国Applied Biosystems 公司)、伯乐1658001 电泳仪、转膜仪(美国BIORAD 公司),MultiskanMK3 酶标仪(赛默飞世尔科技有限公司),JS-680B 全自动凝胶成像系统(上海培清科技有限公司)。MMP-2、MMP-9酶联免疫吸附试验(ELISA)试剂盒(美国R&D公司),PCR引物、miRNA提取试剂盒、反转录试剂盒和荧光定量试剂盒(北京天根科技公司),miR-21 抑制剂(inhibitor)、模拟物(mimic)和对照物(上海吉码公司),MMP-2、MMP-9、PTEN、AKT和p-AKT一抗及辣根过氧化物酶标记的山羊抗兔二抗(美国Abcam公司)。
1.2 方法
1.2.1 脓毒症AKI 相关miRNA 生物信息学分析 本研究在GEO 数据库中的检索关键词为sepsis、sepsis microRNAs、sepsis AKI、sepsis AKI microRNAs 并补充检索Google Scholar和百度学术,在不同时间点检索2 次,纳入芯片集在2010年后,没有语言限制。
1.2.2 细胞培养 将足细胞接种于含10%胎牛血清培养基中,置于37 ℃、5%CO2恒温培养箱常规培养,每2 d换液1次,根据细胞生长情况进行传代。
1.2.3 LPS 浓度选择 将密度为1.0×105个/孔的足细胞接种于6孔板中过夜,按随机数字表法分为正常对照组、1、5和10 mg/L LPS组,每组3个复孔。分别给予0、1、5、10 mg/L LPS刺激24 h,构建足细胞损伤模型。正常对照组给予相同体积的PBS。将培养板置于37 ℃培养箱中培养24 h。采用Western blot 检测各组MMP-2、MMP-9 蛋白表达。根据Western blot结果选取最适宜的脂多糖浓度。
1.2.4 ELISA 检测MMP-2、MMP-9 蛋白表达 按照试剂盒说明书,采用ELISA法检测各组MMP-2、MMP-9表达水平。
1.2.5 细胞模型建立及转染 将密度为1.0×105个/孔的足细胞接种于6孔板中过夜,按随机数字表法分为正常对照组、脂多糖组(LPS组)、miR-21模拟物组(miR-21 mimic 组)、miR-21 模拟物对照组(miR-21 mimic NC 组)、miR-21 抑制物组(miR-21 inhibitor 组)和miR-21 抑制物对照组(miR-21 inhibitor NC 组),每组3 个复孔。LPS 组给予10 mg/L LPS 刺激24 h,构建足细胞损伤模型。正常对照组给予相同体积的PBS。miR-21 mimic/inhibitor 组在含有细胞的1 500µL培养基的培养孔中加入miR-21-mimic/inhibitor-lipo 2000混合液混匀;miR-21 mimic/inhibitor NC 组加入相同剂量miR-21-mimic/inhibitor NC-lipo 2000 混合液混匀。培养6 h 后,将含混合液的培养基移去,更换新鲜培养基,加入10 mg/L LPS,将培养板置于37 ℃培养箱中培养24 h。
1.2.6 PTEN 过表达与沉默 将密度为1.0×105个/孔的足细胞接种于6 孔板中过夜,按随机数字表法分为正常对照组、LPS组、PTEN 过表达组、PTEN 过表达对照组、PTEN 沉默组、PTEN 沉默对照组,每组3 个复孔。LPS 组给予10 mg/L LPS刺激24 h,构建足细胞损伤模型。正常对照组给予相同体积的PBS。按照Lipofectamine2000操作说明进行操作,PTEN过表达组中将pCDNA3.1-PTEN转染至足细胞中,PTEN沉默组将shRNA-PTEN 转染至足细胞中。PTEN 过表达对照组和PTEN沉默对照组分别给予转染对照质粒。培养6 h后,将含混合液的培养基移去,更换新鲜培养基,加入10 mg/L LPS,将培养板置于37 ℃培养箱中培养24 h。
1.2.7 荧光定量PCR 检测miR-21基因表达 取传3~8代的足细胞,按6×105个/孔接种于6 孔板中,37 ℃、5%CO2恒温孵箱中培养12 h 后,去掉培养基。LPS 组加入10 mg/L LPS,对照组加入等量PBS,刺激6 h 后用离心柱法提取总RNA。按照反转录和荧光定量PCR试剂盒说明书进行逆转录和荧光。以U6为内参,数据采用2-ΔΔCt法进行分析,其中,ΔCt=Ct目的基因-Ct内参基因,ΔΔCt=ΔCt LPS组-ΔCt正常对照组。
1.2.8 Western blot 检测蛋白表达 取LPS 刺激后24 h 的各组细胞,加入细胞裂解液后提取蛋白,并用BCA 法检测蛋白浓度。取60µg 蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳结束后转膜至聚偏二氟乙烯(PVDF)膜,室温封闭1 h,分别加入MMP-2(1∶1 000)、MMP-9(1∶1 000)、PTEN(1∶1 000)、AKT(1∶1 000)、p-AKT(1∶1 000)一抗,同时以甘油醛-3-磷酸脱氢酶(GAPDH,1∶5 000稀释)为内参,4 ℃孵育过夜,TBST 清洗3 次,每次10 min。加入辣根过氧化物酶标记的山羊抗兔二抗(1∶5 000),室温孵育1 h,TBST清洗3次,每次10 min。洗膜结束后用凝胶成像系统进行显影。
1.3 统计学方法 采用SPSS 21.0软件进行统计分析。符合正态分布的计量资料用表示,2组间比较用成组t检验,多组间比较用单因素方差分析,组间多重比较采用LSD-t法,采用Pearson法行相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 脓毒症AKI 相关miRNA 生物信息学分析 选取的数据集为GSE94717,芯片标本分别来自健康人和脓毒症AKI 患者,应用3例健康人和6例脓毒症AKI 患者样本的标准化表达数据,根据是否有统计学意义(P<0.05)及其差异倍数(>2)进行分析筛选,符合条件的差异表达的miRNA 共有231 个,部分差异miRNA表达情况见表1。由于差异表达的miRNA数据相对较多,结合前期研究和文献分析选取miR-21作为研究对象。
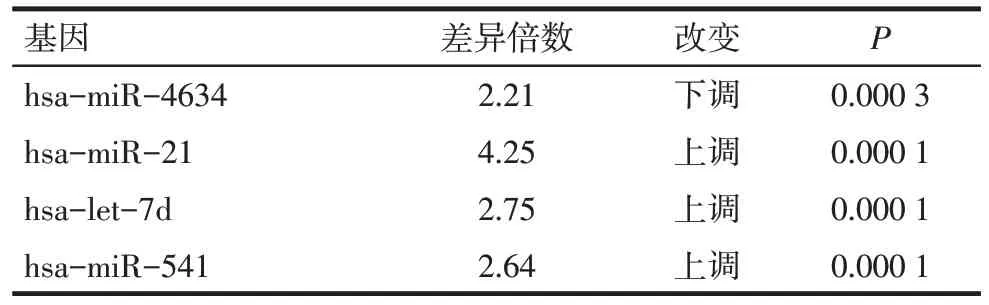
Tab.1 Differentially expressed miRNA in GSE94717表1 GSE94717中部分差异表达的miRNA
2.2 各组miR-21 和MMP-2、MMP-9 表达及相关性分析 不同浓度LPS 刺激后,足细胞MMP-2 和MMP-9 蛋白表达水平升高,且呈浓度依赖性,见图1。本研究选取10 mg/L的LPS处理细胞。荧光定量PCR 和ELISA 结果显示,LPS 组足细胞miR-21、MMP-2、MMP-9蛋白表达量升高(均P<0.01),见表2。LPS组中miR-21与MMP-2、MMP-9的表达呈正相关(r分别为0.462、0.534,均P<0.05)。

Fig.1 Effects of different doses of LPS on expressions of MMP-2 and MMP-9 in podocytes图1 不同剂量LPS对足细胞MMP-2、MMP-9表达的影响
2.3 miR-21促进LPS刺激下足细胞MMP-2、MMP-9 表达 miR-21 抑制物处理后,MMP-2、MMP-9 蛋白表达下降,差异有统计学意义(均P<0.05);miR-21模拟物处理后,MMP-2、MMP-9蛋白表达升高,差异有统计学意义(均P<0.05)。见图2、表3。
2.4 miR-21 靶向PTEN 参与LPS 刺激下足细胞损伤 miR-21靶基因分析结果显示,miR-21与PTEN序列高度互补,PTEN可能为miR-21的靶基因,见表4。抑制miR-21 表达,PTEN 表达上升,p-AKT 表达降低(均P<0.05);miR-21 表达升高,PTEN 表达降低,p-AKT表达升高(均P<0.05),见图2、表5。
Tab.2 Comparison of expression levels of miR-21,MMP-2 and MMP-9 between the two groups表2 2组miR-21、MMP-2和MMP-9表达水平比较(n=20,)

Tab.2 Comparison of expression levels of miR-21,MMP-2 and MMP-9 between the two groups表2 2组miR-21、MMP-2和MMP-9表达水平比较(n=20,)
**P<0.01
组别正常对照组LPS组t miR-21(2-ΔΔCt)1.00±0 3.03±0.56 16.293**MMP-2(mg/L)47.70±19.42 134.12±22.89 12.873**MMP-9(mg/L)59.45±15.96 107.31±47.76 4.250**

Fig.2 Effects of miR-21 mimic/inhibitor on MMP-2,MMP-9,PTEN and p-AKT protein expressions图2 miR-21 模拟物/抑制物对MMP-2、MMP-9、PTEN和p-AKT蛋白表达的影响
Tab.3 The relative expression of MMP-2 and MMP-9 protein in six groups表3 各组MMP-2、MMP-9相对表达量比较(n=3,)
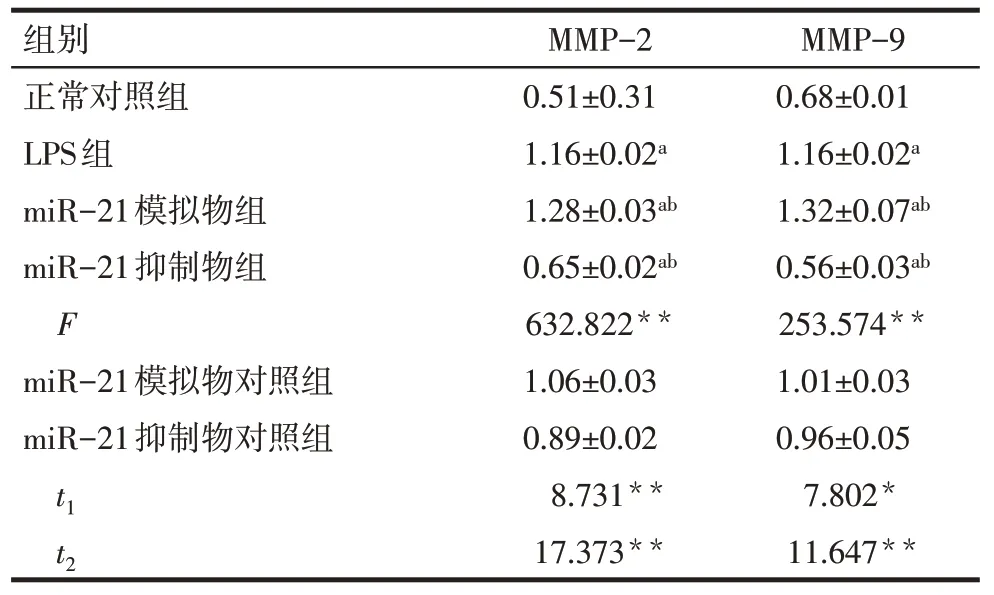
Tab.3 The relative expression of MMP-2 and MMP-9 protein in six groups表3 各组MMP-2、MMP-9相对表达量比较(n=3,)
*P<0.05,**P<0.01;a与正常对照组比较,b与LPS 组比较,P<0.05;t1:miR-21 模拟物组与miR-21 模拟物对照组比较,t2:miR-21抑制物组与miR-21抑制物对照组比较;表5、6同
组别正常对照组LPS组miR-21模拟物组miR-21抑制物组F miR-21模拟物对照组miR-21抑制物对照组t1 t2 MMP-2 0.51±0.31 1.16±0.02a 1.28±0.03ab 0.65±0.02ab 632.822**1.06±0.03 0.89±0.02 8.731**17.373**MMP-9 0.68±0.01 1.16±0.02a 1.32±0.07ab 0.56±0.03ab 253.574**1.01±0.03 0.96±0.05 7.802*11.647**
2.5 PTEN/AKT 参与LPS 刺激下足细胞MMP-2、MMP-9蛋白表达 抑制PTEN表达,p-AKT、MMP-2和MMP-9 蛋白表达上升(均P<0.05);过表达PTEN,p-AKT、MMP-2 和MMP-9 蛋白表达下降(均P<0.05)。见图3、表6。

Tab.4 Bioinformatics analysis and prediction results表4 生物信息学分析预测结果
Tab.5 Comparison of the relative expression of PTEN and p-AKT protein between six groups表5 各组PTEN、p-AKT相对表达量比较 (n=3,)

Tab.5 Comparison of the relative expression of PTEN and p-AKT protein between six groups表5 各组PTEN、p-AKT相对表达量比较 (n=3,)
组别正常对照组LPS组miR-21模拟物组miR-21抑制物组F miR-21模拟物对照组miR-21抑制物对照组t1 t2 PTEN 0.73±0.04 0.84±0.02a 0.84±0.04a 0.67±0.01ab 18.397*0.85±0.02 0.82±0.04 7.916*1.135 p-AKT 0.52±0.01 0.47±0.01a 0.96±0.04ab 0.65±0.04ab 128.523**0.77±0.04 0.83±0.02 5.962*7.311*AKT 0.66±0.01 0.65±0.02 0.63±0.03 0.50±0.02ab 53.393*0.61±0.02 0.56±0.02 6.087*2.662

Fig.3 Effects of pcDNA 3.1-PTEN and shRNA-PTEN on MMP-2,MMP-9 and p-AKT protein expressions图3 过表达/沉默PTEN对MMP-2、MMP-9和p-AKT蛋白表达影响
Tab.6 Comparison of the relative expressions of MMP-2,MMP-9 and p-AKT protein between six groups表6 各组MMP-2、MMP-9和p-AKT相对表达量比较(n=3,)

Tab.6 Comparison of the relative expressions of MMP-2,MMP-9 and p-AKT protein between six groups表6 各组MMP-2、MMP-9和p-AKT相对表达量比较(n=3,)
组别正常对照组LPS组PTEN过表达组PTEN沉默组F PTEN过表达对照组PTEN沉默对照组t1 t2 MMP-2 0.66±0.01 1.07±0.02a 0.87±0.01ab 1.28±0.02ab 686.960**1.13±0.01 1.09±0.01 37.277**11.897*MMP-9 0.66±0.01 0.82±0.03a 0.67±0.01b 0.92±0.01ab 144.586**0.81±0.02 0.79±0.01 71.768**16.350*p-AKT 0.30±0.00 1.12±0.03a 0.73±0.01ab 1.26±0.04ab 1039.652**1.12±0.03 1.15±0.03 21.264**6.203*AKT 0.65±0.01 0.64±0.03 0.61±0.03 0.64±0.04 24.504 0.63±0.05 0.63±0.04 2.217 3.719
3 讨论
脓毒症出现肾损害时预示病情危重且预后不良,因此,脓毒症AKI的早期诊断和治疗是脓毒症治疗的关键。本研究通过探讨miR-21 对脓毒症足细胞损伤模型中MMP-2、MMP-9 表达的影响,并进一步探讨miR-21的可能调控机制,为临床诊断和治疗脓毒症AKI提供理论依据。
3.1 MMP-2、MMP-9在LPS刺激下足细胞中表达升高 MMP-2、MMP-9 是可以降解GBM 的基质金属蛋白酶家族的成员,被认为是一种具有潜在诊断价值的脓毒症标志物,然而MMP-2、MMP-9 在脓毒症足细胞损伤模型中的表达水平及与足细胞损伤的关系尚不明确。本研究通过构建脓毒症足细胞损伤模型,在LPS 刺激下,足细胞MMP-2、MMP-9 表达上升,提示MMP-2、MMP-9 可能参与脓毒症足细胞损伤,同时两者表达随LPS浓度上升而升高,提示两者的表达水平可能反映脓毒症时足细胞的损伤程度。这与既往研究结果一致,既往研究结果发现,脓毒症患者血清中高水平的MMP-2、MMP-9 提示预后不良[3],且与低水平MMP-2、MMP-9患者相比,发生多器官功能障碍综合征的可能性升高[7-8]。因此,MMP-2、MMP-9能够作为生物标志物诊断及判断脓毒症AKI患者预后。
3.2 miR-21在LPS刺激下足细胞中表达升高 LPS刺激MMP-2、MMP-9 表达升高的同时也介导miR-21表达升高。通过基因芯片分析,我们发现miR-21在脓毒症AKI中差异表达,然而miR-21在脓毒症足细胞损伤中的表达变化和具体作用尚不清楚。通过构建脓毒症足细胞损伤模型,笔者发现LPS 刺激下的足细胞miR-21表达升高,这与基因芯片分析的结果相一致。然而,此结果与先前的一项研究结果相悖。该研究观察到LPS 刺激后miR-21 的变化是动态的,6 h 内miR-21 表达升高,但无统计学意义[9]。导致本研究结果与该研究结果相悖有以下可能:(1)选取不同类型的细胞进行研究。细胞的功能会受到细胞来源、组织特异性和激活方式的影响,同时LPS的促炎症作用具有细胞特异性。本研究使用的是足细胞,而该研究使用的是肺泡巨噬细胞NR8383。(2)LPS 干预剂量的差异。LPS 的促炎症作用具有剂量依赖性,不同剂量LPS具有不同的生物学效应,低剂量LPS 主要促进细胞增殖,高剂量LPS 可诱导炎症反应。本研究根据课题组前期研究基础选取10 mg/L的LPS,而该研究采用的LPS剂量为1 mg/L。
其次,LPS 诱导miR-21 和MMP-2、MMP-9 表达上升,且miR-21 与MMP-2、miR-21 与MMP-9 之间呈正相关,但两者之间是否存在调控关系尚不清楚。本研究通过构建miR-21过表达和抑制miR-21表达模型,结果发现过表达miR-21促进MMP-2、MMP-9的表达;而抑制miR-21能抑制MMP-2、MMP-9的表达。这与既往研究结果一致,既往研究观察到苏子油能通过抑制miR-21降低血管内皮细胞MMP-9表达[10]。同时miR-21 能通过PTEN 通路影响心脏成纤维细胞MMP-2表达[11]。这些结果表明miR-21可以影响MMP-2、MMP-9 表达,但具体调控机制尚不明确。
3.3 miR-21 对PTEN/AKT 通路的调控作用 为了进一步研究miR-21 调控MMP-2、MMP-9 表达的机制,通过生物信息学分析发现,miR-21与PTEN序列高度互补,PTEN 可能是miR-21 的靶基因。进一步发现过表达miR-21 可抑制PTEN 的表达,而抑制miR-21能促进PTEN的表达。这与生物信息学分析和既往研究结果一致,既往研究观察到在乳腺癌[12]、肝癌[13]细胞中,PTEN 是miR-21 的直接靶点。这些结果表明miR-21 可以影响PTEN/AKT 通路,但miR-21 是否通过PTEN/AKT 通路影响MMP-2、MMP-9的表达尚不清楚。
3.4 PTEN/AKT 通路对MMP-2、MMP-9 的调控作用 进一步研究发现,过表达PTEN 能抑制p-AKT、MMP-2 和MMP-9 表达,沉默PTEN 能促进p-AKT、MMP-2和MMP-9表达,结果显示PTEN/AKT可以影响MMP-2、MMP-9表达。而在本研究中,miR-21能靶向抑制PTEN/AKT 表达,miR-21 可能通过抑制PTEN/AKT 促进LPS 刺激下足细胞MMP-2、MMP-9表达。
综上,miR-21、MMP-2 和MMP-9 与脓毒症AKI的发生发展密切相关,监测脓毒症患者miR-21、MMP-2和MMP-9水平有利于及早发现脓毒症AKI,同时miR-21 可以通过抑制PTEN/AKT 通路的激活提高MMP-2、MMP-9 表达,对脓毒症AKI 患者及早进行以miR-21 为靶点的干预治疗可能取得较好效果,然而miR-21 调控GBM 降解与重塑的具体机制尚未阐明。目前已知PTEN 能抑制AKT/mTOR 自噬通路[14]。而本研究发现miR-21 会抑制PTEN/AKT通路激活,激活AKT/mTOR 通路而抑制自噬。miR-21 是否通过抑制自噬来调节GBM 重塑参与脓毒症AKI进程仍需进一步的研究。
