内源性孤啡肽通过调节β1肾上腺素能受体对大鼠缺血性心律失常的影响
2019-04-09熊畅韩毅郭政
熊畅,韩毅,2△,郭政,2
急性心肌梗死早期可出现严重的室性心律失常,是引起心源性猝死的重要原因[1]。在此过程中交感神经激活并释放大量儿茶酚胺[2],而心脏感觉神经同样被激活释放多种神经肽,包括降钙素基因相关肽(calcitonin gene-related peptide,CGRP)、P 物质(substance P,SP)以及孤啡肽(nociceptin/orphanin FQ,N/OFQ)[3-4]。这提示两种神经系统可能共同参与调节急性心肌梗死后的病理过程。研究表明,激动β-肾上腺素能受体通路具有致心律失常特性,而激动α-肾上腺素能受体通路具有抗心律失常作用[5]。本课题组前期研究发现拮抗内源性N/OFQ能够抑制缺血性心律失常的发生[6],但其具体调节途径尚不清楚。本研究旨在探讨内源性N/OFQ导致缺血性心律失常与β 肾上腺素能受体通路的关系,进一步探讨交感神经与心脏感觉神经在急性心肌缺血早期的相互作用。
1 材料与方法
1.1 材料 (1)实验动物。SPF 级健康成年雄性SD 大鼠60只,购自解放军军事医学科学院实验动物中心,许可证号:SCHK(京)2014-0013,6~8周龄,体质量250~280 g,适应性喂养1周。(2)实验试剂。孤啡肽受体拮抗剂UFP-101(英国Tocris Cookson 公司);膜蛋白提取试剂盒(美国Invent公司);兔抗大鼠β1-AR、Na/K-ATPase、GAPDH 一抗以及羊抗兔HRP-IgG 二抗(英国Abcam 公司)、总RNA 提取试剂盒(9767)、逆转录试剂盒(RR047A)以及扩增试剂盒(RR820A)均购于日本Takara公司。(3)实验仪器。AlC-V8小动物呼吸机(上海澳尔科特公司);RM6240BD 电生理信号记录仪(成都仪器厂);MX3005P实时荧光定量PCR仪(上海拜力生物科技有限公司);ChemiDoc XRS凝胶成像分析系统(Bio-Rad公司);分光光度计(UV-2800H,上海尤尼柯公司)。
1.2 方法
1.2.1 实验分组 采用随机数字表法分为3组(n=20):假手术组(Sham 组)、结扎左冠状动脉前降支(冠脉)组(CAO 组)和孤啡肽受体拮抗剂(UFP-101)预处理组(U+CAO组),每组在冠脉结扎后15 min和1 h各处死10只取缺血区心肌,故每组按照时间点又分为2个亚组,共6个亚组。Sham组仅开胸穿线但不结扎冠脉;CAO 组开胸后结扎左冠状动脉前降支;U+CAO 组在结扎冠脉前10 min 经尾静脉按1 mL/kg 注射特异性孤啡肽受体拮抗剂UFP-101(1×10-9mol/L),其余2组给予等容量生理盐水。
1.2.2 建立大鼠急性心肌缺血模型 大鼠称质量后以质量分数为25%的乌拉坦(1.2 g/kg)进行腹腔注射麻醉,将大鼠仰卧位固定于操作台上连接生物信号采集系统记录标准Ⅱ导联心电图。气管切开置入气管导管,连接小动物呼吸机施行机械通气,呼吸机潮气量设为8 mL/kg,呼吸频率70 次/min。稳定15 min 后,按1 mL/kg 经尾静脉分别注入生理盐水或UFP-101。10 min 后在左侧第四肋间隙开胸,以5-0 无损伤缝线的弯针从左心耳右缘进针,肺动脉圆锥左缘出针结扎左冠状动脉前降支。而后可见Ⅱ导联心电图出现ST段逐渐抬高并渐与QRS 波融合,心肌前壁组织变苍白色随后出现紫绀,可有心律失常出现,提示造模成功。
1.2.3 大鼠心律失常评分 根据参考文献[7]进行心律失常评分,评分标准如下:0分,冠脉结扎后1 h内共出现<50个室早(ventricular ectopic beats,VEB),包括单发室早、室早二联律、室早三联律。1分,出现≥50个VEB。2分,出现1~5次室速(ventricular tachycardia,VT)。3分,出现≥6次VT。4分,出现1次室颤(ventricular fibrillation,VF)。5分,出现2~5次VF。
1.2.4 细胞膜以及全细胞β1-AR 蛋白含量测定 利用膜蛋白提取试剂盒处理提取组织膜蛋白,加入裂解液,分装后于-80 ℃保存。另外,称取部分组织按正常步骤提取总蛋白,分装后于-80 ℃保存。将分装蛋白利用BCA 法进行蛋白定量,依次进行SDS-PAGE凝胶电泳、转膜、5%脱脂奶粉封闭2 h 后,加入β1-AR 一抗(稀释度为1∶1 000)摇匀后4 ℃孵育,摇床过夜,加入二抗室温孵育1 h。TBST 清洗,3 次×10 min。应用Quantity One 图像分析软件测定各蛋白条带的灰度值。细胞膜组分中,以β1-AR条带灰度值与内参Na/K-ATPase灰度值的比值反映其表达水平;全细胞组分中,以β1-AR条带灰度值与内参GAPDH灰度值的比值反映其表达水平。
1.2.5 β1 mRNA表达测定 称取20~30 mg组织提取总RNA,通过紫外可见分光光度计测定并评估总RNA纯度,然后逆转录合成cDNA。引物序列取自NCBI Nucleotide Database数据库,经Primer软件设计与检验,由Takara生物有限公司合成。β1-AR上游引物5′-CTGCTACAACGACCCCAAGTG-3′,下游引物5′-AACACCCGCAGGTACACGAA-3′,产物长度120 bp;内参GAPDH上游引物5′-ACCACAGTCCATGCCATCAC-3′,下游引物5′-TCCACCACCCTGTTGCTGTA-3′,产物长度452 bp。将合成的cDNA进行PCR反应,反应条件:95 ℃预变性60 s;95 ℃变性20 s,55 ℃退火40 s,72 ℃延伸60 s,共40个循环。采用2-ΔΔCt法对目的基因进行相对定量分析。
1.3 统计学方法 应用SPSS 13.0 软件进行统计分析,正态分布计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,检验水准α=0.05。非正态分布计量资料以M(P25,P75)表示,采用Kruskal-Wallis H检验,组内两两比较采用Mann-Whitney U检验,并对检验水准α′按Bonferroni法进行校正。
2 结果
2.1 模型建立情况 实验过程出现缺血性心律失常只做记录不予抗心律失常处理,本实验Sham组和U+CAO 大鼠全部存活至实验结束,CAO 组1只大鼠未到实验结束便死于室颤,将其剔除并重新补充标本。大鼠心肌缺血前后不同时间点心电图变化如图,见图1。

Fig.1 Changes of ECG at different time points before and after coronary artery occlusion in rats图1 大鼠心肌缺血前后不同时间点心电图变化
2.2 心肌缺血后室性心律失常的时间分布 Sham组大鼠心肌穿线后可出现单发VEB,无VT、VF 发生。CAO 组和U+CAO 组大鼠CAO 后均出现缺血性心律失常,且心律失常发生集中于缺血后15 min 内并在15 min 左右达到高峰,30 min 后无心律失常出现。CAO 组大鼠缺血1 h 内心律失常的时间分布情况见表1。
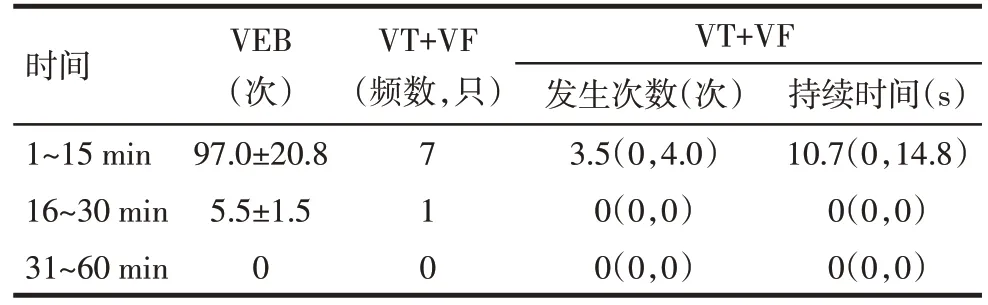
Tab.1 Temporal distribution of arrhythmias in CAO group within 1 hour of ischemia表1 CAO组大鼠缺血1 h内心律失常的时间分布(n=10)
2.3 各组大鼠缺血性心律失常的比较 与Sham 组比较,U+CAO 组和CAO 组均出现缺血性心电图改变,VEB次数、VT+VF 发作次数、持续时间及心律失常评分明显上升(P<0.05 或P<0.017)。与CAO 组比较,U+CAO 组VEB 次数、VT+VF 持续时间及心律失常评分明显下降(P<0.05 或P<0.017),而VT+VF的发生次数差异无统计学意义,见表2。

Tab.2 Comparison of cumulative arrhythmias within 1 hour after CAO in three groups of rats表2 3组大鼠冠脉闭塞后1 h内累计心律失常的比较(n=10)
2.4 β1-AR 蛋白及mRNA 的表达 15 min 时,与Sham 组比较,CAO 组全细胞β1-AR 表达下调,而细胞膜β1-AR 上调,β1-AR mRNA 表达下调(均P<0.05),U+CAO 组全细胞β1-AR、β1-AR mRNA 表达差异无统计学意义(P>0.05),而细胞膜β1-AR 下调(P<0.05);与CAO 组比较,U+CAO 组全细胞β1-AR 表达上调,而细胞膜β1-AR 下调,β1-AR mRNA表达上调(均P<0.05),见图2,表3。1 h时,与Sham组比较,CAO 组和U+CAO 组全细胞β1-AR 表达上调,而细胞膜β1-AR 下调,β1-AR mRNA 表达上调(均P<0.05),见图3,表4。

Fig.2 Expression of β1-AR in plasma membrane and whole cell detected by Western blot assay at 15 min after coronary artery occlusion in three groups of rats图2 CAO后15 min Western blot检测各组β1-AR在细胞膜和全细胞的表达
Tab.3 Comparison of relative expressions of β1-AR and its mRNA at 15 min after coronary artery occlusion between three groups of rats表3 3组大鼠CAO后15 min β1-AR蛋白及其mRNA相对表达水平比较(n=10,)

Tab.3 Comparison of relative expressions of β1-AR and its mRNA at 15 min after coronary artery occlusion between three groups of rats表3 3组大鼠CAO后15 min β1-AR蛋白及其mRNA相对表达水平比较(n=10,)
**P<0.01;a与Sham组比较,b与U+CAO组比较,P<0.05
组别Sham组U+CAO组CAO组F细胞膜β1-AR 0.763±0.049 0.676±0.060a 0.877±0.033ab 40.776**全细胞β1-AR 0.128±0.004 0.133±0.012 0.106±0.009ab 27.926**β1-AR mRNA 1.014±0.034 1.054±0.060 0.785±0.025ab 101.199**

Fig.3 Expressions of β1-AR in membrane and whole cell detected by Western-blot assay at 1 h after coronary artery occlusion in three groups of rats图3 CAO后1 h Western-blot检测各组β1-AR在细胞膜和全细胞的表达
3 讨论
急性心肌梗死可引起心脏交感神经末梢儿茶酚胺的释放急剧增多,在最初的10~15 min,缺血区心肌儿茶酚胺含量可达正常组织的100~1 000 倍[8]。此外,早期研究发现急性心肌缺血导致心肌细胞膜上β受体增多(主要是β1受体),而其确切机制尚不完全清楚[9]。二者共同导致β肾上腺素能受体信号通路过度激活,介导缺血性心律失常的发生。一般认为,β 受体过度激活使得心肌细胞发生电生理改变,包括细胞内钙超载、细胞外钾积聚、传导减慢以及动作电位时程缩短等。目前循证医学证据亦表明β受体阻滞剂的应用可明显降低心肌梗死引起的心律失常,且是唯一降低病死率的药物[10-11]。
Tab.4 Comparison of relative expressions of β1-AR and its mRNA at 1 h after coronary artery occlusion between three groups of rats表4 3组大鼠CAO后1 h β1-AR蛋白及其mRNA相对表达水平比较 (n=10,)

Tab.4 Comparison of relative expressions of β1-AR and its mRNA at 1 h after coronary artery occlusion between three groups of rats表4 3组大鼠CAO后1 h β1-AR蛋白及其mRNA相对表达水平比较 (n=10,)
**P<0.01;a与Sham组比较,P<0.05
组别Sham组U+CAO组CAO组F细胞膜β1-AR 0.672±0.046 0.372±0.036a 0.352±0.037a 200.930**全细胞β1-AR 0.089±0.006 0.142±0.003a 0.140±0.010a 217.504**β1-AR mRNA 0.991±0.023 1.241±0.068a 1.212±0.064a 53.449**
N/OFQ同CGRP、SP等一样,是感觉神经末梢释放的神经肽。N/OFQ及其受体广泛存在于全身各器官系统,对于心血管系统、神经系统以及免疫系统等均有调节作用[12]。近年有研究发现急性心肌缺血时心肌、脊髓和胸段背根神经节N/OFQ 表达上调[4,12],这些均提示N/OFQ参与心脏病理过程调节。本课题组前期研究亦发现拮抗内源性N/OFQ能够减少缺血性心律失常发生,并确定其作用呈现剂量相关性[6]。本次研究根据前期结果选择UFP-101 最佳剂量(10-9mol/L,1 mL/kg)进行实验。
既往研究显示大鼠冠脉结扎后1 h内,心律失常出现在前30 min内[13]。本实验结果进一步表明心律失常集中在前15 min 内并于15 min 左右达到峰值。通过对比冠脉结扎后15 min 和1 h 2个时间点β1受体在全细胞以及细胞膜的变化情况,发现β1受体在急性心肌缺血早期呈现出动态变化的过程。与假手术组相比,缺血后15 min,β1受体显著外化,而全细胞β1受体及其mRNA下降,此时伴随室性心律失常的频繁发生;缺血后1 h,β1 受体出现内化,而全细胞β1受体及其mRNA增多,表现出少心律失常甚至无心律失常发生。当给予特异性孤啡肽受体拮抗剂拮抗内源性N/OFQ以后,出现室性心律失常的降低,与此同时,膜β1 受体显著下降。提示β1 受体在细胞膜的表达增多可能导致缺血性心律失常的发生,而拮抗内源性N/OFQ可通过下调急性心肌缺血早期心肌细胞膜β1 受体进而降低缺血性心律失常。另外,膜β1 受体与全细胞β1 受体的转录翻译呈现相反趋势,其机制尚不清楚。
本实验研究通过比较3组大鼠室性心律失常发生的时间分布以及相应时点β1 受体在心肌细胞的变化情况,揭示了急性心肌缺血早期(15 min)β1 受体在心肌细胞膜表达上调是导致缺血性心律失常的关键因素,而内源性N/OFQ 是介导急性心肌缺血早期心肌细胞膜β1 受体上调的因素之一。然而关于心肌缺血1 h 时细胞膜β1 受体下调的原因尚不清楚,推测有更多的机体自我保护机制参与其中调节。此外,目前关于感觉神经肽对于心血管系统的调控,主要以保护作用为主[14]。最近的研究表明,心脏CGRP 的保留能够减轻糖尿病大鼠心功能不全的发生[15-16],SP通过抑制急性心肌梗死后PKA活性调节心功能[17],甚至发挥抗心律失常作用[18]。而本实验研究发现内源性N/OFQ作用于外周通过上调心肌细胞膜β1受体展现出的致心律失常作用,是感觉神经对于心血管系统双重调控的重要补充。综上所述,内源性N/OFQ 可通过β1 肾上腺素能受体通路调节大鼠缺血性心律失常的发生。
