血清乳酸脱氢酶水平对索拉非尼治疗肝癌患者预后的影响
2019-04-08刘晓超陈志娟何创业
刘晓超 陈志娟 何创业
原发性肝癌是一种发病率高、预后差的恶性肿瘤,且由于肝癌症状隐匿,潜伏期长,绝大多数患者在确诊时已达中晚期,失去了手术机会。索拉菲尼是一种多激酶抑制剂,具有抑制肿瘤血管新生及肿瘤细胞繁殖的作用,可用于治疗晚期肝癌[1]。然而由于肝癌,肝硬化患者肝组织已经纤维化,肝内细胞缺氧,缺氧对肿瘤发展有益,影响了索拉非尼的药效发挥[2-3]。而在部分研究中,得出索拉非尼改善不能手术切除肝癌患者生存率的结论[4]。因此,对使用索拉非尼患者个体进行有效预测显得极为重要[9]。
研究表明,肝癌患者血清乳酸脱氢酶(LDH)水平与反映肿瘤侵袭性和肝纤维化程度相关,血清LDH水平可反映肿瘤内缺氧程度[5],因此推测血清LDH水平有望成为肿瘤的预测因素。最近,faloppi等[6]认为血清LDH水平是评价索拉非尼治疗肝癌患者预后的一个有用参数。此外,LDH对使用索拉非尼的直肠癌、小细胞肺癌和胰腺癌患者亦具有相似的预测作用[7-8]。然而,Sacco等[9]发现基线LDH水平与索拉非尼治疗的肝癌患者预后无相关性。针对这些有争议的结果目前还未得到清楚的解释。
本研究旨在探讨采用索拉非尼治疗的肝癌患者临床结局和安全性与血清LDH之间的关系,为临床上早期预测索拉非尼治疗肝癌患者预后提供依据,有利于优化临床决策。
资料和方法
一、病例资料
选择2011 年1月至2014年12月我院住院的经射频消融治疗的肝癌患者。入选标准:(1)经病理检查,符合原发性肝癌诊断标准;(2)Karnofsky评分60分以上,预计生存期2年以上;(3)年龄大于18岁小于80岁。排除标准:(1)肝性脑病、肝昏迷、曲张静脉出血;(2)严重肝肾功能异常、凝血功能障碍;(3)白细胞严重降低(<3.0×109/L)或严重贫血(血红蛋白<90 g/L);(4)转移性肝癌、肝硬化、胆管细胞癌、混合型肝癌。
二、治疗方案
患者第1次射频消融治疗后1周开始口服索拉非尼(拜耳药业),起始剂量为每次400 mg,2次/d,一个疗程4周,共进行6个疗程。每疗程开始前检查患者生命体征、血常规、肝肾功能,影像学检查评估肿瘤状态等,如出现不良反应则药量减半或暂停用药,待不良反应减轻后恢复初始剂量,若无不良反应出现则长期维持。
三、观察指标及疗效判定
疾病无进展生存时间(Progress Free Survival, PFS):患者从接受治疗开始,到观察到肿瘤复发或者发生死亡的时间。完全缓解(complete response, CR):所有靶病灶消失,无新病灶出现,且肿瘤标志物正常,至少维持4周。部分缓解(partial response, PR) :靶病灶最大径之和减少≥30%,至少维持4周。疾病稳定(stable disease, SD):靶病灶最大径之和缩小未达PR,或增大未达PD。疾病进展(progressive disease, PD):靶病灶最大径之和至少增加≥20%,或出现新病灶。客观有效率(Overall Response Rate, ORR) = CR + PR。临床获益率(Clinical remission rate, CBR) = CR + PR+SD。
四、统计学方法
采用 SPSS22.0进行统计学分析,计量资料采用使用(均数±标准差)表示,两组之间比较采用独立样本t检验;计数资料采用率(%)表示,两组之间比较采用卡方检验。采用Kaplan-Meier 方法分析中位疾病进展时间,log-rank检验,P<0.05表示差异有统计学意义。
结 果
一、患者临床资料比较
共纳入81例患者,根据LDH水平将其分为高LDH组与正常LDH组,LDH分别为(301.5±27.4) IU/L和(195.9±18.3) IU/L。高LDH组共41例,其中男性30例(73.17%),女性11例(26.83%);正常LDH组共40人,其中男性32例(80.00%),女性8例(20.00%)。两组年龄、性别构成比、白蛋白、胆红素、AST、ALT、LDH、ALP等指标相比均差异无统计学意义,详见表1。
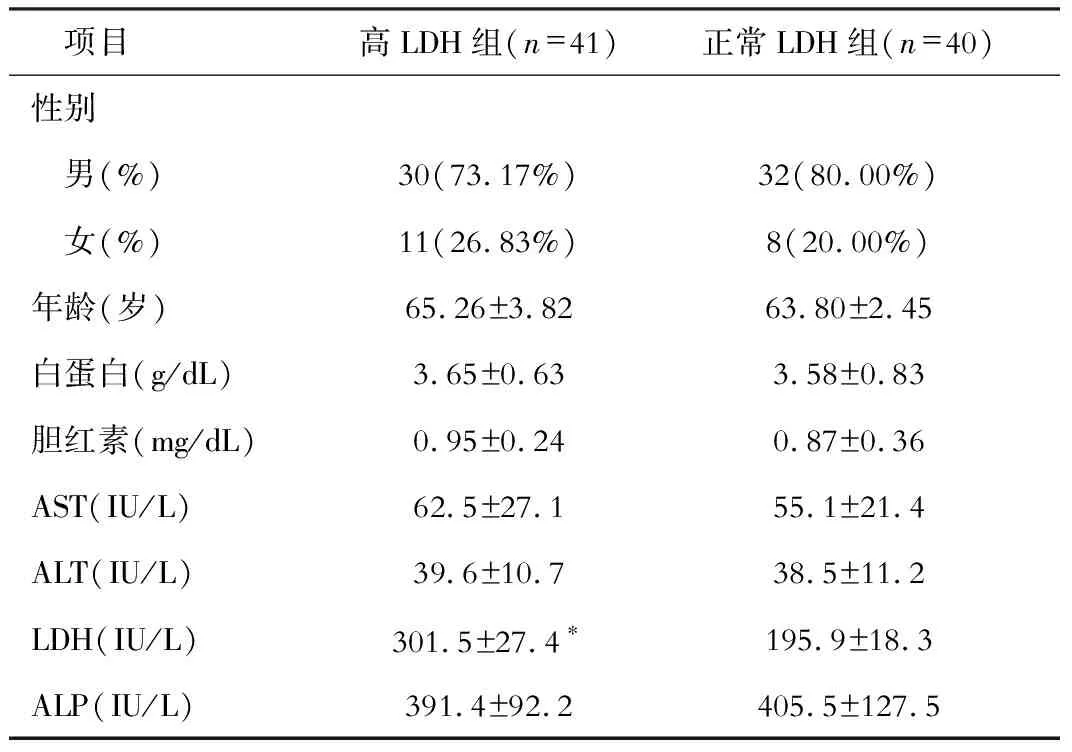
表1 两组患者临床资料比较
注:*为与正常组相比P<0.05
二、疾病无进展生存期
接受索拉非尼治疗的患者整体中位生存时间为16周,95%CI为10.12~21.88周。其中高LDH组中位生存时间为20周,95%CI为14.98~25.02周,正常LDH组中位生存时间为16周,95%CI为11.54~20.46周。Log-rank 检验P=0.032,风险比为2.79,95%CI为1.62~3.60。(图1)
三、临床疗效
高LDH组患者中共有14例达到客观有效,比例为34.15%;共有24例患者达到临床获益,比例为58.54%。正常LDH组患者中共有13例达到客观有效,比例为32.50%;共有22例患者达到临床获益,比例为55.00%,高LDH组患者临床获益显著高于正常LDH组,详见表2。
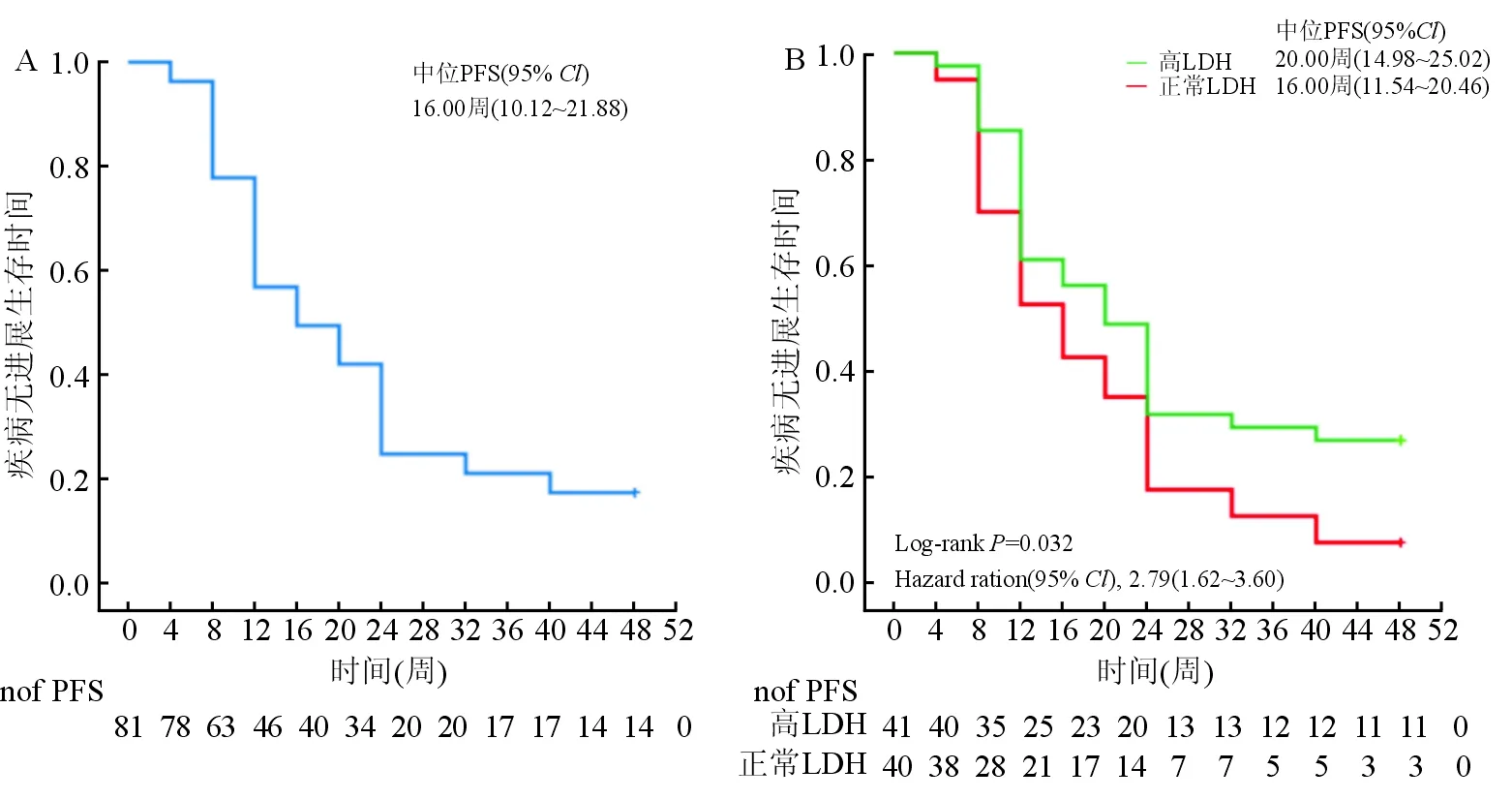
图1 A:接受索拉非尼治疗后患者的整体PFS,B:不同LDH水平患者的PFS
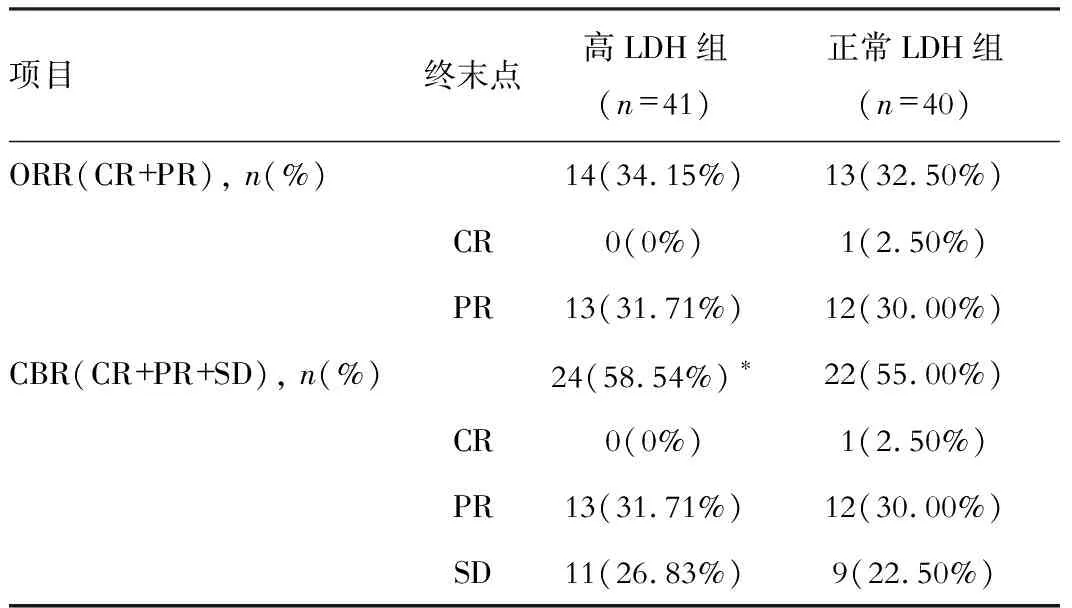
表2 临床疗效
注:*为与对照组相比,P<0.05
四、不良反应
高LDH组恶心/呕吐的发生率为15(36.59%),发热/乏力的发生率为20(48.78%),腹泻的发生率为10(24.39%),白细胞减少的发生率为0(0%),血小板减少的发生率为0(0%),皮疹的发生率为13(31.71%),肝功能损害的发生率为7(17.07%)。其中发热/乏力,白细胞减少与血小板减少等不良反应发生率与对照组相比显著降低。
讨 论
本研究结果显示,接受索拉非尼治疗的患者整体中位生存时间为16周,95%CI为10.12~21.88周。其中高LDH组中位生存时间为20周,95%CI为14.98~25.02周,正常LDH组中位生存时间为16周,95%CI为11.54~20.46周。Log-rank 检验P=0.032,风险比为2.79,95%CI为1.62~3.60(图1),说明两者相比差异有统计学意义,且高LDH患者在同一时间达到终点事件的概率较正常组低2.79倍。
此外高LDH组患者中共有14例达到客观有效,比例为34.15%;共有24例患者达到临床获益,比例为58.54%高于正常LDH组(表2),说明高LDH组患者有更好的临床结局。在不良反应中,高LDH组其中发热/乏力,白细胞减少与血小板减少等不良反应发生率与对照组相比显著降低,尤其在白细胞减少与血小板减少严重不良反应上,高LDH组的发生率均为0%,说明高LDH水平能够抵消部分索拉非尼带来的不良反应,提高用药的安全性。
LDH在组织中广泛存在,与肝组织纤维化与缺氧相关,而缺氧对于索拉非尼的疗效具有限制作用[5]。血清LDH水平是评价索拉非尼治疗肝癌患者预后的一个有用参数[6],而另外的研究则得出了相反的结论[9]。本研究却显示高水平的LDH能提高索拉非尼治疗肝癌患者的效果与安全性,但具体机制值得进一步研究证实。
