木麻黄和桤木离体根瘤和立地土壤的固氮酶与N2O还原酶活性的研究
2019-04-04马莹玲朱思佳曾思如马红亮尹云锋杨柳明高人
马莹玲, 朱思佳, 曾思如, 马红亮,2, 尹云锋,2, 杨柳明,2, 高人,3*
木麻黄和桤木离体根瘤和立地土壤的固氮酶与N2O还原酶活性的研究
马莹玲1, 朱思佳1, 曾思如1, 马红亮1,2, 尹云锋1,2, 杨柳明1,2, 高人1,3*
(1. 福建师范大学地理科学学院,福州 350007;2. 湿润亚热带山地生态国家重点实验室培育基地,福州 350007;3. 福建省植物生理生态重点实验室,福州 350007)
为了解非豆科固氮树种的固氮酶和N2O还原酶(Nos)活性,采用乙炔还原法和乙炔抑制技术对细枝木麻黄()和江南桤木()离体根瘤及立地土壤的两种酶活性进行了研究。结果表明,离体根瘤只在厌氧条件下有固氮酶活性,在好氧条件下有Nos活性。根瘤区根际土和非根瘤区根际土的固氮酶活性在好氧条件大于厌氧条件,Nos活性只表现在厌氧条件下。在好氧条件下,根瘤区根际土和非根瘤区根际土的固氮酶活性无显著差异; 根瘤区根际土的Nos活性显著大于非根瘤区根际土。除离体根瘤在好氧条件下不表现固氮酶活性外,细枝木麻黄和桤木的离体根瘤、根瘤区根际土和非根瘤区根际土的固氮酶活性均都大于Nos活性。好氧条件下根瘤区根际土的固氮酶活性与非根瘤区根际土的呈极显著正相关,而厌氧条件下根瘤的固氮酶活性与好氧条件下根瘤区根际土和非根瘤区根际土固氮酶活性、好氧条件下根瘤的Nos活性与厌氧条件下根瘤区根际土和非根瘤区根际土Nos活性均呈极显著负相关。这为研究弗兰克氏菌结瘤植物共生固氮体系对N2O汇强度的影响和调控奠定基础。
细枝木麻黄;江南桤木;共生固氮;离体根瘤;立地土壤;固氮酶;Nos
木麻黄(spp.)和桤木(spp.)是两种非豆科木本植物,在自然状态下能与弗兰克氏菌(spp.)共生形成根瘤,固定空气中的氮素[1],属于两个最主要的共生结瘤固氮体系的一种(另一种是豆科植物与根瘤菌)[2–3],因而成为重要的造林树种。弗兰克氏菌是一类根瘤内生菌[4],其固氮功能同根瘤菌(spp.)一样是在固氮酶的催化作用下进行的[5]。固氮酶的还原底物不只是氮气(N2),还包括氧化亚氮(N2O)在内的许多物质,固氮酶可以将N2O还原成N2,再还原成NH3[6],或直接一步还原成NH3[7]。有的固氮菌也具有反硝化能力[8]且存在负责反硝化作用的基因[9],有些固氮菌能够在氧化亚氮还原酶(Nos)的催化下将N2O还原成N2[10]。甚至由反硝化作用损失的氮量,数量上相当于根瘤菌共生固氮作用所获得的氮[11]。这就意味着固氮菌通过两大酶系统不但具有同化固定大气(土壤空气)中的N2能力, 还可能具有同化还原或异化还原大气(土壤空气)中N2O的能力,这对通过控制两大酶系统的作用来维持生态系统氮素平衡和减缓温室气体效应具有重要意义。
但以往的共生固氮研究,多以豆科作物共生固氮体系为研究对象[12–13],且多侧重于根瘤菌的固氮机理和固氮效应研究[14],结论多是围绕分离的内生菌的纯培养得出的[15]。对于共生体系的(离体)根瘤及其对立地土壤的研究不多,对木本非豆科植物共生体系的根瘤固氮酶和反硝化酶系统及与立地环境关系研究更是鲜见报道[13]。因此做出如下假设: 1、根瘤(因有内生菌)既具有固氮酶活性也具有Nos活性;固氮酶活性在好氧条件下大于厌氧条件下, Nos活性在好氧条件下小于厌氧条件下; 固氮酶活性大于Nos活性。2、根瘤区根际土和非根瘤区根际土都具有固氮酶活性且前者大于后者;根瘤区根际土和非根瘤区根际土都具有Nos活性且前者大于后者;立地土壤的固氮酶活性小于Nos活性。为了检验这些假设,本研究以两种非豆科植物细枝木麻黄()和江南桤木()的离体根瘤为材料,分别利用乙炔还原法和乙炔抑制法测定好氧和厌氧条件下的固氮酶和Nos活性,并探讨与立地土壤两种酶活性的关联性, 为今后进一步研究弗兰克氏菌结瘤植物共生固氮体系对N2O汇强度的影响和调控提供基础和依据。
1 材料和方法
1.1 材料
细枝木麻黄采自福建省惠安赤湖国有防护林场(24°35ʹ N,118°55ʹ E),所在地区属南亚热带海洋性季风气候,年均气温20.7℃,年均降水量1 241.8 mm,土壤为潮积或风积沙土。细枝木麻黄是营养袋扦插育苗后移植大田培育了1年的无性系植株。随机选取50株(平均株高0.89 m, 平均根径为0.54 cm, 叶片和根C/N分别为20.7和91.9),将其根系一侧土挖开, 将带有根瘤的侧根剪下,小心收集粘附于根瘤上的土壤作为根瘤区根际土(RSI, rhizospheric soil in nodule roots grown areas),取根际周围非根瘤区的土壤作为非根瘤区根际土(RSN, rhizospheric soil near nodule roots grown areas),分别装袋,将根瘤和土保存于冷藏箱中带回实验室。将采集的根瘤一部分用于培养实验,另一部分保存用于根瘤内生菌分离培养实验。取新鲜的细枝木麻黄根瘤,用水洗净表面后分成根瘤小瓣,水洗净,以95%乙醇浸泡30~60 s, 迅速用蒸馏水冲洗,以0.1% HgCl2表面灭菌5~10 min, 然后以无菌水洗数次,用滤纸吸干水分,移入灭菌的培养皿以备培养实验[16]。将带回实验室的根瘤区根际土和非根瘤区根际土挑除小石子、凋落物、根系等杂质,过2 mm孔径尼龙筛后装入自封袋密封保存。
江南桤木采自清流县嵩口镇速生林苗圃(26° 17ʹ N,116°94ʹ E),所在地区属于中亚热带季风气候,年平均气温17.9℃,年降雨量1 738 mm,平均海拔345 m,土壤以红壤分布最广。桤木是2年生的实生苗。随机选取20株(平均株高2.56 m,根径为2.13 cm, 叶片和根C/N分别为20.9和61.4),用相同方法收集根瘤、根瘤区根际土和非根瘤区根际土样品。培养实验在48 h内完成。
土壤的基本理化性质(表1)采用常规的分析方法[17]。用铝盒烘干法测定含水量;土壤pH用便携式pH计(Starter 300,上海)测定,水土比2.5∶1 (/); 总氮(TN, total nitrogen)、总碳(TC, total carbon)和碳氮比(C/N)采用CN元素分析仪(Elemental vario MAX analyzer,德国)测定;溶解有机氮(DON, dissolved organic nitrogen)用连续流动分析仪(Skalar San++, 荷兰)测定,溶解有机碳(DOC, dissolved organic carbon)采用TOC仪(TOC-VCPH, 岛津,日本)测定。

表1 土壤的基本理化性质
RSI: 根瘤区根际土; RSN: 非根瘤区根际土; TN: 总氮; TC: 总碳; DON: 溶解有机氮; DOC: 溶解有机碳。下表同。
RSI: Rhizospheric soil in nodule roots grown area; RSN: Rhizospheric soil near nodule roots grown area; TN: Total nitrogen; TC: Total carbon; DON: Dissolved organic nitrogen; DOC: Dissolved organic carbon. The same is following Tables.
1.2 培养试验
在好氧和厌氧条件下测定根瘤和土壤的固氮酶活性和Nos活性,固氮酶活性测定采用乙炔还原法,Nos活性采用乙炔抑制法。
离体根瘤试验 共设计8种处理,包括厌氧+根瘤+乙炔(处理1)、厌氧+根瘤(处理2)、好氧+根瘤+乙炔(处理3)、好氧+根瘤(处理4)、厌氧+乙炔(对照1),好氧+乙炔(对照2)、厌氧(空白1)、好氧(空白2),每个处理均3个重复,对照和空白各2个重复。称取适量根瘤(0.25~0.35 g)装入20 mL的培养瓶中,塞上橡胶塞,盖紧塑料盖;将处理1、处理2,对照1和空白1抽真空,用He洗气反复替换顶空气体3次制造厌氧条件;将处理3、处理4、对照2和空白2抽真空,向瓶内注入新鲜空气;随后在需要加乙炔的培养瓶中用注射器抽出10%瓶内体积的气体,注入等量乙炔气体。将瓶子置于25℃的培养箱中培养,分别于0和24 h时抽取10 mL气体,在岛津GC-2010气相色谱仪上测定C2H4, 载气为N2,流速30 mL min–1,色谱柱型号为Porapak TΦ4*2m,柱温60℃,进样器温度100℃,FID检测器温度280℃;在Shimadzu GC-2014 (日本)气相色谱仪上测定N2O,载气为95%Ar-CH4,流速30 mL min–1,ECD检测器温度为320℃,使用3 m长的Porapak Q (80/100目)分离柱,柱温70℃。
土壤实验 分别称取新鲜根瘤区根际土和非根瘤区根际土5 g,装入50 mL的培养瓶,盖紧丁基胶塞,用704硅胶密封,其他步骤与根瘤试验相同。
1.3 酶活性测定
固氮酶活性[18]用加乙炔与不加乙炔的处理所产生的乙烯浓度差来表征固氮酶活性大小,用对照来排除乙炔中的乙烯干扰,用空白来排除空气中的乙烯干扰,将实验处理所产生的乙烯通量减去对照和空白所产生的乙烯通量对数据进行校正。产生的C2H4浓度:C=1000×V×/(22.4R××), 式中,C为根瘤(土壤)在时刻的C2H4浓度(nmol C2H4g–1h–1),V为时刻土壤根瘤(土壤)中产生C2H4的体积(L),为标准大气压(kPa),为绝对温度(k),R为通用气体常数(8.31451 L kPa mol–1k–1),为干根瘤(烘干土)质量(g), 其中V=(C×V)/1000,C为时刻培养瓶顶部C2H4浓度(L L–1),V为培养瓶顶部空间的体积(mL)。
Nos活性[19]用加乙炔与不加乙炔处理所产生的N2O浓度差来表示,用空白来排除空气中的乙炔,将加乙炔与不加乙炔处理所产生的N2O通量减去空白所产生的N2O通量对数据进行校正。产生的N2O浓度:N=1000×V××28.0134/(R××), 式中,N为根瘤(土壤)在时刻的N2O-N浓度(ng N2O g–1h–1),V为时刻根瘤(土壤)中排放N2O的体积(L),其中V=C(V+water)/1000,water为根瘤(土壤)所含水分体积(mL),为溶解在水中N2O的Bunsen校正系数=0.544 (25℃)。
1.4 数据处理
采用Excel 2007进行数据整理,用SPSS 20.0软件对数据进行统计分析,变量间的显著性检验采用单因素方差分析法(ANOVA),用最小显著差数法(LSD)进行多重比较(=0.05),数据以平均值±标准差表示,相关分析采用Pearson相关系数。
2 结果和分析
2.1 固氮酶活性
从表2可见,两树种的离体根瘤在好氧条件下没有检测出固氮酶活性(负值),在厌氧条件下测出固氮酶活性,且细枝木麻黄是江南桤木的3.75倍(<0.01)。
细枝木麻黄根瘤区根际土的固氮酶活性在好氧和厌氧条件下无显著差异(>0.05);非根瘤区根际土的固氮酶活性在好氧条件下显著大于厌氧条件下(<0.01)。江南桤木根瘤区根际土的固氮酶活性在好氧条件下是厌氧条件下的14.5倍,达显著差异(<0.01);非根瘤区根际土的固氮酶活性在好氧条件下是厌氧条件下的40.3倍,达显著差异(< 0.01)。两树种的根瘤区根际土和非根瘤区根际土的固氮酶活性在好氧条件下都没有显著差异(< 0.05)。
2.2 Nos活性
从表2可见,在好氧条件下细枝木麻黄根瘤的Nos活性是江南桤木的11.7倍(<0.01);两树种在厌氧条件下都没有检测出Nos活性(负值)。
细枝木麻黄和江南桤木无论是根瘤区根际土还是非根瘤区根际土,都只在厌氧条件下检测出较弱的Nos活性,在好氧条件下没有检测出Nos活性(负值);两种树种厌氧条件下的Nos活性都表现出根瘤区根际土大于非根瘤区根际土,且达显著差异(<0.05),表明离根瘤越近的土壤Nos活性可能越大;江南桤木根瘤区根际土和非根瘤区根际土的Nos活性都显著大于细枝木麻黄的(<0.05)。
除离体根瘤在好氧条件下不表现固氮酶活性外, 细枝木麻黄和桤木无论是离体根瘤还是根瘤区根际土和非根瘤区根际土,固氮酶活性都大于Nos活性(<0.01)。
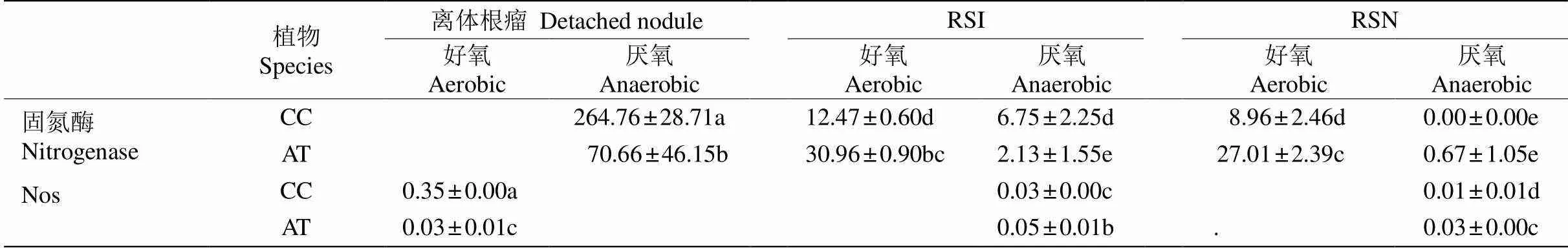
表2 细枝木麻黄(CC)和江南桤木(AT)离体根瘤、根瘤区根际土(RSI)和非根瘤区根际土(RSN)的固氮酶活性和Nos活性(ng N g–1h–1)
同行数据后不同字母分别表示差异显著(<0.05)。
Data followed different letters within line indicate significant differences at 0.05 level.
2.3 固氮酶和Nos活性的相关分析
由表3可见,固氮酶活性在厌氧条件下,根瘤与根瘤区根际土和非根瘤区根际土无显著相关性,根瘤区根际土与非根瘤区根际土也无显著相关性,而根瘤厌氧固氮酶活性与好氧条件下根瘤区根际土和非根瘤区根际土固氮酶活性均呈极显著负相关;好氧条件下根瘤区根际土固氮酶活性与非根瘤区根际土的呈极显著正相关;而固氮酶在其余处理间无显著相关。由表4可见,根瘤好氧条件下的Nos活性与厌氧条件下根瘤区根际土呈显著负相关,与厌氧条件下的非根瘤区根际土呈极显著负相关,而同在厌氧条件下,根瘤区根际土与非根瘤区根际土的Nos活性在处理间无显著差异。
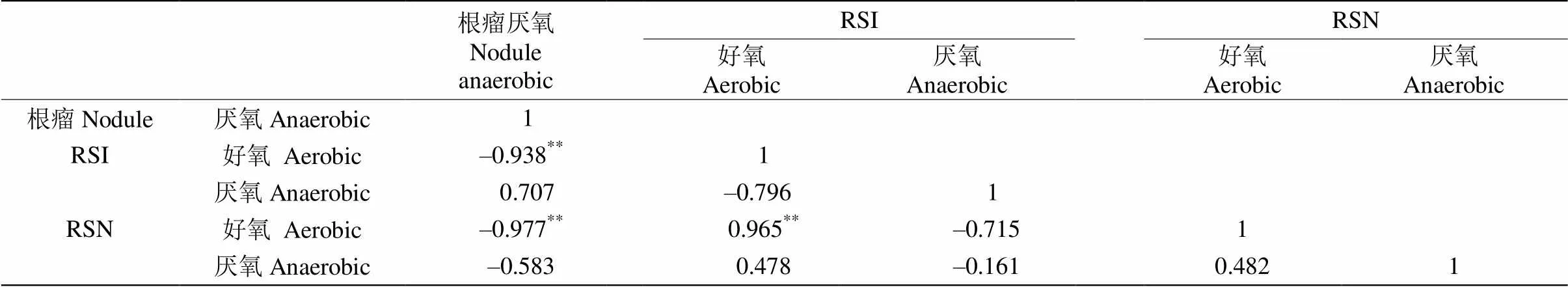
表3 固氮酶活性的Pearson相关系数
**<0.01

表4 Nos活性的Pearson相关系数
*:<0.05;**:<0.01
3 讨论和结论
3.1 固氮酶活性
一般根瘤菌是好氧菌[11],固氮酶在根瘤菌的固氮过程中起到催化的作用,但固氮酶对氧气十分敏感,过多氧气存在会阻碍固氮酶合成,从而导致固氮酶失活[20]。与根瘤菌一样,弗兰克氏菌也是一种好气菌,其与宿主共生固氮过程不含屏氧的血红蛋白,对氧气不是很敏感,在正常的氧分压下,不论是离体培养还是在根瘤中,弗兰克氏菌都能很好地进行固氮,在解决供氧和防氧的矛盾方面更适合共生[16]。但有研究表明,在弗兰克氏菌与细枝木麻黄的共生固氮体系中是存在防氧屏障的[21],一般共生固氮体系依赖与宿主之间的相互联系[11]。本试验中离体根瘤切断了共生固氮体系与宿主之间的联系,不能形成隔氧机制,因而,根瘤在好氧条件下检测不出固氮酶活性。本试验中的厌氧为人为制造的缺氧环境,为离体根瘤内生菌固氮酶创造了催化条件。这表明传统的离体好氧条件下测定离体根瘤的固氮酶活性在实际运用时要谨慎,在厌氧条件下测定更具科学性。另外,还可能与根瘤的离体时间有关,研究发现,长时间切断光合产物对根瘤的供应会使离体根瘤活力迅速下降[22],表明人为的厌氧条件减少了根瘤的能量损耗,使其固氮酶活性在厌氧条件下大于好氧条件。为验证此结果,未来应关注根瘤的原位试验。
土壤中存在多种自生固氮菌,自生固氮菌是利用土壤和空气中的氮进行固氮作用[23],一般地,自生固氮菌的固氮能力比共生固氮菌弱[24]。土壤中还广泛分布着自生根瘤菌[23]和自生弗兰克氏菌[25],固氮酶能催化土壤固氮菌进行固氮作用。自生固氮菌的固氮作用一般是在好氧条件下进行的[20],好氧自生固氮菌通过加强有氧呼吸将周围氧气吸收,保持低氧状态以保护固氮酶活性,执行正常的厌氧固氮过程[26]。有研究表明, 细胞内较低的O2浓度有利于提高生物体中固氮酶的潜在活性[20,27]。但在本研究中,两树种无论是根瘤区根际土还是非根瘤区根际土在好氧条件和厌氧条件下都表现出固氮酶活性, 说明两树种根际土的自生固氮菌中既具有好氧种类也具有厌氧种类。本研究结果还表明,除细枝木麻黄在厌氧条件外,两树种根瘤区根际土和非根瘤区根际土之间的固氮酶活性没有显著差异,表明在根系的有限范围内,好氧条件下的根瘤区根际土与非根瘤区根际土的固氮酶活性并无明显差异。这可能是,在本研究取样条件下,根瘤区根际土与非根瘤区根际土几乎相邻,没有明显区分。因此,未来应在取样条件上,严格划分根瘤区根际土与非根瘤区根际土来研究。
3.2 Nos活性
共生固氮菌既能进行固氮作用也能进行反硝化作用[11],反硝化是在厌氧条件下进行的[28],Nos是一种反硝化酶,能在反硝化的最后一步催化N2O还原[19]。Nos对O2十分敏感[7,19],O2的存在会抑制反硝化酶的作用从而使反硝化酶的活性降低[29]。有研究表明,存在好氧反硝化菌,反硝化酶在好氧和厌氧条件下都能合成[30],在O2存在时反硝化酶仍有较高活性[27],因此,在本试验中,根瘤在厌氧条件下检测不出Nos活性,表明在好氧条件下测定离体根瘤的Nos活性更具有科学性。固氮和反硝化是两种相互矛盾的生理过程,N2O是许多根瘤内生菌的反硝化作用的终产物,它是固氮酶的竞争性抑制剂,也能被还原为N2,N2又可进一步为固氮酶所还原,然后在根瘤内被同化[11]。根瘤菌的类菌体(根瘤)同时具有释放氮和固定氮的能力,已经在豌豆固氮菌的类菌体和其他一些固氮菌(,sp.)的菌株上观察到[11]。本研究在弗兰克氏菌的类菌体上观察到厌氧条件下的固氮酶活性和好氧条件下的Nos活性,且固氮酶活性大于Nos活性。但Nos失氮过程和固氮酶的固氮过程彼此在进化上有何好处及化学计量特征等还有待进一步研究。有研究表明在土壤的无氧环境中,维持根瘤的完整性对共生体的存在至关重要[31]。本研究中,离体根瘤切断了共生固氮体系与宿主之间的联系,这种人为扰动对固氮酶和Nos活性的影响还需进一步研究。
土壤中存在少量反硝化细菌,它们直接或间接参与土壤氮循环[32]。在根瘤菌内进行着N2的固定和反硝化两个相反的生理过程[33],因此,土壤中的根瘤菌也能参与反硝化作用[34]。本研究表明细枝木麻黄/桤木的根瘤区根际土和非根瘤区根际土只在厌氧条件下具有Nos活性,表明两树种的根瘤区根际土和非根瘤区根际土只能在厌氧条件下进行反硝化作用。通常认为,土壤反硝化是一个厌氧过程,反硝化酶活性和相关基因的表达会受到O2的严格抑制,产生N2O主要是厌氧反硝化过程[35],本研究结果表明,细枝木麻黄/桤木的根瘤区根际土和非根瘤区根际土只有在厌氧条件下具有Nos活性,这也证实了土壤反硝化是一个厌氧过程。研究表明,土壤表层是反硝化作用最主要的层次,而下层土壤的反硝化作用较为微弱[34]。本研究发现细枝木麻黄和桤木根瘤区根际土的Nos活性显著大于非根瘤区根际土,这表明根瘤区根际土由于离体根瘤距离较近,受到根瘤共生固氮菌反硝化的影响,导致其Nos活性要强于非根瘤区根际土。本研究结果表明,土壤同时具有固氮酶活性和Nos活性,但土壤中Nos是较低的[33]。本研究结果表明,除离体根瘤在好氧条件下外,立地土壤的固氮酶活性大于Nos固氮细菌活性符合这一规律。
3.3 固氮酶和Nos活性的相关关系
相关分析表明,根瘤厌氧固氮酶与好氧条件下两种根际土及根瘤好氧Nos与厌氧条件下两种根际土表现出显著相关性。土壤是根瘤赖以生存的环境,固氮细菌在根瘤固氮过程中发挥重要作用[11], 根瘤坏死后内生菌释放到土壤中导致土壤也广泛分布着弗兰克氏菌[36],从土壤中能够分离出弗兰克氏菌[37]。因此,根瘤的固氮酶及Nos活性在一定程度对立地土壤有影响。根际环境是植物与土壤的连接纽带, 土壤微生物依附着根际生存[38]。研究表明,在不同土壤深度弗兰克氏菌菌株的分布不同[39], 因而固氮酶活性也有所差异。根际土壤的微生物丰度和酶活性普遍高于非根际土壤[40]。本研究结果表明, 固氮酶活性在好氧条件下根瘤区根际土与非根瘤区根际土显著正相关。但是在厌氧条件下,两种根际土固氮酶与Nos并无显著相关性,表明不同通气条件会影响根瘤与周围的土壤环境的关系。然而,目前对于在不同通气条件下根瘤与土壤、根际土与非根际土之间两种酶活性的研究甚少,还有待深入研究。
两树种的离体根瘤既具有固氮酶活性也具有Nos活性;固氮酶活性只表现在厌氧条件下,Nos活性只表现在好氧条件下;固氮酶活性大于Nos活性。
根瘤区根际土和非根瘤区根际土都具有固氮酶活性;在好氧条件下,两种土壤固氮酶活性之间无显著差异;根瘤区根际土和非根瘤区根际土都具有Nos活性,且前者大于后者;立地土壤的固氮酶活性大于Nos活性。
根瘤厌氧固氮酶活性与好氧条件下的两种根际土都呈极显著负相关,而与厌氧条件下的两种根际土都没有表现出显著负相关性,根瘤区根际土只在好氧条件下与非根瘤区根际土显著相关,根瘤区根际土与非根瘤区根际土在两种不同通气条件下的固氮酶活性没有表现出显著相关性;根瘤好氧Nos活性与厌氧条件下的两种根际土均有显著相关性,而厌氧条件下两种根际土之间无显著相关性。
[1] Li Z Z, Xie Y Q, WANG Z J, et al. The biological characteristics of actinormycetesliving in roots of[J]. For Sci, 2003, 39(S1): 139–147. doi: 10.11707/j.1001-7488.2003S125.李志真, 谢一青, 王志洁, 等. 木麻黄根瘤内生菌生物学特性研究 [J]. 林业科学, 2003, 39(S1): 139–147. doi: 10.11707/j.1001-7488. 2003S125.
[2] HANEY C H, LONG S R. Plant flotillins are required for infection by nitrogen-fixing bacteria [J]. Proc Nat Acad Sci USA, 2010, 107(1): 478–483. doi: 10.1073/pnas.0910081107.
[3] HUANG Q C, CHEN Q F, LI Z Z. Prospects for nitrogen fixation by azotobacter [J]. Sci Technol Rev, 1999, 17(1): 26–29. doi: 10.3321/ j.issn:1000-7857.1999.01.008.黄群策, 陈启锋, 李志真. 生物固氮研究的前景 [J]. 科技导报, 1999, 17(1): 26–29. doi: 10.3321/j.issn:1000-7857.1999.01.008.
[4] ZHOU Z H, SHI Y L, LIU Z H. Advances on the classification of[J]. Microbiol Bull, 1997, 24(1): 41–44. doi: 10.13344/j. microbiol.china.1997.01.011.9.周志宏, 石彦林, 刘志恒. 弗兰克氏菌的分类研究进展 [J]. 微生物学通报, 1997, 24(1): 41–44. doi: 10.13344/j.microbiol.china.1997.01.011.
[5] HAN H. The Analysis of nitrogenous compounds and genes expression ofandamong different protein content materials of,of high protein content andof high protein content [D]. Changchun: Jilin Agricultural University, 2014: 2–7.韩红. 不同蛋白含量大豆氮代谢物及和基因表达量分析 [D]. 长春: 吉林农业大学, 2014: 2–7.
[6] JENSEN B B, BURRIS R H. Nitrous oxide as a substrate and as a competitive inhibitor of nitrogenase [J]. Biochemistry, 1986, 25(5): 1083– 1088. doi: 10.1021/bi00353a021.
[7] VIETEN B, CONEN F, SETH B, et al. The fate of N2O consumed in soils [J]. Biogeosciences, 2008, 5(1): 129–132. doi: 10.5194/bg-5-129-2008.
[8] SAMESHIMA-SAITO R, CHIBA K, MINAMISAWA K. New method of denitrification analysis offield isolates by gas chroma- tographic determination of15N-labeled N2[J]. Appl Environ Microbiol, 2004, 70(5): 2886–2891. doi: 10.1128/AEM.70.5.2886-2891.2004.
[9] KANEKO T, NAKAMURA Y, SATO S, et al. Complete genomic sequence of nitrogen-fixing symbiotic bacteriumUSDA110 (Supplement) [J]. DNA Res, 2002, 9(6): 225–256. doi: 10.1093/dnares/9.6.225.
[10] WEN Y, CHEN Z, DANNENMANN M, et al. Disentangling gross N2O production and consumption in soil [J]. Sci Rep, 2016, 6: 36517. doi: 10.1038/srep36517.
[11] O’HARA G W, DANIEL R M. Rhizobial denitrification: A review [J]. Soil Biol Biochem, 1985, 17(1): 1–9. doi: 10.1016/0038-0717(85)90082-3.
[12] NOVA-FRANCO B, ÍÑIGUEZ L P, VALDÉS-LÓPEZ O, et al. The miR172c-AP2-1 node as a key regulator of the common bean-rhizobia nitrogen fixation symbiosis [J]. Plant Physiol, 2015, 168: 273–291. doi: 10.1104/pp.114.255547.
[13] XIAO X. The structure, variation and influencing factors of leguminous plant rhizosphere and nodule endosphere microbiome [D]. Yangling: Northwest Agricultural & Forestry University, 2017: 1–9.肖潇. 豆科植物根际和根瘤内生细菌群落结构、变化规律及其影响因素研究 [D]. 杨凌: 西北农林科技大学, 2017: 1–9.
[14] CHEN W F. Progress and perspective of systematics of rhizobia [J]. Microbiol China, 2016, 43(5): 1095–1100. doi: 10.13344/j.microbiol. china.150994.陈文峰. 根瘤菌系统学研究进展与展望 [J]. 微生物学通报, 2016, 43(5): 1095–1100. doi: 10.13344/j.microbiol.china.150994.
[15] ZHANG X, MA X Y, WANG Q Q, et al. Identification and nitrogen fixation effect of symbioticspp. isolated fromspp. [J]. Chin J Ecol, 2011, 30(9): 1975–1981. doi: 10.13292/j.1000-4890. 2011.0330.张昕, 马新颖, 王秋芹, 等. 木麻黄共生固氮菌的分离鉴定及固氮效应 [J]. 生态学杂志, 2011, 30(9): 1975–1981. doi: 10.13292/ j.1000-4890.2011.0330.
[16] LI Z Z. Actinomycetesin Fujian [M]. Beijing: China Environ- mental Science Press, 2006: 10–11.李志真. 福建弗兰克氏菌()研究 [M]. 北京: 中国环境科学出版社, 2006: 10–11
[17] LU R K. Analysis Method of Soil Agricultural Chemistry [M]. Beijing: China Agricultural Science and Technology Press, 2000: 12–14,127, 146–163,289.鲁如坤. 土壤农业化学分析方法 [M]. 北京: 中国农业科技出版社, 2000: 12–14,127,146–163,289.
[18] BELLENGER J P, XU Y, ZHANG X, et al. Possible contribution of alternative nitrogenases to nitrogen fixation by asymbiotic N2-fixing bacteria in soils [J]. Soil Biol Biochem, 2014, 69: 413–420. doi: 10. 1016/j.soilbio.2013.11.015.
[19] QIN S P, YUAN H J, HU C S, et al. Determination of potential N2O- reductase activity in soil [J]. Soil Biol Biochem, 2014, 70: 205– 210. doi: 10.1016/j.soilbio.2013.12.027.
[20] ZHAO F Y. Antioxidant protection of aerobic nitrogen-fixing micro- organisms [J]. Digital World, 2017(11): 438–438. doi: 10.3969/j.issn. 1671-8313.2017.11.397. 赵方毅. 好氧固氮微生物的防氧保护作用[J]. 数码世界, 2017(11): 438–438. doi: 10.3969/j.issn.1671-8313.2017.11.397.
[21] RUAN J S, LIU Z H, LIANG L N, et al. Research and Application of Actinomycetes [M]. Beijing: Science Press, 1990: 439–473.阮继生, 刘志恒, 梁丽糯, 等. 放线菌研究及应用 [M]. 北京: 科学出版社, 1990: 439–473.
[22] YANG H F, SHEN S M, ZHONG Y H. Preliminary research on the dynamic process of nitrogen fixation activities of detached nonleguminousnodules [J]. Chin J Ecol, 1987, 6(1): 10–13. doi: 10.13292/j.1000-4890. 1987.0003.杨慧凡, 沈善敏, 钟玉华. 离体赤杨型根瘤固氮活力进程的初步研究 [J]. 生态学杂志, 1987, 6(1): 10–13. doi: 10.13292/j.1000-4890. 1987.0003.
[23] MÅRTENSSON A M, WITTER E. Influence of various soil amend- ments on nitrogen-fixing soil microorganisms in a long-term field experiment, with special reference to sewage sludge [J]. Soil Biol Biochem, 1990, 22(7): 977–982. doi: 10.1016/0038-0717(90)90139-Q.
[24] ZHANG F Q. The practice of popularization and application of biological nitrogen fixation bacterium reagent [J]. Inner Mongolia Sci Technol Econ, 2003(12): 53–54. doi: 10.3969/j.issn.1007-6921.2003.12.026.张福全. 生物固氮菌剂的推广应用 [J]. 内蒙古科技与经济, 2003 (12): 53–54. doi: 10.3969/j.issn.1007-6921.2003.12.026.
[25] CHAIA E E, WALL L G, HUSS-DANELL K. Life in soil by the actin- orhizal root nodule endophyte: A review [J]. Symbiosis, 2010, 51(3): 201–226. doi: 10.1007/s13199-010-0086-y.
[26] WANG X H. Mechanism of anaerobic nitrogen fixation by aerobic nitrogen fixation microorganisms [J]. Middle School Biol, 2006, 22(1): 15. doi: 10.3969/j.issn.1003-7586.2006.01.007.王学宏. 好氧固氮微生物进行厌氧固氮的机制 [J]. 中学生物学, 2006, 22(1): 15. doi: 10.3969/j.issn.1003-7586.2006.01.007.
[27] BELL L C, FERGUSON S J. Nitric and nitrous oxide reductases are active under aerobic conditions in cells of[J]. Biochem J, 1991, 273: 423–427. doi: 10.1042/bj2730423.
[28] LI P, ZHANG S, LIU D L. Study progress of bacterial aerobic denitri- fication [J]. J Microbiol, 2005, 25(1): 60–64. doi: 10.3969/j.issn.1005-7021.2005.01.015.李平, 张山, 刘德立. 细菌好氧反硝化研究进展[J]. 微生物学杂志, 2005, 25(1): 60-64. doi: 10.3969/j.issn.1005-7021.2005.01.015.
[29] BURGIN A J, GROFFMAN P M. Soil O2controls denitrification rates and N2O yield in a riparian wetland [J]. J Geophys Res Biogeosci, 2015, 117(G1): G01010. doi: 10.1029/2011JG001799.
[30] WANG W, CAI Z C, ZHONG W H, et al. Research advances in aerobic denitrifiers [J]. Chin J Appl Ecol, 2007, 18(11): 2618–2625. doi: 10. 13287/j.1001-9332.2007.0433.王薇, 蔡祖聪, 钟文辉, 等. 好氧反硝化菌的研究进展 [J]. 应用生态学报, 2007, 18(11): 2618–2625. doi: 10.13287/j.1001-9332.2007. 0433.
[31] ZABLOTOWICZ R M, ESKEW D L, FOCHT D D. Denitrification in[J]. Can J Microbiol, 1978, 24(6): 757–760. doi: 10.1139/ m78-126.
[32] PRASAD P, BASU S, BEHERA N. A comparative account of the microbiological characteristics of soils under natural forest, grassland and cropfield from Eastern India [J]. Plant Soil, 1995, 175(1): 85–91. doi: 10.1007/BF02413013.
[33] ROBERTSON L A, van NIEL E W, TORREMANS R A, et al. Simul- taneous nitrification and denitrification in aerobic chemostat cultures of[J]. Appl Environ Microbiol, 1988, 54(11): 2812–2818.
[34] ZOU G Y, ZHANG F S. Denitrification in rhizosphere and N2O emission [J]. J China Agric Univ, 2002, 7(1): 77–82. doi: 10.3321/j.issn:1007-4333.2002.01.015.邹国元, 张福锁. 根际反硝化作用与N2O释放 [J]. 中国农业大学学报, 2002, 7(1): 77–82. doi: 10.3321/j.issn:1007-4333.2002.01.015.
[35] HAYATSU M, TAGO K, SAITO M. Various players in the nitrogen cycle: Diversity and functions of the microorganisms involved in nitri- fication and denitrification [J]. Soil Sci Plant Nutri, 2008, 54(1): 33–45. doi: 10.1111/j.1747-0765.2007.00195.x.
[36] ZHAO Z W. The ecological destribution ofin forestry soil [J]. J Yunnan Univ (Nat Sci), 1990(1): 81–83.赵之伟.菌在林地土壤中的生态分布 [J]. 云南大学学报(自然科学版), 1990(1): 81–83.
[37] BAKER D, O’KEEFE D. A modified sucrose fractionation procedure for the isolation offrom actinorhizal root nodules and soil samples [J]. Plant Soil, 1984, 78(1/2): 23–28. doi: 10.1007/BF02277837.
[38] WANG J. Genes and expression of ACC deaminase in nodules and soil of leguminous crops [D]. Xi’an: Shaanxi Normal University, 2013: 4王瑾. 豆科作物根瘤与土壤ACC脱氨酶基因及其表达研究 [D]. 西安: 陕西师范大学, 2013: 4.
[39] NALIN R, NORMAND P, DOMENACH A M. Distribution and N2- fixing activity ofstrains in relation to soil depth [J]. Physiol Plant, 1997, 99(4): 732–738. doi: 10.1111/j.1399-3054.1997.tb05378.x.
[40] LIU Z, WEI T X, ZHU Q K, et al. Microbes, enzyme activities and nutrient characteristics of rhizosphere and non-rhizosphere soils in forests of Loess Hilly Region [J]. Soils, 2016, 48(4): 705–713. doi: 10. 13758/j.cnki.tr.2016.04.013.刘钊, 魏天兴, 朱清科, 等. 黄土丘陵沟壑区典型林地土壤微生物、酶活性和养分特征 [J]. 土壤, 2016, 48(4): 705–713. doi: 10.13758/j. cnki.tr.2016.04.013.
Nitrogenase and N2O Reductase Activities of Detached Nodules and Site Soils ofand
MA Ying-ling1, ZHU Si-jia1, ZENG Si-ru1, MA Hong-liang1,2, YIN Yun-feng1,2, YANG Liu-ming1,2, GAO Ren1,3*
(1. School of Geographical Science, Fujian Normal University,Fuzhou 350007, China; 2. Cultivation Base of State Key Laboratory of Humid Subtropical Mountain Ecology,Fuzhou 350007, China; 3. Fujian Provincial Key Laboratory for Plant Eco-physiology,Fuzhou 350007, China)
To understand the activities of nitrogenase and N2O reductase (Nos) for non-legume nitrogen-fixing tree species, the detached nodules, rhizospheric soil in nodule root grown area (RSI) and rhizospheric soil near nodule root grown area (RSN) were collected fromandin Fujian Province, southeastern China, and the nitrogenase and Nos activities were determined by acetylene reduction method and acetylene inhibition technique, respectively. The results showed that the nitrogenase activity of detached nodules could be detected only under anaerobic condition, and the Nos activity only in aerobic condition. The nitrogenase activity in RSI and RSN under aerobic conditions was higher than those under anaerobic condition, and the Nos activities could be detected only under anaerobic condition. In aerobic condition, there was no significant difference in nitrogenase activity between RSI and RSN, while Nos activity of RSI was significantly larger than that of RSN. The nitrogenase activity were greater than Nos activity for the two tree species, except that there were no nitrogenase activity for the detached nodules under aerobic condition. The nitrogenase activity in the RSI under aerobic condition was significantly positively correlated with that in RSN. However, the nitrogenase activity in nodules under anaerobic condition was negatively correlated with that in RSI and RSN under aerobic condition, and the Nos activity in nodules under aerobic condition was also negatively correlated with that in RSI and RSN under anaerobic condition. These would lay a foundation for studying the effect and regulation of symbiotic nitrogen fixation system of tree species nodulated withon N2O sink intensity.
;; Symbiotic nitrogen fixation; Detached nodule; Site soil; Nitrogenase; Nos
10.11926/jtsb.3963
2018-07-02
2018-10-27
国家自然科学基金项目(31570607, 31770659, 41271282)资助
This work was supported by the National Natural Sciences Foundation of China (Grant No. 31570607, 31770659, 41271282).
马莹玲(1991~ ),女,硕士研究生,主要研究方向为生态与环境。E-mail: 1076369512@qq.com
E-mail: ren.gao@fjnu.edu.cn
