miR-140-5p靶向HDAC4调控人骨肉瘤细胞MG-63增殖
2019-04-03孙玉秀秦宝丽
孙玉秀,秦宝丽
0 引言
作为好发于青少年的常见的原发性恶性骨肿瘤,骨肉瘤常常被认为是儿童及青少年中癌症相关性死亡的常见病因[1]。骨肉瘤为起源于间充质细胞的原发性恶性骨肿瘤,其恶性程度极高,生长非常迅速,转移早,侵袭性强,预后常常不佳[2-3]。尽管近年来包括外科切除和化学治疗在内的综合治疗取得了一定的进展,仍有30%~40%的患者存在复发及远处转移,而且这些病例的平均生存期不足1年[4]。因此,寻找与骨肉瘤增殖相关的分子并明确其作用机制,对临床医生和相关研究者来说都显得尤为重要。
微小RNA (microRNAs,miRNAs)是近年来发现的长度约22~25 nt的内源性短链RNA[5]。MiRNAs通过转录水平或转录后水平调控各自的靶基因表达,从而在肿瘤中发挥了癌基因或抑癌基因的作用[6]。既往研究发现,miR-140-5p在多种肿瘤中表达增高且参与到肿瘤的增殖凋亡、侵袭转移等生物学行为过程中[7-10]。本研究拟从细胞学水平探讨miR-140-5p在骨肉瘤中的表达,并研究其对人骨肉瘤细胞MG-63增殖能力的影响,进一步明确其对人骨肉瘤细胞MG-63增殖的影响能否通过靶向抑制组蛋白脱乙酰基酶4(Histone deacetylase 4,HDAC4)基因来实现。
1 材料和方法
1.1 材料 人骨肉瘤细胞系MG-63以及人成骨细胞系hFOB1.19均购买于中国科学院上海生科院细胞资源中心;RNA提取试剂盒,Reverse Transcription 试剂盒,PCR试剂盒及LipofectamineTM3000转染试剂盒购自Invitrogen公司;CCK8试剂盒购自sigma公司;HDAC4兔源单克隆抗体购自Abcam公司;引物由生工生物工程(上海)股份有限公司合成;miR-140-5p 模拟物(miR-140-5p mimics)及空白对照模拟物(Negative control mimic,NC mimic)由广州锐博生物科技有限公司化学合成。
1.2 方法
1.2.1 细胞培养及分组 人成骨细胞系hFOB1.19细胞培养于DMEM/F12培养液中并置于35 ℃、5%CO2孵箱中培养;人骨肉瘤细胞系MG-63细胞培养于DMEM培养液中并置于37 ℃、5%CO2孵箱中培养。以上两种培养基均添加10%胎牛血清(Fetal bovine serum,FBS)。
1.2.2 脂质体介导的细胞转染 取对数生长期的MG-63细胞,调整细胞密度为2×105个细胞/孔并接种于6孔板中,添加完全培养基孵育24 h后,根据说明书采用LipofectamineTM3000转染,将50 nmol/L miR-140-5p mimics和相应的NC mimic分别转染到各自的细胞组中,转染48 h后收集细胞进行后续实验。
1.2.3 载体构建及荧光素酶报告实验 含有野生型及突变型miR-140-5p作用位点的HDAC4双荧光素酶报告基因质粒(wt-HDAC4-luc及mut-HDAC4-luc)由上海吉玛生物公司合成。将MG-63细胞接种于24孔板中,按照LipofectamineTM3000说明书转染干预因素,同时共转染wt-HDAC4-luc或mut-HDAC4-luc与miR-140-5p mimics或NC mimic。转染24 h后,利用双荧光素酶报告基因检测法检测,具体操作见说明书。
1.2.4 CCK8法检测MG-63细胞增殖 取对数生长期的MG-63细胞,胰蛋白酶消化后调整细胞密度为2×103并接种于96孔板中,每孔加入DMEM培养基200 μl并置于37 ℃、5%CO2培养箱中培养。待细胞长至50%融合时,更换无血清培养基同步化。24 h后,加入血清,不同时间(24 h、48 h、72 h)加入10 μl CCK8液,继续培养2 h,弃培养基,加入150 μl DMSO,室温孵育10 min,上机测定A490 nm,以该值代表细胞活力。
1.2.5 Western blot检测HDAC4蛋白表达 分组转染48 h后提取各组细胞的总蛋白并分组标记,BCA法测定各组蛋白浓度。取200 μl样品进行SDS-PAGE凝胶电泳,转膜。封闭1 h后,分别加入HDAC4一抗(稀释比例为1∶500),同时加入GAPDH一抗(稀释比例1∶500)作为对照,孵育过夜;第2天,采用辣根过氧化物酶标记的羊抗兔二抗(稀释比率为1∶1 000)室温下孵育1 h。参照ECL试剂盒说明书行电化学发光检测,采用Quantity One软件分析蛋白条带灰度值,并分组计算HDAC4蛋白相对表达量。
1.2.6 实时荧光定量 PCR检测miR-140-5p及HDAC4 mRNA的表达 采用Trizol分组提取各组细胞的总RNA。取50 μg总RNA并使用Invitrogen的逆转录试剂盒,按试剂盒说明书合成cDNA。反应产物进行PCR扩增,PCR过程按Invitrogen的SYBR Green 实时荧光定量PCR 试剂盒说明书在荧光定量仪上进行,分别设定GAPDH及U6作为HDAC4及miR-140-5p的内参照,引物序列见表1。以 HDAC4 mRNA拷贝数与内参照GAPDH mRNA 拷贝数的比值为 HDAC4的相对表达量;miR-140-5p拷贝数与内参照U6 拷贝数的比值为 miR-140-5p的相对表达量。

表1 引物序列表

2 结果
2.1 人骨肉瘤细胞系MG-63和人成骨细胞系hFOB1.19中miR-140-5p及HDAC4的差异表达 人骨肉瘤细胞系MG-63中miR-140-5p呈低表达而HDAC4呈高表达,如图1所示,Realtime-PCR及Western blot结果显示,与正常成骨细胞系相比,人骨肉瘤细胞系MG-63中miR-140-5p表达明显降低(图1A),HDAC4表达明显升高(图1B)。
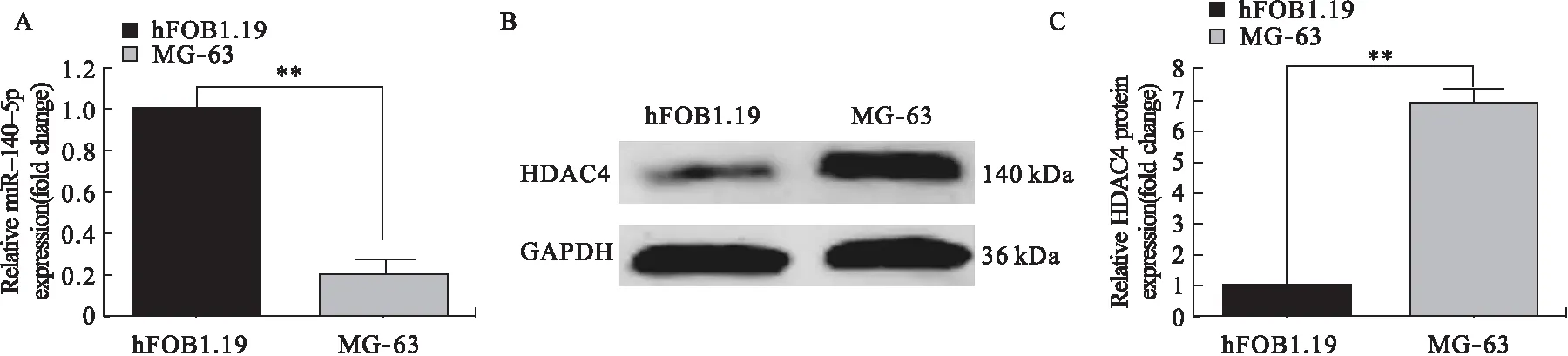
图1 人骨肉瘤细胞系MG-63和人成骨细胞系hFOB1.19中miR-140-5p及HDAC4的差异表达
2.2 上调miR-140-5p抑制HDAC4的表达 在MG-63细胞中转染miR-140-5p mimics,并通过qRT-PCR确认转染成功。结果如图2A所示,相比转染NC mimic组,转染miR-140-5p组的MG-63细胞内的miR-140-5p表达明显升高。我们进一步考察了上调miR-140-5p对HDAC4表达的影响,结果发现,相比于NC mimic转染组,转染miR-140-5p mimics也即上调miR-140-5p后,HDAC4的表达明显降低(见图2B、图2C)。
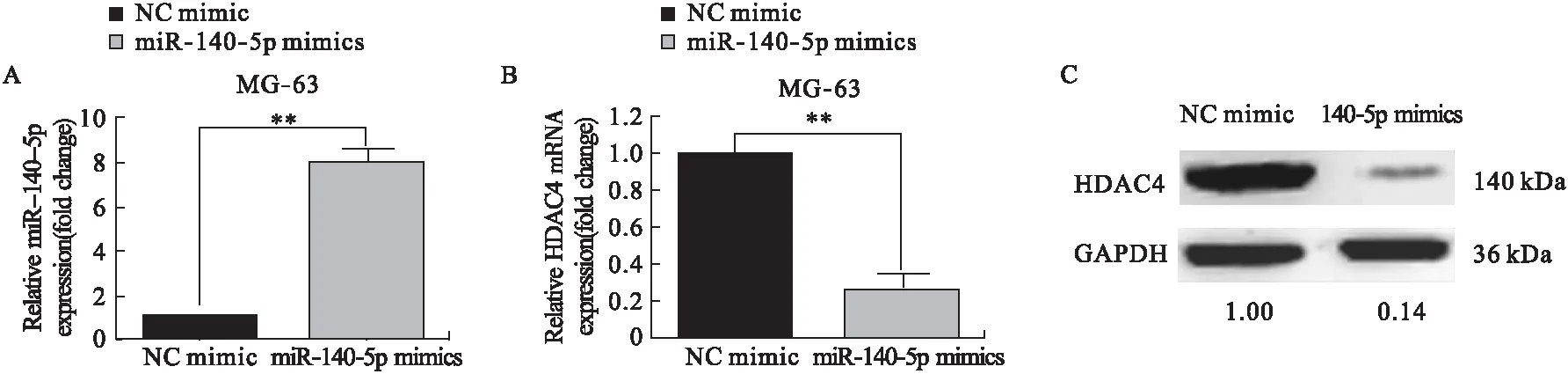
图2 上调miR-140-5p抑制HDAC4的表达
2.3 上调miR-140-5p抑制骨肉瘤细胞MG-63增殖 我们通过CCK8法考察了上调miR-140-5p对骨肉瘤细胞MG-63增殖的影响。如图3所示,相比转染NC mimic组,转染miR-140-5p组的MG-63细胞的增殖能力明显减弱,即上调miR-140-5p,可明显抑制骨肉瘤细胞MG-63的增殖能力。
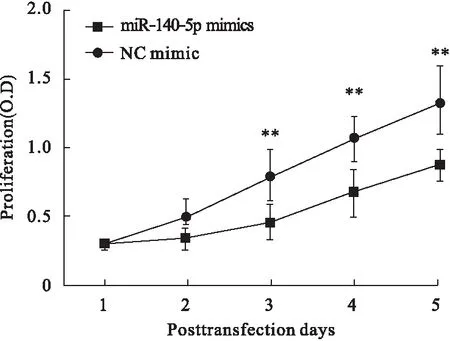
图3 上调miR-140-5p抑制骨肉瘤细胞MG-63增殖
2.4 miR-140-5p 可与HDAC4 3′UTR靶向结合 我们首先通过tagetscan在线理论预测软件预测发现,HDAC4基因的3′UTR与miR-140-5p存在理论上的7个碱基互补区,见图4A。进一步的双荧光素酶报告基因实验结果显示,野生型HDAC报告质粒(wt-HDAC4-luc)和 miR-140-5p mimics 共转染后,MG-63细胞的荧光素酶活性比wt-HDAC4-luc 和NC mimic组共转染组明显降低 (P<0.05);但将理论上的HDAC4 3′UTR与 miR-140-5p 的结合位点做了突变后(共转染wt-HDAC4-luc与miR-140-5p mimics),荧光素酶活性复又升高,也就是miR-140-5p能够靶向作用于HDAC4 3′UTR,见图2B。
2.5 HDAC4 cDNA逆转miR-140-5p对MG-63增殖的抑制效应 我们将HDAC4 cDNA质粒(oe-HDAC4)及对应的空白载体质粒(pcDNA)与miR-140-5p mimics共转染,并再次检测HDAC4的表达,结果发现,相比于miR-140-5p mimics组及空白载体共转染组(miR-140-5p mimics+pcDNA组),miR-140-5p mimics+oe-HDAC4组的HDAC4的表达明显升高(见图5A、图5B)。我们进一步检测了这三组细胞的增殖能力变化,结果发现,相比于miR-140-5p mimics组及空白载体共转染组(miR-140-5p mimics + pcDNA组),miR-140-5p mimics + oe-HDAC4组细胞的增殖能力明显得到了提升(见图5C)。

图4 荧光素酶报告基因实验检测 miR-140-5p与 HDAC4 3′UTR结合

图5 HDAC4 cDNA逆转miR-140-5p对MG-63增殖的抑制效应
3 讨论
miRNA是一类在进化上高度保守且在真核生物广泛表达的小分子单链RNA,通常miRNA不具有编码功能。miRNA的表达具有严格的组织特异性及时间特异性,而miRNA的失常表达往往与疾病的发生发展密切相关。miRNA在肿瘤的发生发展过程中同样起到了至关重要的调控者角色。一般来讲,参与肿瘤进展的miRNA有两大类,一类能够促进肿瘤细胞的增殖、存活及侵袭转移,另一大类则起到相反的作用[11]。研究表明,miRNA在多种肿瘤组织中都存在异常表达的现象,并在肿瘤的进程中发挥着癌基因或抑癌基因的效应[12]。
人miRNA-140-5p(序列号MIMAT0000431),既往也称miR-140,位于人染色体16q22.1,广泛参与多种肿瘤的多种生物学行为。Fang等[7]发现,miR-140-5p能够通过调控YES原癌基因1(YES proto-oncogene 1,YES1)的表达并抑制胃癌细胞的增殖及侵袭转移。Yuan 等研究认为,miR-140-5p能够抑制胰岛素样生长因子1受体(Insulin-like growth factor 1 receptor)的表达并抑制其介导的非小细胞肺癌增殖及侵袭转移。Wei等[13]报道,miR-140-5p能够通过打靶肌醇1,4,5-三磷酸激酶(Inositol 1,4,5-trisphosphate kinase 2,IP3k2)的方式,减轻化学药物诱导的骨肉瘤细胞死亡。在本研究中,我们发现,miR-140-5p在人骨肉瘤细胞系MG-63中表达降低。通过转染miR-140-5p mimics的方式上调miR-140-5p的表达后,骨肉瘤细胞系MG-63的增殖能力与NC mimic组相比明显降低,表明miR-140-5p在骨肉瘤细胞的增殖过程中发挥了重要的调控作用。人组蛋白脱乙酰基酶4(Histone deacetylase 4,HDAC4)基因位于人染色体2q37.3,其mRNA长度为8 980 bp,共含有37个外显子,因此,HDAC4具有极为复杂的生物学功能。Zeng等[14]研究发现,HDAC4在食管癌中表达增高并与食管癌的不良预后及肿瘤进展密切相关。Wu等[15]报道,HDAC4在骨肉瘤中表达增高,上调miR-145-3p可抑制HDAC4的表达,并抑制骨肉瘤细胞增殖,促进其凋亡及自噬的发生。我们在前期研究中发现,HDAC4与骨肉瘤细胞的增殖和凋亡密切相关[16]。在本研究中我们发现,HDAC4在人骨肉瘤细胞系MG-63中表达明显增高。在MG-63中上调miR-140-5p后,HDAC4的mRNA及蛋白表达均明显降低,提示miR-140-5p可在转录水平调控HDAC4的表达。同时,我们通过targetsan在线软件预测发现,miR-140-5p与HDAC4 3′ UTR区存在7个碱基互补区的miRNA作用元件(MicroRNA response elements,MREs)。因此,我们进一步通过荧光素酶报告基因实验,验证理论上的miR-140-5p与HDAC4 3′ UTR的靶向结合作用是否存在。结果证实,miR-140-5p可通过理论上的miRNA作用元件靶向结合于HDAC4 3′ UTR区,即HDAC4是miR-140-5p的靶基因之一。最后我们通过构建的反义实验,验证HDAC4在miR-140-5p介导的骨肉瘤细胞增殖中的作用。结果显示,当我们将HDAC4 cDNA转染到miR-140-5p过表达的细胞模型内后,miR-140-5p对骨肉瘤细胞MG-63的抑制作用被明显翻转,也就是说HDAC4是miR-140-5p介导的骨肉瘤细胞增殖的效应基因。以上研究结果提示,miR-140-5p可通过靶向结合于HDAC4 3′ UTR区,在转录水平抑制HDAC4的表达,从而抑制骨肉瘤细胞系MG-63的增殖。
综上所述,miR-140-5p可通过靶向结合于HDAC4的3′ UTR区,并干扰HDAC4的表达,从而抑制骨肉瘤细胞的增殖。本研究结果提示,miR-140-5p/HDAC4轴在骨肉瘤细胞增殖的过程中发挥了重要的调控作用,miR-140-5p/HDAC4轴有望成为分子治疗骨肉瘤的靶基因。
