鲤浮肿病毒和锦鲤疱疹病毒三重PCR检测方法的建立及初步应用
2019-04-03张文徐立蒲吕晓楠王小亮王静波曹欢
张文 徐立蒲 吕晓楠 王小亮 王 姝 王静波 曹欢
(北京市水产技术推广站 北京 100176)
1 前言
锦鲤(Cyprinus Carpio Var Koi)是我国主要观赏鱼养殖品种之一,在观赏鱼国际贸易中占较大比重,具有重要的经济价值[1-3]。随着我国锦鲤养殖规模的不断扩大,疫病的频繁出现也制约了观赏鱼养殖产业的健康发展。锦鲤对多种病原易感,据研究可引起锦鲤大面积死亡的主要病原是鲤浮肿病毒(Carp Edema Virus,CEV)和锦鲤疱疹病毒(Kio Herpes Virus,KHV)[4]。CEV是大小约为200nm×400nm的双链DNA,属痘病毒[5]。KHV是直径167~200 nm的双链DNA,属疱疹病毒[6,7]。这2种病毒引起的症状极其相似,包括烂鳃、眼球凹陷等,死亡率高达80%~100%[8,9]。因此,当养殖锦鲤出现烂鳃、凹眼等症状,并有较高死亡率时,根据现场调查症状和流行特点很难区分这2种病毒病,还需尽快进行实验室检测。分子生物学方法是实验室最常用的检测CEV和KHV 的方法。对于CEV,Oyamatsu等[10]建立了nest-PCR方法,该方法适合于锦鲤的检测[11]。对于KHV、PCR检测方法是世界动物卫生组织(OIE)水生动物疾病诊断手册上优先推荐的方法。目前,实验室通常采用SC/T 7212.1—2011《鲤疱疹病毒检测方法第1部分:锦鲤疱疹病毒》行业标准同时扩增TK基因和 Sph基因来检测该病毒[12,13]。
鉴于CEV和KHV引起的发病锦鲤症状极其相似,针对同一临床样品需要分别检测CEV和KHV这2种病原,为提高实验室检测效率,尽快确诊病原,本研究建立了可同时检测锦鲤样品中CEV和KHV的三重PCR检测方法,为鲤浮肿病毒病(CEVD)和锦鲤疱疹病毒病(KHVD)这2种常见鱼类疫病的快速诊断及有效防控提供必要的技术支持。
2 材料与方法
2.1 材料
2.1.1 毒株
CEV、KHV、金鱼造血器官坏死病毒(Goldfish Haematopoietic Necrosis Virus,GFHNV)、 流行性造血器官坏死病毒(Epizootic Haematopoietic Necrosis Virus,EHNV)、蛙虹彩病毒(Bohle Iridovirus Virus,BIV)、斑点叉尾鮰病毒 (Channel Catfish Virus,CCV)(由北京市水产技术推广站鉴定保存)、白斑综合征病毒 (White Spot Syndrome Virus,WSSV)、虾肝肠胞虫 (Enterocytozoon Hepato Penaei,EHP)(购自中国水产科学研究院黄海水产研究所)。
2.1.2 主要试剂与仪器
DNA抽提试剂盒(QIAGEN公司);DNA扩增试剂盒(北京百泰克生物技术有限公司);梯度PCR仪(Life Technologies公司)。
2.2 方法
2.2.1 引物的选择与合成
根据Oyamatsu等建立的nest-PCR方法和锦鲤疱疹病毒行业标准SC/T 7212.1—2011《鲤疱疹病毒检测方法 第1部分:锦鲤疱疹病毒》公布的方法,选择扩增CEV P4a基因548 bp片段、KHV TK基因409 bp片段和KHV Sph基因292 bp片段的3对特异性引物,引物序列见表1,由北京六合华大基因科技有限公司合成。

表1 引物序列
2.2.2 标准品的制备
参照DNA抽提试剂盒说明书,提取鲤浮肿病毒和锦鲤疱疹病毒的DNA,送至北京天成新脉生物技术有限公司,合成CEV P4a基因序列(548 bp),克隆到pEASY-T1载体。合成KHV TK基因序列(409 bp)和 KHV Sph 基因序列(292 bp),克隆到PUC57-Kan载体上,构建CEV-P4a、KHV-TK和KHV-Sph标准质粒,根据质粒浓度计算拷贝数。
2.2.3 三重PCR退火温度及引物浓度优化
参照DNA扩增试剂盒说明书,单重PCR扩增反应的反应体系见表2,反应程序为:95℃预变性4 min,95℃变性 1 min, 适宜温度退火 1 min,72℃延伸1 min,35个循环后72℃延伸10 min。

表2 单重PCR反应体系
在单重PCR反应条件基础上,分别加入质粒CEV-P4a、KHV-TK和KHV-Sph各2.5μL作为模板,退火温度设置为 43℃、45℃、47℃、49℃、51℃、53℃、55℃、57℃、59℃、61℃、63℃、65℃进行三重 PCR 扩增,根据条带强弱确定最佳退火温度。在此基础上,设 置 每 对 引 物 终 浓 度 为 0.1 μmol/L、0.2 μmol/L、0.3 μmol/L、0.4 μmol/L、0.5 μmol/L、0.6 μmol/L 6 个梯度,组合后分别进行三重PCR扩增,根据条带强弱、有无杂带确定最佳引物终浓度。
2.2.4 敏感性试验
对质粒 CEV P4a、KHV TK和KHV Sph分别进行10倍系列稀释,按照2.2.3所述的方法进行单重和三重PCR扩增,验证检测方法的敏感性。
2.2.5 特异性试验
分别以质粒 CEV-P4a、KHV-TK和 KHV-Sph作为模板,同时加入3对特异性引物,按照优化好的反应条件进行三重单检PCR扩增,验证引物间是否存在交叉反应。同时采用建立的方法,对GFHNV、EHNV、CCV等DNA病毒进行特异性验证。
2.2.6 临床样品检测应用
采用本研究建立的三重PCR方法,检测本实验室鉴定保存的20份样品,评价该方法的可靠性。
3 结果
3.1 反应条件的优化
通过设置不同退火温度进行三重PCR扩增,可知退火温度为53℃,目的条带最清晰且背景干净,见图1。设置不同引物终浓度进行三重PCR扩增,结果显示,当引物终浓度均为0.3 μmol/L时,目的条带最明显。因此,优化好的反应体系为:2×Master Mix 25 μL,3 对特异性引物终浓度 0.3 μmol/L,模板2.5μL,补水至50μL。反应程序为:95℃预变性4 min,95℃变性1min,53℃退火 1min,72℃延伸 1min,35 个循环后72℃延伸10 min。

图1 不同退火温度的扩增结果
3.2 敏感性试验结果
以10倍系列稀释的质粒CEV-P4a、KHV-TK和KHV-Sph作为模板,分别进行单重PCR检测,结果显示 3种质粒的检测限分别为 300 copies/μL、30 copies/μL、30 copies/μL,见图 2;进行三重 PCR 检测,结果显示3种质粒的检测限均为300 copies/μL,与单重PCR相比,KHV敏感性有所下降,见图3。
3.3 特异性试验结果

图2 单重PCR敏感性试验

图3 三重PCR敏感性试验
当反应体系中只加入CEV P4a、KHV TK和 KHV Sph中任意2种质粒作为模板,采用本研究建立的方法进行PCR扩增时,结果仅得到相应模板的目的条带,表明引物间没有交叉反应,见图4。以GFHNV、EHNV、CCV等多种DNA病毒核酸作为模板进行三重PCR扩增,结果均没有目的条带,见图5。
3.4 临床样品检测结果
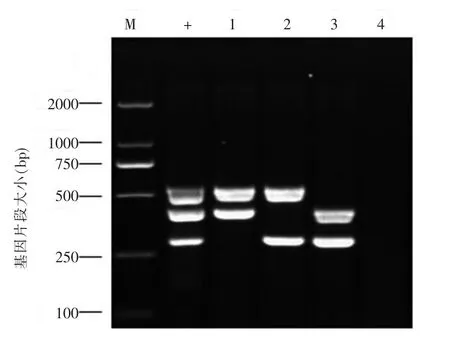
图4 任意2种质粒作为模板三重PCR扩增

图5 特异性试验
采用本研究建立的三重PCR法,对实验室鉴定保藏的20份锦鲤样品进行检测,验证方法的可靠性。其中有13份样品经英国环境、渔业和水产养殖科学中心(CEFAS)建立的荧光PCR鉴定为CEV阳性,7份样品经SC/T 7212.1—2011《鲤疱疹病毒检测方法 第1部分:锦鲤疱疹病毒》行业标准鉴定为KHV阳性。三重PCR扩增结果显示,13份CEV阳性样品中,只有4份有548 bp目的条带,参考日本学者Oyamatsu等建立的nest-PCR方法,采用该方法中的套式引物对其余9份样品进行套式扩增,结果均有180 bp目的条带。虽然这9份样品经三重PCR扩增没有548 bp目的条带,但经套式PCR可扩增出180 bp条带,说明第一步可以扩增出微量的PCR产物,或产生了错误片段。7份KHV阳性样品均能够同时扩增出409 bp和292 bp 2条目的条带,结果见表3。
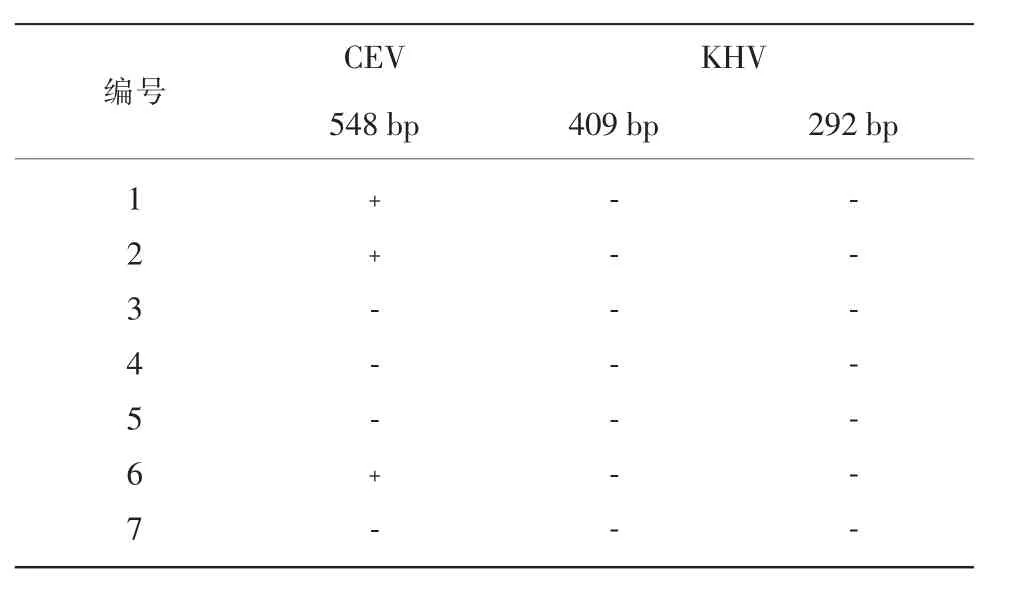
表3 临床样品检测结果
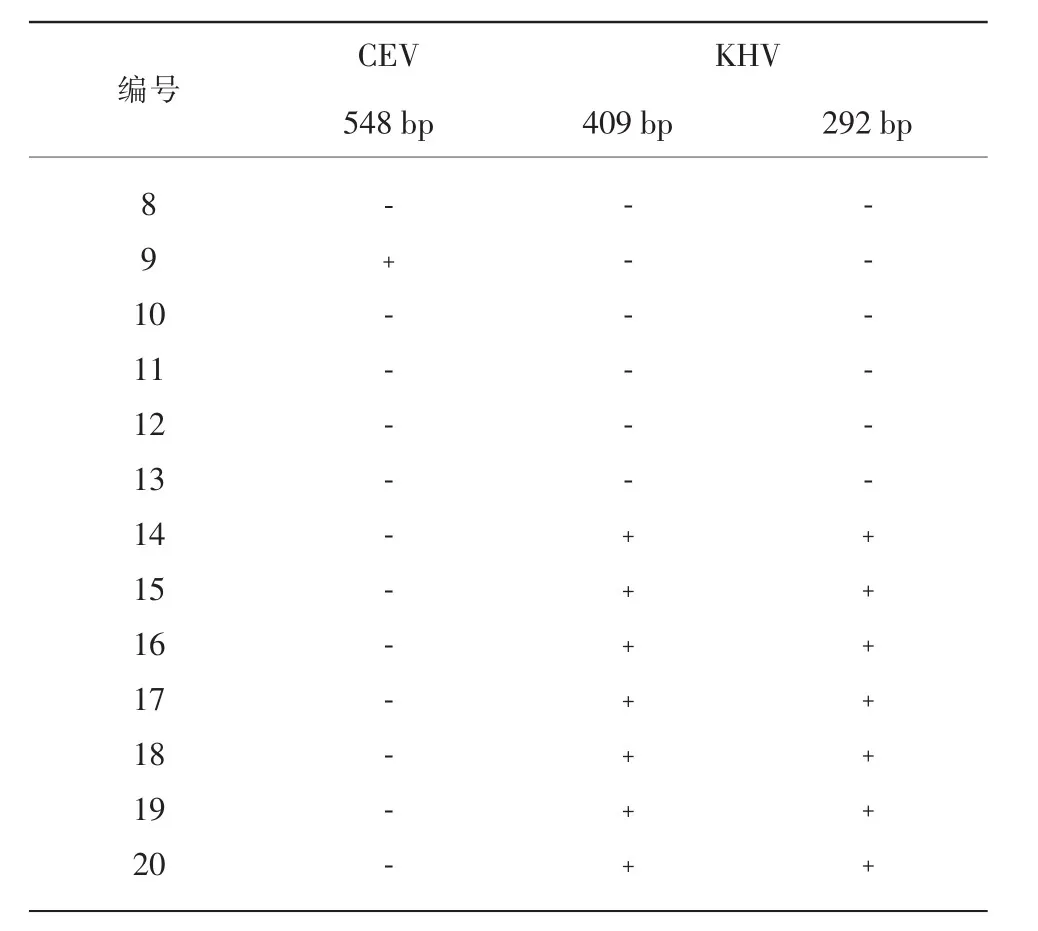
(续表3)
4 讨论
KHVD是OIE必须申报的国家二类动物疫病,自2002年在我国大陆进口的锦鲤中发现KHV至今,我国多地鲤(Cyprinus Carpio Linnaeus)及锦鲤养殖场均有KHV感染的报道,给我国鲤及锦鲤养殖业造成了严重的经济损失[14]。CEVD是2016年在我国首次被确诊的可感染鲤和锦鲤临床症状与KHVD极其相似的鱼类病毒病[15-17],死亡率在80%以上,已在我国多地爆发流行[18],同样制约了鲤及锦鲤养殖产业的发展。目前,针对CEVD和KHVD尚没有有效的治疗措施,提高检测效率,尽早确诊病原,为疫病防控提供必要依据则具有重要意义。目前,还没有筛选到能够稳定易感CEV的敏感细胞系,主要依靠PCR方法检测CEV。有研究表明,Oyamatsu等和英国CEFAS建立的套式PCR都存在漏检现象[19,20],其中,Oyamatsu 建立的方法适用于锦鲤的检测,而检测鲤时有漏检情况。英国CEFAS建立的实时荧光定量PCR是目前最适用于检测CEV的方法,更适用于CEV的常规监测。但是荧光PCR的扩增产物长度只有76 bp,测序后无法通过序列比对进行相似性和同源性分析,导致相关数据缺失,且一般普通实验室不具备该设备。针对KHV的敏感细胞系已有大量报道,但通常需要传代3~5次,每次培养时间约为2周,分离培养时间较长,且首次分离成功的很少,故普通PCR检测方法依然是诊断KHV首选。综合考虑上述因素,本研究建立了针对锦鲤样品可同时检测CEV和KHV的三重PCR检测方法。
目前,PCR技术因快速、灵敏、特异等特点早已被广泛应用。多重PCR是在单重PCR基础上,在同一反应体系中,同时加入多对特异性引物,扩增多个目的基因的技术手段[21-23]。在实际检测工作中,当样品量非常大时,与单重PCR相比,多重PCR高效、简便等特点则具有明显优势。但多重PCR对扩增条件、引物序列、扩增产物大小等要求较高[24],需要对反应条件、引物浓度等进行优化,以提高反应的扩增效率。
本研究选择扩增CEV P4a基因548 bp、扩增KHV TK基因409bp及扩增KHV Sph基因292bp的3对特异性引物,通过优化退火温度和引物浓度,初步建立了鲤浮肿病毒和锦鲤疱疹病毒三重PCR检测方法。敏感性试验结果显示,KHV敏感性有所下降,推测引物间的相互竞争可能是导致三重PCR敏感性有所下降重要原因。与实验室普通单重PCR检测方法相比,该方法大大缩短了检测时间,提高了检测效率,实现了一管多检;扩增产物可直接测序,可进行序列相似性和同源性分析;有较高的敏感性,检测限为300 copies/μL;有良好的特异性,引物间不发生交叉反应,以其他鱼类DNA病毒作为模板进行扩增,没有目的条带。
临床样品检测结果表明,采用本研究建立的三重PCR方法检测KHV,结果与实验室常规方法检测结果一致。检测CEV时,只有4份样品扩增出目的条带,参考日本学者Oyamatsu等建立的nest-PCR方法对其余样品的扩增产物进行套式扩增,有9份样品可获得180 bp目的条带,证明有13份CEV阳性样品,与实验室采用荧光定量PCR检测方法结果一致。分析原因,扩增548 bp的引物序列在对病毒含量很低的样品进行扩增时只产生了微量的PCR产物,或易产生错误片段,需进一步进行套式扩增。
综上所述,本研究通过对CEV和KHV三重PCR检测方法的初步建立,明确了反应体系和反应程序,适用于检测病毒含量较高或发病状况下的锦鲤样品,针对病毒含量较低的样品,弥补套式PCR的缺陷。与荧光PCR相比,扩增产物可直接测序进行序列分析。该方法在引物序列方面还需改进,需要在以后的工作中积累大量的阳性样品以及序列信息,力求找到更加保守的序列和更通用的引物。本研究的建立为CEV和KHV检测方法的研究提供了重要依据,为更好地检测这2种常见鱼类疫病奠定了一定的基础。
