猪肠道α冠状病毒荧光定量PCR检测方法的建立
2019-04-02赵冠宇黄海鑫张世亨赵翠青陆祎婷夏秀秀孙文超鲁会军金宁一
赵冠宇,黄海鑫,张世亨,赵翠青,陆祎婷,夏秀秀,倪 铭,李 笨,汪 伟,曹 亮,郑 敏,孙文超*,鲁会军*,金宁一*
(1.吉林大学动物医学学院,吉林长春130062;2.温州大学病毒学研究所,浙江温州 325035;3.广西动物疫病预防控制中心,广西南宁530001;4.军事科学院军事医学研究院军事兽医研究所,吉林长春130122)
冠状病毒(Coronavirus,CoV)是一种带有包膜的单股正链RNA 病毒,感染人、鼠、猪、猫、犬、禽等动物,并引发胃肠道、呼吸道和神经系统疾病[1-2]。CoV 根据基因型和血清学特征分为4 个不同的属:α-CoV,β-CoV,γ-CoV 和δ-CoV[3-4]。迄今为止,已确定猪传染性胃肠炎病毒(TGEV)、猪流行性腹泻(PEDV)及猪delta 冠状病毒(PDCoV)会引起仔猪临床腹泻[5-6]。2016年德国曾发现并报道猪肠道α 冠状病毒(Swine enteric alphacoronaviruses,SeACoV)病毒,其对养猪业造成较大威胁[7]。该病毒于2017年2 月在中国广东首次发现,引起新生仔猪水样腹泻、呕吐、脱水,且死亡率可达90 %以上[8]。其基因组长度约为27 kb,基因结构与蝙蝠样HKU2 株冠状病毒相似,包括开放阅读框1a/1b、非结构蛋白3、包膜E、核衣壳N 等[9]。由于该病毒引起的仔猪腹泻症状与已知的PEDV、TGEV、PDCoV 引起的症状类似,迫切需要建立一种更快,更可靠的鉴别诊断技术,对SeACoV 的分子流行病学状况及其感染情况进行诊断。
1 材料与方法
1.1 主要实验材料 猪流行性腹泻(PEDV)、猪传染性胃肠炎病毒(TGEV)、猪delta 冠状病毒(PDCoV)、猪繁殖与呼吸综合征病毒(PRRSV)、SeACoV基因组均由军事兽医研究所分子病毒学与免疫学实验室保存。70 份腹泻仔猪的小肠内容物及粪便样品为本实验室2017年采集自广西与云南地区猪场。ExTaq酶、T4 DNA 连接酶、pEASY-Blunt 载体及DL2000 DNA Marker 均购自TaKaRa 公司;质粒小提试剂盒购自杭州AXYGEN 公司;SYBR Green I PCR Master Mix 购自美国Promega 公司。
1.2 引物的设计及合成 根据GenBank 中登录的SeACoV 基因组序列(EF203064.1),利用Primer 5.0软件选择高度保守的N 基因区域设计特异性引物(PA-N-F2: 5'-TCCCCAAGACTGATAAAAATCTACC CA-3'/PA-N-R2:5'-ATAATCTCATCCACCATCTCAA CCTCC-3'),引物由吉林省库美生物工程有限公司合成。
1.3 重组质粒标准品的制备 以SeACoV 基因组作为模板,利用引物PA-N-F2/R2 扩增目的基因片段(199 bp),将该目的基因片段克隆至pEASY-Blunt 质粒,经测序鉴定后阳性质粒转化感受态细胞DHα 后接种LB 培养基后提取质粒,NanoDrop One 测定其浓度,换算成拷贝数,作为质粒标准品保存备用。
1.4 SeACoV 荧光定量PCR 方法的建立 以质粒标准品pEASY-Blunt-PA-N 为模板,采用方阵法分别对引物浓度(5 pmol/L~20 pmol/L)、退火温度(50 ℃~70 ℃)和循环数(30 个循环~40 个循环)进行优化。
采用优化的反应条件,以10 倍倍比稀释的7 个浓度梯度的标准质粒分别为模板进行荧光定量PCR扩增,绘制标准曲线和溶解曲线。
1.5 特异性试验 按照已建立的SYBR Green I 荧光定量PCR 反应体系,分别扩增PEDV、TGEV、PDCoV、PRRSV、SeACoV 基因组,并以无菌去离子水作为阴性对照,分析该方法的特异性。
1.6 敏感性试验 阳性质粒pEASY-Blunt-PA-N 经无菌去离子水10 倍倍比稀释(9.47×101拷贝/μL~9.47×108拷贝/μL)后,分别以其为模板进行SYBR Green I 荧光定量PCR 检测,确定该方法检测下限,同时设无菌去离子水为阴性对照。
1.7 重复性试验 以同一批次提取的不同浓度的质粒标准品(9.47×104拷贝/μL、9.47×105拷贝/μL 及9.47×106拷贝/μL)为模板进行SYBR Green I 荧光定量PCR 批内重复性试验反应,每个浓度重复3 次;另以不同批次提取质粒为模板,参照以上方法进行批间重复性试验,分析SeACoV SYBR Green I 荧光定量PCR 方法的重复性。
1.8 临床样品检测 70 份腹泻仔猪的小肠内容物及粪便按常规方法经PBS 处理后提取RNA 反转录获得cDNA,以其为模板,利用建立的SYBR Green I 荧光定量PCR 方法进行检测,每次检测均设置SeACoV 阳性质粒标准品为阳性对照,以去离子水为阴性对照。
2 结 果
2.1 重组质粒标准品构建结果 利用SeACoV 特异性引物PA-N-F2/R2 扩增得到约200 bp 的目的片段,与预期目的基因片段相同,无非特异性条带(图1)。将所得的目的片段经纯化后与pEASY-Blunt 载体相连接,提取质粒经测序后与NCBI 登录的标准序列比对,同源性为100 %,且插入位置正确,表明重组质粒pEASY-Blunt-PA-N 正确构建;阳性质粒扩增培养后提取质粒,经NanoDrop One 测定其浓度为412.85 ng/μL,换算成拷贝数为9.47×1010拷贝/μL。

图1 SeACoV N 基因的扩增结果Fig.1 Amplification of SeACoV N gene
2.2 荧光定量PCR 方法的建立 通过荧光定量PCR 条件优化,最终确定反应条件: PCR 反应总体积为20 μL,其中2×SYBR Green I 荧光染料10 μL,上、下游引物(20 pmol/L)各0.2 μL,质粒模板1.0 μL,用去离子水补足至20 μL。同时设置阴性对照。反应程序为:95 ℃5 min;94 ℃30 s,56 ℃30 s,72 ℃30 s,共40 个循环。建立的标准曲线斜率为-3.91,截距为42.57,相关系数为0.996(图2)。
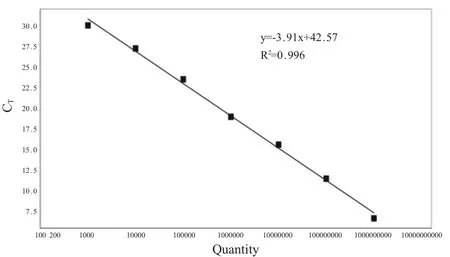
图2 SeACoV N 基因SYBR Green I 荧光定量PCR 标准曲线Fig.2 Standard curves of SeACoV N genes by SYBR Green I real-time PCR
2.3 特异性试验结果 以PEDV、TGEV、PDCoV、PRRSV 基因组为模板,利用建立的SYBR Green I荧光定量PCR 方法进行扩增,结果显示,除SeACoV 阳性对照外,其它病原均无特异性扩增(图3)。表明本研究建立的SeACoV YBR Green I 荧光定量PCR 方法特异性较强。

图3 SeACoV N 基因SYBR Green I 荧光定量PCR 特异性分析Fig.3 Specificity analysis of the SYBR Green I real-time PCR
2.4 敏感性试验结果 分别以8 个系列稀释的标准质粒为模板,进行SYBR Green I 荧光定量PCR。结果显示,当PCR 反应体系中含有9.47×101拷贝/μL标准质粒DNA 时,仍然产生特异性扩增(图4),并且阴性对照未观察到特异性扩增。表明本实验所建立方法具有良好的敏感性。

图4 SeACoV N 基因SYBR Green I 荧光定量PCR 敏感性分析Fig.4 Sensitivity analysis of the SYBR Green I real-time PCR
2.5 重复性试验结果 不同稀释度的标准品进行SYBR Green I 荧光定量PCR 的重复性试验,利用统计学软件分析扩增结果(表1),批内变异系数在0.82 %~1.01 %;批间变异系数在1.20 %~1.69 %。表明建立的SYBR Green I 荧光定量PCR 方法具有较好的重复性。

表1 SeACoV 荧光定量PCR 检测重复性试验Table 1 Repeatability assay of SeACoV florescence quantitative real-time PCR
2.6 临床样品的检测 采取广西和云南等地猪腹泻临床样品70 份,利用建立的SYBR Green I 荧光定量PCR 方法进行检测,结果显示,阳性孔显示为阳性,阴性对照孔无扩增,70 份临床样品检测均为阴性。表明本研究建立的SYBR Green I 荧光定量PCR可用于临床样品检测。
3 讨 论
2017 浙江大学Pan 等证实SeACoV 是一种全新的猪肠道冠状病毒,也是迄今所发现的第5 种猪冠状病毒。细胞分离的SeACoV 有能力感染3 日龄新生仔猪并引起腹泻和粪便排毒[10]。
N 蛋白是冠状病毒的主要结构蛋白之一,是一种多功能的磷酸化蛋白,在感染细胞中是表达量最高的病毒蛋白之一[11],同时N 蛋白也是冠状病毒结构蛋白中最保守的蛋白质,病毒感染前期检测手段多为针对N 蛋白[12]。因此本实验选择N 基因保守区为靶基因,可以保证临床样品检测的准确性,具有其它蛋白基因所不具备的优势。
目前尚未见针对SeACoV 所建立的SYBR Green I 荧光定量检测方法。Zhou 等建立基于TaqMan 的荧光定量RT-PCR 检测方法,用于检测猪腹泻病毒SADS-CoV,最低检出下限为3.0×102拷贝/μL[13]。本实验所建立的方法,敏感性达到9.47×101拷贝/μL,是Zhou 等所建立的TaqMan RT-PCR 检测方法的10 倍。Hu 等建立了基于RT-PCR 方法用于监测多种冠状病毒,设计了一对新的引物,用于扩增RNA 依赖性RNA 聚合酶(RdRP)基因区域的668 bp,其编码α、β、γ 和δ 属冠状病毒最保守的的蛋白质结构域[14]。该方法可以区分PEDV 和PDCoV,但无法区分CoV 的血清型。本实验的检测方法针对新发现的SeACoV 具有特异性,可用于对CoV 的血清型等研究的技术手段。
研究认为SeACoV 是造成中国不同省份猪群腹泻的原因之一。SeACoV 在中国广东猪场发生严重腹泻的猪群中暴发,表明其具有区域暴发腹泻的可能,同时由于广东省处于人员、动物交流频繁地区,可能散播至数个乃至更多省份,导致新的大流行病毒的出现。本研究所采集广西、云南两省临床样品中虽未检测到SeACoV,但该地区紧邻广东省,仍有极大的感染风险,因此需要对SeACoV 进行广泛监测,以确定其流行病学和进化趋势。本实验首次建立了能够检测SeACoV 的SYBR Green I 荧光定量PCR 方法,该方法具有敏感度高,特异性强等特点。同时该方法更加快速,成本更低,且避免了核酸对环境的污染等危害。
综上所述,本研究建立的SYBR Green I 荧光定量PCR 检测方法,为SeACoV 的诊断、流行病学监测和致病机制研究提供了技术支撑。
