经白色念珠菌胁迫后家蝇新型抗菌肽AMP17表达模式的研究①
2019-04-02马慧玲苏佩佩赵欣宇杨隆兵陶如玉
马慧玲 李 妍 苏佩佩 赵欣宇 杨隆兵 陶如玉 国 果
(贵州医科大学基础医学院,贵州医科大学环境污染与疾病监控教育部重点实验室,贵阳 550025)
昆虫抗菌肽是机体先天免疫防御系统的重要组成部分,当机体受到感染性损伤或免疫刺激后,虫体可以产生抗菌肽,以抵御病原体入侵,这些抗菌肽对多种病原物如细菌、真菌、病毒及病原虫均有杀伤作用,且作用机制独特,不会损伤和破坏高等动物的正常细胞[1-6]。自从七十年代中期瑞典科学家Boman[7]发现昆虫抗菌肽Cecropins以来,昆虫抗菌肽已成为生命科学的研究热点。
病原真菌是昆虫病原微生物中最大的一类,约有60%以上的昆虫疾病由病原真菌引起[8]。真菌细胞壁是昆虫识别真菌的靶位置,昆虫可通过对病原真菌细胞壁成分的识别实现免疫防御反应。有研究显示在果蝇、黄粉虫中,革兰氏阴性菌识别蛋白-3(GNBP3)可识别真菌细胞壁成分β-1,3葡聚糖,激活免疫信号通路,参与机体先天免疫防御反应[9-11]。抗菌肽是与昆虫体液免疫密切相关的小分子活性蛋白质。Iijima等[12]从麻蝇(Sarcophaga peregrina)幼虫血淋巴分离出抗真菌肽AFP,该肽能够抑制白色假丝酵母(Candida albicans)生长,并可以与真菌结合造成真菌细胞质泄漏导致真菌死亡[12]。昆虫对外来微生物的抵御是多免疫因子和多免疫组织共同协作的过程。 吕丁丁等[13]研究发现不同家蚕组织在感染白僵菌后,4种抗菌肽基因cecropinA、gloverin2、lebocin1/2 和 lysozyme相对表达水平随时间的变化也不同,说明不同组织对白僵菌有不同的防御机制。正常情况下,昆虫幼虫体内抗菌肽的表达水平不是很高, 但可以被微生物诱导表达。黄玉霞等[14]发现家蚕感染白僵菌后,可能诱导激活Toll信号通路,从而调控 enbocin1 基因上调表达,推测该抗菌肽在抵御球孢白僵菌的侵染过程中发挥重要作用。杨雪等[15]研究发现家蝇抗菌肽muscin 基因在血细胞和脂肪体中表达量最高,通过细菌刺激进行免疫诱导后,幼虫体内该基因的表达水平明显上调,并在 6 h 达到高峰,推测该基因参与家蝇抗菌免疫反应。
家蝇(Musca domestica)属于世界性分布的昆虫,是一种卫生害虫又是一种重要的资源昆虫,大量研究表明其拥有强大的先天免疫系统[16-18]。AMP17是本课题组在前期研究中,从微生物诱导的家蝇转录组数据组中筛选到一条特异性高表达的基因[19,20]。我们采用原核表达系统,克隆表达并纯化得到了重组MD-AMPs-17蛋白,该重组蛋白在体外显示了较强的抗真菌活性[21]。为了进一步了解该基因在家蝇免疫防御反应中的作用,本研究探讨了经白色念珠菌胁迫后,AMP17的时空表达模式,为进一步揭示该蛋白的功能及家蝇抗真菌机制奠定一定的实验基础。
1 材料与方法
1.1材料
1.1.1动物材料与菌种 实验家蝇由贵州医科大学病原生物学实验室饲养,饲养温度28℃,相对湿度65%,光照周期10L:14D,3龄幼虫均重26.5 mg。白色念珠菌(ATCC10231)为贵州医科大学微生物教研室王涛博士惠赠。
1.1.2主要试剂和仪器 Trizol、SYBR Premix Ex TaqTMⅡ、PrimeScript RT reagent Kit with gDNA Eraser、焦碳酸二乙酯(DEPC)、RNA保护剂(均购自大连宝生物TaKaRa公司);去RNA酶EP管、PCR耗材(美国Sigma公司);异丙醇、无水乙醇、氯仿、磷酸盐缓冲盐溶液(PBS)及滤纸均购自贵州索莱宝贸易有限公司。
ABI7300荧光定量PCR仪(美国ABI公司)、移液器(德国Eppendorf公司)、PCR扩增仪(德国Eppendorf公司)、显微解剖镜(尼康)、显微超微量注射仪(美国)、Milli-Q超纯水仪(法国Millipore Pharmacia公司)、Allegra 64R 冷冻高速离心机(美国BECKMAN公司)。
1.2方法
1.2.1标本制备 将白色念珠菌在沙氏固体培养基上转种2次,之后挑取单克隆接种于沙氏液体培养基中培养,收集对数生长期的白色念珠菌,用无菌PBS缓冲液将菌液稀释至1.0×108cfu/ml。以白色念珠菌作为感染源,通过显微超微量注射仪注射家蝇第2天幼虫,注射浓度为:1.0×108cfu/ml,注射体积210 nl,设置为实验组,注射等体积PBS缓冲液为对照组。分别收集显微注射3 h、6 h、12 h、24 h、36 h、48 h后的整虫标本以及受胁迫后3 h、12 h、48 h 家蝇幼虫不同组织(体壁、脂肪体、马氏管、中肠、唾液腺、气管、血淋巴)标本。
1.2.2家蝇幼虫组织标本解剖 选取受胁迫后3 h、12 h、48 h家蝇幼虫,浸泡在盛有生理盐水的培养皿中,剪头法收集血淋巴,用小剪刀自虫体末端沿体壁剪一个小口可见体液溢出,然后小心翼翼沿伤口处剪向头端。在显微解剖镜下用镊子拨开体壁,分离脂肪体、中肠、马氏管、唾液腺、气管。
1.2.3总RNA的提取及cDNA合成 对所收集的标本,按照Trizol法提取总RNA,检测其浓度和纯度后,按照cDNA合成试剂盒说明书分别合成cDNA,于-20℃冰箱保存备用。
1.2.4引物的设计与合成 以RPS18为内参基因,根据RPS18及AMP17基因的cDNA序列运用primer5.0软件设计实时荧光定量PCR引物。引物由TaKaRa公司合成,其序列如下:AMP17-F:5′-TGGGATGTGTTGGTTCCGATT-3′;AMP17-R:5′-CGCTACTTCAATGGAACTGGT-3′。RPS18-F:5′-AAGGGTGTGG-GTCGCCGTT-3′;RPS18-R:5′-GCAATGGGTTGGAGA-TGAT-3′。
1.2.5实时荧光定量PCR 取上述家蝇幼虫感染后不同时间点(3 h、6 h、12 h、24 h、36 h、48 h)及感染后3 h、12 h、48 h的家蝇幼虫不同组织(体壁、马氏管、脂肪体、肠、唾液腺、血淋巴、气管)的cDNA(1∶10稀释)为模板,RPS18为内参基因,按照TaKaRa SYBR Premix Ex TaqTMⅡ(Perfect Real Time)试剂盒说明,使用ABI PRISM7300(ABI,USA)进行real-time PCR,每个样品重复3次,每组3个重复。 反应体系为:SYBR Premix Ex Taq Ⅱ(2×)10 μl;上游引物 0.8 μl;下游引物 0.8 μl;ROX Reference DyeⅠ(50×)0.4 μl;cDNA 1.0 μl;ddH2O 7.0 μl。反应程序:95℃预变性10 s;95℃变性10 s,58℃退火1 min,共40个循环。PCR反应结束后收集数据进行分析。
1.3统计学分析 本实验采用2-ΔΔCT方法计算并分析实验数据,运用SPSS15.0对实验数据进行统计学分析,单因素方差分析进行组间比较,以P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义,使用Graphpad Prism 5绘图。
2 结果
2.1AMP17基因在显微注射感染白色念珠菌的家蝇幼虫不同时间点的表达情况 经白色念珠菌胁迫后, 实验组幼虫的AMP17基因表达量较对照组明显上调,在48 h该基因表达量达到最高,差异具有统计学意义(P<0.05),其次是3 h、6 h、12 h,差异均具有统计学意义(P<0.05)。而在感染后24 h和36 h,该基因的表达量出现下调趋势。 总体上家蝇AMP17基因的表达量随时间的推移呈现先升高后降低再升高的状态(图1)。
2.2AMP17基因在显微注射感染白色念珠菌不同时间点的家蝇幼虫不同组织的表达情况 根据家蝇感染白色念珠菌后不同时间点AMP17基因的表达情况,选取经胁迫后3 h、12 h、48 h的幼虫,显微解剖镜下分离各组织(图2),分析家蝇AMP17基因在各组织(体壁、脂肪体、马氏管、中肠、唾液腺、气管、血淋巴)的表达量。在3 h时,以PBS组为对照进行计算,体壁表达量最高,上调了6.59倍,差异具有统计学意义(P<0.01),其次为气管,上调了4.74倍;血淋巴和脂肪体呈现下调趋势(图3A)。在12 h时,以PBS为对照组进行计算,体壁表达量最高,上调了5.54倍(P<0.01),其次为血淋巴,上调了1.87倍(P<0.05);气管、脂肪及唾液腺呈现下调趋势(图3B)。在48 h时,以PBS为对照组进行计算,体壁表达量最高,上调了10.98倍(P<0.05);其次为唾液腺,上调了7.28倍(P<0.05)。血淋巴、中肠及马氏管呈现下调趋势(图3C)。

图1 AMP17经显微注射白色念珠菌诱导后家蝇幼虫中的表达差异Fig.1 Variation in expression of AMP17 gene in Musca domestica larvae after microinjected Candida albicans

图2 家蝇幼虫不同组织标本Fig.2 Different tissue specimens from Musca domestica arvae
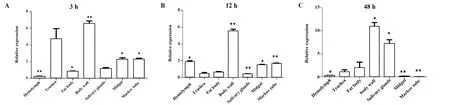
图3 AMP17经白色念珠菌诱导后家蝇幼虫中不同组织的表达差异Fig.3 Variation in expression of AMP17 gene in Musca domestica larvae after Candida albicans induction
3 讨论
基因表达是指基因指导下的蛋白质合成过程,是调控生命活动的重要机制,不同发育阶段、不同生理状态下基因的表达决定了整个生命过程包括发育和分化、内环境稳定、对逆环境的反应等,因此比较不同发育阶段、不同生理状态下的基因表达情况可为分析不同生命活动过程提供重要信息[22]。当受到病原体或环境因素胁迫时,昆虫机体会做出快速有效的免疫应答。抗菌肽是昆虫体液免疫的重要效应分子,在受到感染和损伤时,昆虫的抗菌肽能够迅速合成,在信号肽酶的作用下成为有活性的物质,参与机体免疫应答[23]。
本研究中,经白色念珠菌胁迫后,AMP17基因的表达量随时间的推移呈现先升高后降低再升高的状态。可能在反应初期,AMP17基因的表达量应激性增高, 抗菌肽迅速合成,作为主要效应分子参与免疫应答,抵御损伤和病原体;之后,可能由于其他防御物质表达增加,或一些抑制因子的表达,使得机体对AMP17的需求减少以维持机体免疫稳态,以至在诱导后 24~36 h 有一个降低的过程[24];随着时间的延长,存活的白色念珠菌数量不断增长,48 h AMP17出现上调最高峰,可能是由于机体被大量真菌攻击后,激活了体内的信号通路,诱导产生更多抗菌肽以应对病原体的侵害,提示AMP17基因参与了家蝇先天免疫的后期调节[25]。昆虫对外来微生物的抵御是多免疫因子和多免疫组织共同协作的过程[26,27]。本研究还发现受到白色念珠菌胁迫后,AMP17 基因在不同家蝇组织相对表达水平随时间的变化也有不同,说明不同组织对白色念珠菌有不同的防御机制。体壁是昆虫直接接触外界环境的重要组织,是保护机体免受外界各种刺激和损伤的第一道防线,它不仅是机体的物理屏障,同时也作为免疫器官发挥作用,相关研究指出,当机体受到微生物侵染时,昆虫幼虫的体壁能够启动免疫应答应对挑战[28,29]。显微注射白色念珠菌3 h、12 h、48 h后,体壁呈现高表达,推测是针刺感染的过程中的应激反应,体壁损伤后,激活机体免疫系统,产生大量的免疫相关因子,从而达到防御外源病原体的入侵并修复损伤的目的[30]。血淋巴及脂肪体为昆虫的主要免疫器官,参与昆虫的免疫应答反应[31,32]。本次研究中,血淋巴、脂肪体及唾液腺在白色念珠菌诱导后,表达水平相对较低,但将诱导12 h较3 h的相对表达水平相比较,都有上升趋势,且脂肪体及唾液腺在诱导48 h时达到高峰,与不同时间点诱导结果相符。
综上所述,AMP17基因参与了家蝇免疫应答反应,是家蝇免疫应答的关键分子之一,在家蝇先天免疫中扮演着重要的角色。本研究结果有利于深入理解家蝇乃至其他昆虫抵御真菌侵染的防御机制,为进一步探讨家蝇先天免疫系统提供新的思路。
