重金属铜化学发光酶联免疫快速检测方法的建立①
2019-04-02程龙球黄建芳朱柳蓉向军俭
杨 浩 程龙球 黄建芳 朱柳蓉 刘 洋 向军俭
(暨南大学抗体工程研究中心,生命科学技术学院生物工程学系,广东省分子免疫与抗体工程重点实验室,广州 510632)
重金属广泛分布于自然界,随着城市的急速扩张和工业的快速发展,大量重金属因人为活动以非常态速度进入我们的生活环境,这些重金属及其化合物多有致畸、致癌作用,并且都是蓄积性毒物,通过饮用水、药材或食物链富集等方式进入机体,严重危害人类及动物的健康[1]。
环境污染最严重的重金属包括:铅、镉、汞、铬、砷,此外,还有毒性相对较弱的镍、锌、铜、钴、锡等。虽然重金属铜的毒性相对较弱,但是因其在工业、农业及畜牧业的广泛应用,铜污染的危害也越来越多地引起人们的关注[2,3]。2010年7月3日,福建紫金矿业紫金山铜矿湿法厂发生铜酸水渗漏事故,导致汀江部分河段水质受到严重污染,并造成大量鱼类死亡[4]。铜污染问题不仅在内陆地区突出,近年来近海与河口环境铜污染也日趋严重,“蓝牡蛎”和“绿牡蛎”的出现便是近海河口生物遭受铜污染影响的典型例证[5]。人体摄入过量的铜会引发一系列病变,急性铜中毒可引起恶心干呕、腹痛腹泻等胃肠道黏膜刺激症状,还可造成溶血性贫血、肾功能衰竭、甚至休克昏迷;慢性吸入铜粉尘或摄入铜含量过高,可导致胸闷气憋,进而发展为尘肺,还会对肝和胆造成严重负担,导致新陈代谢紊乱,甚至出现肝硬化、肝腹水等严重疾病[1-6]。另外,铜盐具有一定杀菌效果,在饲料中被广泛使用,但高剂量的铜进入家畜的体内很难被代谢,随着生物累积效应造成家畜中毒死亡,还会因食用家畜肉制品而直接威胁人类健康[7,8]。因此,加强食品和环境卫生的重金属铜的监查检测迫在眉睫。
常规重金属检测方法多采用物理/化学方法,如原子吸收光谱法(AAS)、原子荧光光谱法(AFS)、电感耦合等离子体光谱分析法(ICP)等,虽然其检测结果准确,可信度高,但需要大型仪器设备和专业人员操作,分析时间长,成本昂贵,有一定时间地点局限性,难以适应突发性的环境污染事件或大规模环境质量筛查检测[9-11]。而近年来发展迅速的免疫学快速检测方法因其方便、快捷、灵敏度高、特异性强、费用较低,能满足大批量现场快速检测等特性[12-14],越来越多地受到国内外科研工作者的重视和研究。
化学发光酶联免疫法(Chemiluminescence link-ed enzyme immunoassay,CLEIA)是化学发光法和免疫分析法相互结合的产物,其基本原理是化学发光的强度(相对光单位,RLU)和反应物或产物的浓度呈相关性,同时具有化学发光的高灵敏度和免疫分析的高特异性,其检测线性范围和灵敏度均优于放射免疫分析,方法简单,且无放射性污染,适用于各种抗原、半抗原、抗体、激素、酶、脂肪酸、维生素和药物等的检测[15]。本研究旨在建立检测铜离子的化学发光酶联免疫快速检测方法策略,为监测中草药、食品和环境中重金属铜的污染提供高效、便捷、准确、价廉的新检测方法。
1 材料与方法
1.1材料
1.1.1主要试剂 CuSO4·5H2O(天津大茂化学试剂厂),Pb(Ⅱ)、Mn(Ⅱ)、Cd(Ⅱ)、Zn(Ⅱ)、Mg(Ⅱ)、Ca(Ⅱ)、Fe(Ⅱ)、Cr(Ⅲ)标准液(国家钢铁材料测试中心钢铁研究总院),GBW07602(GSV-1)灌木枝叶、GBW07404(GSS-4)土壤标准物质(国家标准物质网),HNO3[AR](广州化学试剂厂),p-SCN-Bn-NOTA(2-S-(4-Isothiocyanatobenzyl)-1,4,7-triazacyclononane-1,4,7-triacetic acid)双功能螯合剂、单NOTA(Macrocyclics),鸡卵清蛋白OVA(Sigma),铜离子完全抗原Cu-NOTA-OVA、铜离子单克隆抗体细胞株4F12及纯化抗体[16](暨南大学抗体工程中心),羊抗鼠IgG-HRP(广州国奥生物技术有限公司),HRP化学发光底物(北京科跃中楷生物技术有限公司),96孔黑色酶标板(Greiner Bio-one),BCA蛋白浓度测定试剂盒(碧云天生物技术研究所),30 kD超滤管、超纯水(Millipore),植物中草药样品(13份)由广州地理研究所馈赠,土壤样品(18份)由暨南大学环境学院馈赠。
1.1.2主要仪器 Synergy H1多功能微孔板检测酶标仪(BioTek),数字pH计(Mettler-Toledo),磁力搅拌器(IKA),分析电子天平(Sartorius),MARS6微波消解仪(PyNN·CEM),GS-1赶酸仪(南京瑞尼克科技开发有限公司),AKTA蛋白纯化仪、CoolSafe真空冷冻干燥机(Gene),CO2细胞培养箱、X-Series 2电感耦合等离子体发射光谱质谱仪(Thermo Fisher Scientific),PinAAcle AA900T火焰石墨炉一体原子吸收光谱仪(PerkinElmer)。
1.2方法
1.2.1间接竞争CLEIA法的建立 将检测完全抗原稀释至最佳工作浓度(100 ng/ml)后,100 μl每孔包被黑色酶标板,4℃过夜;PBST缓冲液洗涤后(后文简称“洗涤后”),200 μl每孔5%(w/v)脱脂奶粉封闭液37℃封闭40 min;洗涤后,每孔加入50 μl系列梯度浓度(0~400 ng/ml)竞争物标准品Cu-NOTA和50 μl稀释至最佳工作浓度(48 ng/ml)的单抗,以PBS缓冲液作空白对照,混匀后37℃孵育1 h;洗涤后,每孔加入100 μl稀释至工作浓度(1∶8 000)的HRP酶标羊抗鼠二抗,37℃孵育40 min;洗涤后,每孔加入平衡至室温(10 min)的HRP鲁米诺化学发光底物A、B液各50 μl,室温避光反应10 min,上机读取发光信号(过程原理如图1所示)。每一检测采用3个平行组均值,计算标准曲线与线性参数。
1.2.2间接竞争CLEIA法的性能评价 在方法线性范围内,配制低、中、高(10、40、70 ng/ml)3种浓度标准液,平行重复5次,测定并计算实际检测浓度,评价其准确度与精密度;制备Pb2+、Mn2+等金属离子半抗原母液,ICP-AES测定其浓度后配制相应梯度浓度半抗原工作液,用以替代铜半抗原标准液,按间接竞争CLEIA法检测并计算各金属IC50值,再通过公式Cross reactivity(%)=[IC50(铜离子)/IC50(其他金属离子)]×100%,测定重金属铜单抗与Pb2+、Mn2+等金属离子半抗原及单NOTA的交叉反应,平行重复3次,计算交叉反应率并评价其特异性;将包被封闭后的酶标板在-20℃避光保存2、4、6、8周后,分别拿出测定低、中、高(10、40、70 ng/ml)3种浓度标准液,平行重复3次,测定并计算检测浓度,通过SPSS软件进行相关性统计学分析,评价其稳定性。
分别在自来水、校园明湖水、灌木枝叶(GSV-1)消解液、土壤(GSS-4)消解液中添加低、中、高(10、40、70 ng/ml)3种浓度标准液,平行重复3次,测定并计算回收浓度,评价本方法分析过程中系统误差的影响。
1.2.3对植物中草药和土壤样品检测效果的评价
1.2.3.1植物中草药和土壤样品的检测前处理 采用微波消解联合沉淀法对样品进行前处理:将固体类植物中草药(13份)和土壤(18份)样品先干燥至恒重,再用粉碎机和研钵分别粉碎样品至均一小颗粒粉末状。准确称量0.200 0 g样品,加入8 ml HNO3(土壤样品加入反王水8 ml,即6 ml HNO3与2 ml HCl),通风橱过夜或赶酸仪130℃预热30 min预消解;选择合适消解程序消解样品(130℃爬升10 min,保持3 min;160℃爬升3 min,保持5 min;180℃爬升3 min,保持40 min;冷却);赶酸仪180℃赶酸后定容至合适量程(植物中草药和土壤样品分别定容至10 ml和25 ml);消解液经滤纸过滤后再经0.22 μm 滤器过膜除杂;取5 ml定容液,通过1.0 mol/L NaOH调节溶液pH至中性,并加入 200~400 μl 1%絮凝剂(聚丙烯酰胺,PAM),静置15 min后 2 000 r/min 离心5 min,去上清收集沉淀(可将铜与大多金属离子有效分离);再通过稀HNO3溶液缓慢复溶沉淀用于制备待测样品[3,9,13,17-20]。

图1 间接竞争化学发光酶联免疫法反应原理Fig.1 Reaction principle of indirect competitive CLEIA
将标准物质灌木枝叶(GSV-1)和土壤(GSS-4)以及空白对照HNO3与样品一同消解,石墨炉原子吸收法(AAS)测定标准物质实际铜含量,计算消解回收率,以评估消解过程是否合格。
1.2.3.2植物中草药和土壤待测样品的检测 配制4 μg/μl单NOTA螯合剂,取前处理复溶后的植物中草药和土壤样品液5 ml,分别加入(5±1)μl和(40±8)μl单NOTA与样品液中的铜离子偶联15 min,制备具有反应原性的铜离子半抗原待测样品[10,13,21,22];调节溶液pH至中性后通过间接竞争CLEIA法进行检测(样品的实际检测以50 μl稀释一定倍数的样品液替代50 μl竞争物标准品Cu-NOTA,其余步骤与1.2.1间接竞争CLEIA法的建立相同)。以重金属测定金标准ICP-AES仪器法(暨南大学分析测试中心)检测结果为对照,采用SPSS软件进行相关性统计学分析,以评价方法可靠性。
2 结果
2.1间接竞争CLEIA法的建立与性能评价
2.1.1标准曲线的建立 将0 ng/ml标准品孔的发光信号值定为B0,其他孔为B,以检测抑制率(B0-B)/B0×100%为纵坐标,以Cu2+浓度log10对数为横坐标,绘制标准抑制曲线。如图2所示,标准曲线线性回归方程为y=41.386x-1.865 5,R2=0.995,检测灵敏度(IC50)为17.9 ng/ml,检测限(IC10)为1.9 ng/ml,线性范围为3.0~200 ng/ml。满足GB5749《生活饮用水卫生标准》、GB3838《地表水环境质量标准》、GB15618《土壤环境质量标准》、《中国药典》、《中医药-中药材重金属限量》等规定的铜最低限量值0.01 mg/L的检测要求。
2.1.2准确度与精密度评价 在方法线性范围内,测定低、中、高3种浓度标准液,计算准确度回收率为98.8%~105.5%,精密度RSD≤5.0%(如图3所示),符合重金属残留分析检测要求。
2.1.3特异性评价 各金属离子及单NOTA交叉反应率如图4所示。除Mg2+、Zn2+分别与铜单抗有13.3%、3.3%的交叉反应率外,其余金属交叉反应率均小于或近似于1%,其特异性总体良好,满足检测要求。
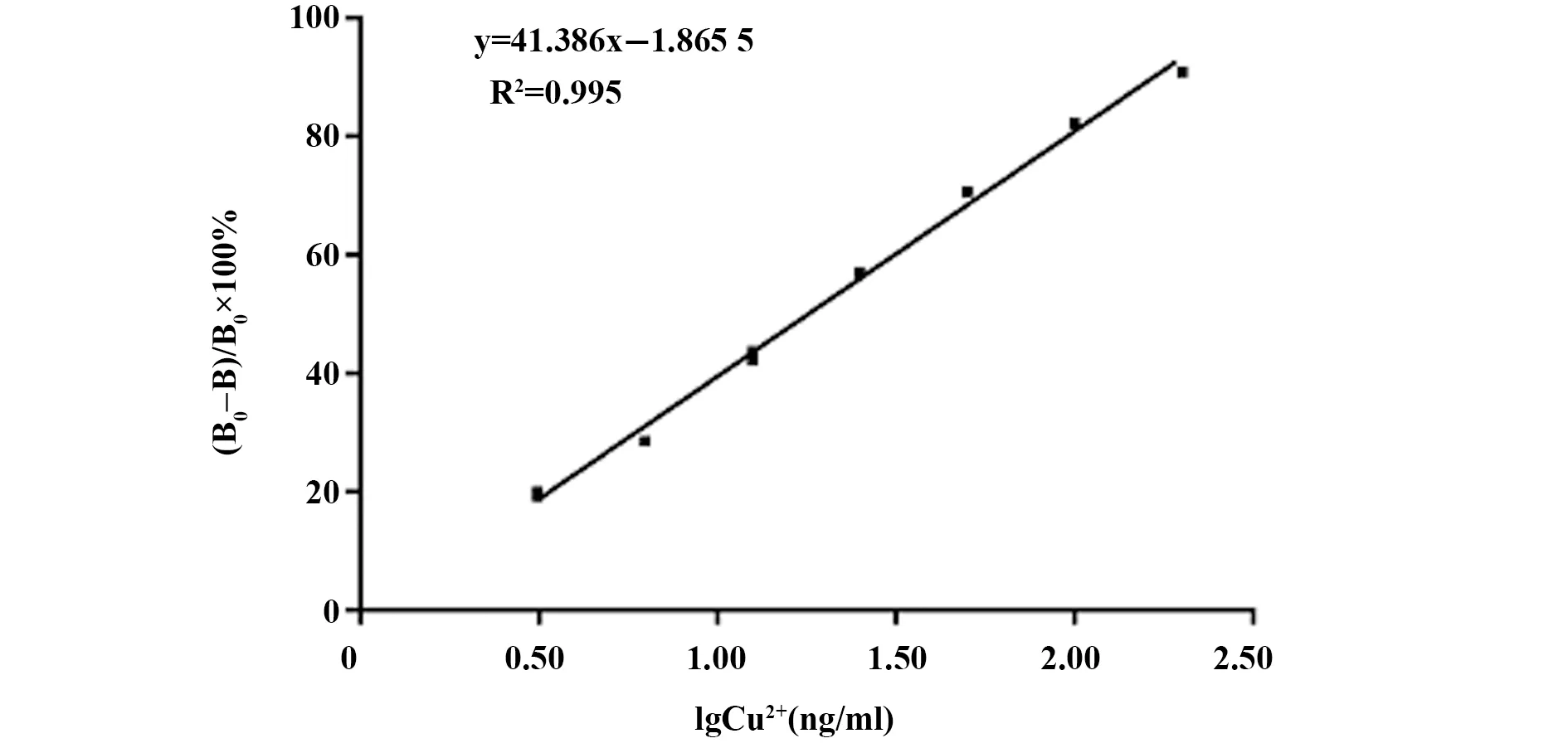
图2 间接竞争CLIEA法标准曲线Fig.2 Standard curve of indirect competitive CLEIA

图3 间接竞争CLEIA法准确度与精密度试验Fig.3 Accuracy and precision test of indirect competitive CLEIA
2.1.4稳定性评价 将包被封闭后的酶标板在-20℃避光保存2、4、6、8周后,分别拿出测定低、中、高3种浓度标准液,计算检测浓度。以0周酶标板标准液测定值为基准,通过SPSS软件分析各周不同标准液检出值,如图5所示,第8周低浓度(10 ng/ml)标准液实际检测值与基准值出现显著性差异(P<0.05),提示包被封闭后的酶标板在-20℃避光保存6周以内使用为佳。

图4 间接竞争CLEIA法特异性试验Fig.4 Specific test of indirect competitive CLEIA
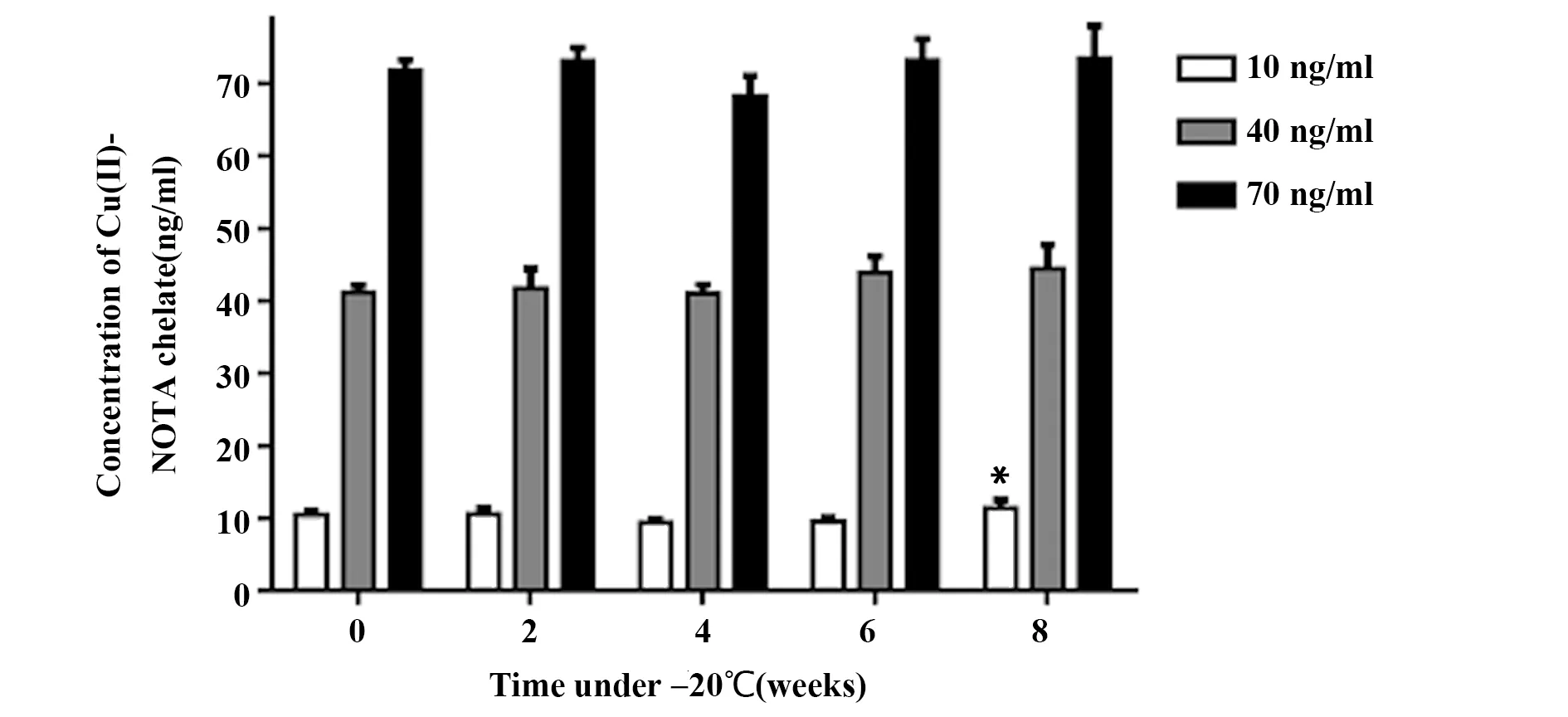
图5 间接竞争CLEIA法稳定性试验Fig.5 Stability test of indirect competitive CLEIA
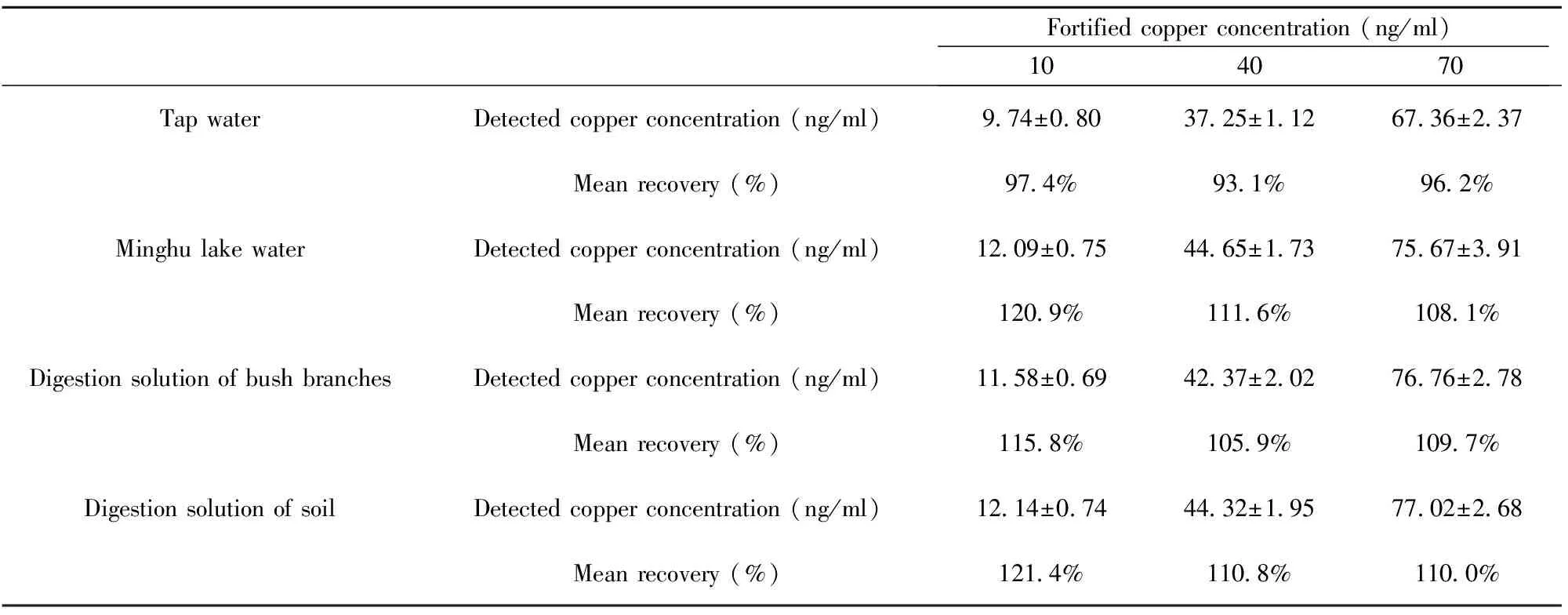
表1 间接竞争CLEIA法铜离子添加回收率Tab.1 Add recovery rate of copper ions by indirect competitive CLEIA
2.1.5添加回收试验 各溶液添加回收试验结果如表1所示。对比可知,低浓度添加回收率略高于高浓度,提示低浓度样本在检测体系中可能更易受到系统误差的干扰影响。此外,溶液基质成分相对简单的自来水添加回收率也优于相对复杂的校园明湖水以及灌木枝叶和土壤消解液,提示溶液基质成分越简单,实际检测值的准确性越高,回收率更好,对检测系统的干扰更小。

表2 标准物质标准铜含量及测定结果Tab.2 Standard and detected copper content of stand-ard substances
2.2植物中草药和土壤样品微波消解回收率计算 标准物质的标准铜含量及消解后实测铜含量结果详见表2,灌木枝叶和土壤标准物消解回收率经计算分别为88.8 %与107.4 %,消解合格。
2.3植物中草药和土壤待测样品的制备与检测
2.3.1植物中草药样品中铜含量的测定 制备植物中草药待测样品(13份)后,由间接竞争CLEIA法与ICP-AES仪器法分别对同一样品铜含量进行测定,结果详见表3。采用SPSS软件进行相关性统计分析,相关系数为0.972,两种方法检测结果无显著性差异(P>0.05),表明间接竞争CLEIA法可应用于一般植物样品中铜含量的测定。
2.3.2土壤样品中铜含量的测定 制备土壤待测样品(18份)后,由间接竞争CLEIA法与ICP-AES仪器法分别对同一样品铜含量进行测定,结果详见表4。采用SPSS软件进行相关性统计分析,相关系数为0.989,两种方法检测结果无显著性差异(P>0.05),表明间接竞争CLEIA法可应用于一般土壤样品中铜含量的检测。
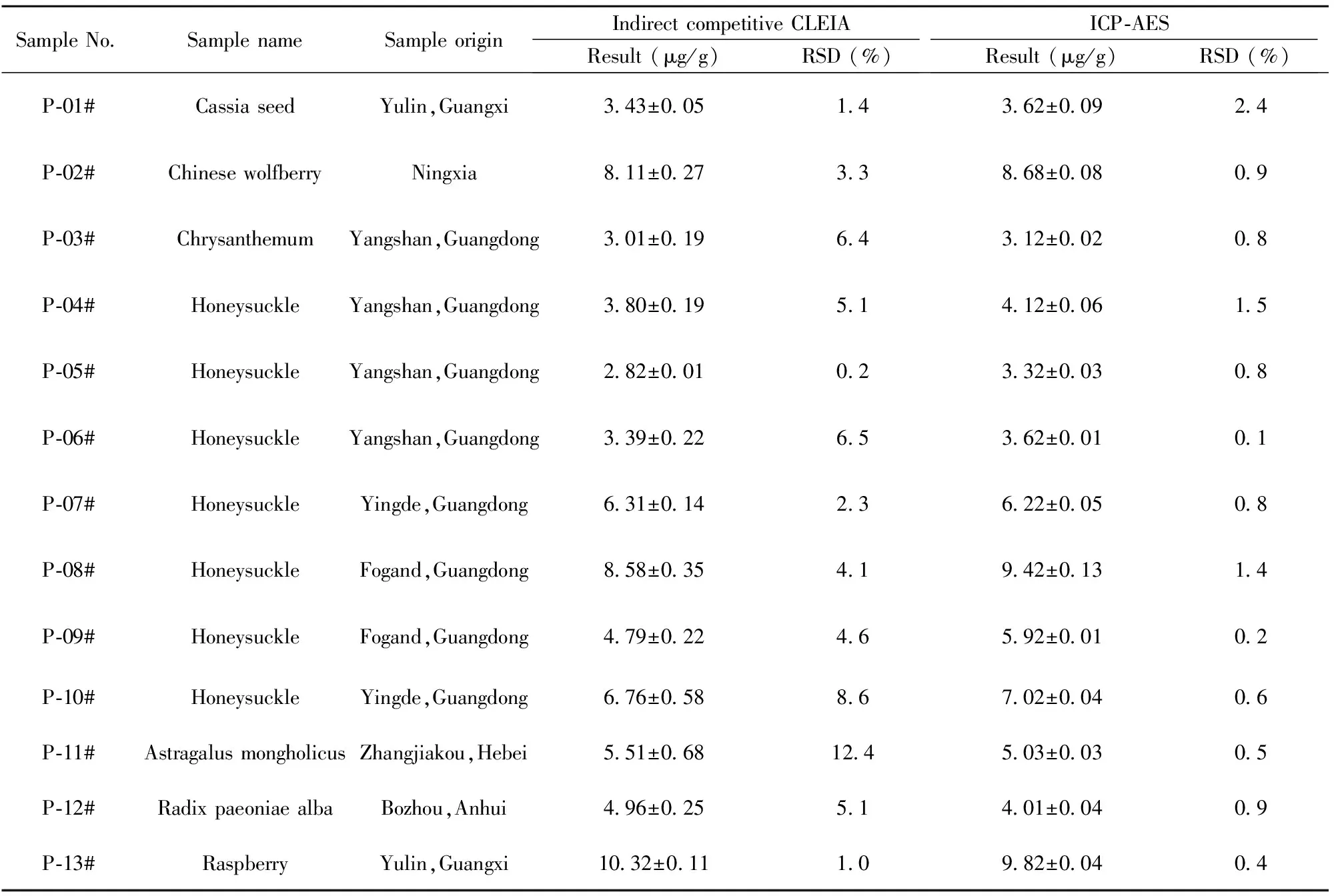
表3 中草药植物样品重金属铜含量测定结果Tab.3 Determination of copper content in herbal plants samples

表4 土壤样品重金属铜含量测定结果Tab.4 Determination of copper content in soil samples
3 讨论
本研究使用p-SCN-Bn-NOTA双功能螯合剂偶联重金属铜离子与载体蛋白以制备重金属完全抗原并免疫小鼠获得抗重金属铜单克隆抗体,以此抗原、抗体为基础建立化学发光酶联免疫法,并将其应用于固体类植物中草药和土壤样品中铜含量的实际检测,在已有文献中少有相关方面的报道。
本方法灵敏度、检测限等参数均符合国家法定相关样品铜离子检测技术指标的要求,且优于传统ELISA方法,为重金属免疫学检测新型试剂盒的研发提供了依据。相对于常规重金属大型仪器检测法,本研究方法具有方便、快捷、灵敏度高、特异性强、费用较低,能满足大批量现场快速检测等特性,且在中草药植物和土壤样品的实际检测应用中与ICP-AES仪器法相比具有良好的相关性(相关系数>0.95)。相对于郝代玲等[16]建立的铜间接竞争ELISA,检测灵敏度为28.9 ng/ml以及Kong等[25]建立的铜间接竞争ELISA,检测限为3 ng/ml,本研究所用的化学发光酶联免疫间接竞争法,检测灵敏度为17.9 ng/ml,检测限为1.9 ng/ml,均有提升。
重金属在实际环境样品中多以固体化合物形式存在而不能直接检测,需要对其进行前处理使之释放于液相环境中来,且样品前处理的好坏直接关系到后续检测的准确性。本研究通过微波消解联合沉淀法对环境样品进行前处理,并与单NOTA偶联制备具有反应原性的半抗原待测样品。微波消解法作为一种新型样品前处理方法,具有样品处理简单、消化程度完全、回收率高、对环境污染小、劳动强度相对较低等优点,使其在重金属样品前处理中得到广泛应用[21,26]。沉淀法工艺简单、操作方便、经济实用,且针对各金属离子的沉淀平衡常数(pKsp)可通过调节不同的溶液pH值来实现不同金属离子的沉淀、分离和回收[19,20]。免疫学检测技术理论上适用于任何一种能产生抗体的被分析物,针对不同重金属设计和制备其抗原、抗体,可使重金属免疫学检测技术进一步推广。探索不同环境样品的个性化前处理方式,降低复杂样品的基质干扰以及开发更为简便快捷的重金属免疫学快速检测方法(如试纸条法)仍是关键问题。
