Xpert MTB/RIF Ultra诊断结核性脑膜炎的价值
2019-04-02张培泽郑俊峰付亮李天品袁星燎刘厚明邓国防
张培泽 郑俊峰 付亮 李天品 袁星燎 刘厚明 邓国防
结核性脑膜炎(tuberculous meningitis,TBM)是由结核分枝杆菌引起的中枢神经系统感染性疾病,临床上由于早期快速诊断存在困难,常常导致治疗延误,进而导致较高的致残率及致死率。2013年开始,WHO推荐Xpert MTB/RIF(Cepheid公司,美国;简称“Xpert”)用于儿童及成人肺内外结核病的初始快速诊断[1]。Xpert MTB/RIF Ultra(简称“Xpert Ultra”)是在GeneXpert平台上开发的新的全自动巢式实时PCR技术,非劣性试验证实其在诊断结核方面具有良好的敏感度和特异度[2],但该技术在国内结核病患者中的应用未见报道。本试验采用前瞻性的研究方法,对临床疑似结核性脑膜炎患者的脑脊液进行检测,比较Xpert Ultra、Xpert及液体培养法3种检测技术的敏感度和特异度,探讨Xpert Ultra在早期诊断结核性脑膜炎中的应用价值。
资料和方法
一、 研究对象
选取深圳市第三人民医院2018年2月1日至12月31日临床疑似中枢神经系统结核感染的非HIV感染患者21例。对所有患者的脑脊液进行常规、生化、腺苷脱氨酶(ADA)检查,并采用Xpert Ultra、Xpert及液体培养法对患者的脑脊液进行结核分枝杆菌检测。
本研究方案获得本院医学伦理委员会的批准。
二、试验方法
1.标本的收集和制备:收集每例患者脑脊液4~6 ml,1~2 ml用于Xpert Ultra检测, 1~2 ml用于Xpert检测,1~2 ml用于分枝杆菌液体培养,所有标本均未使用离心富集法。
2.仪器与试剂: Xpert检测系统购自美国Cepheid公司,Xpert试剂盒及标本处理液购自美国Cepheid公司; Xpert Ultra试剂盒由美国Cepheid公司赠送用于临床科研。BACTEC MGIT960系统及其配套试剂(MGIT生长指示管,分枝杆菌培养添加剂试剂盒,分枝杆菌联合药敏试剂盒)购自美国BD公司。
3.脑脊液Xpert Ultra检测:取1~2 ml脑脊液,按照说明书操作指南加入标本处理液后放入仪器中进行核酸扩增,70 min仪器会自动输出检测结果,即菌量及是否对利福平耐药。当插入序列IS6110 和IS1081基因片段特异性探针为阳性时即为检测到MTB。利福平耐药状态根据rpoB基因4条特异性探针的熔解温度来判断。将rpoB特异性探针的熔解温度与系统预设的野生型菌株的熔解温度进行对比,如一致,即为利福平敏感;否则,提示利福平耐药。
4.脑脊液Xpert检测:取1~2 ml脑脊液,按照说明书操作指南加入标本处理液后放入仪器中进行核酸扩增,2 h内仪器会自动输出检测结果,即菌量及是否对利福平耐药,当6条探针中除了质控探针(SPC)外至少2条特异性探针为阳性时,提示MTB感染。对利福平耐药性的判断基于MTB特异性探针的Δ循环阈值(cycle threshold,Ct)(即最大Ct值与最小Ct值之差)。当ΔCt>3.5时,提示利福平耐药;当ΔCt≤3.5则提示利福平敏感。
5.液体培养法:采用BACTEC MGIT 960培养系统进行液体培养,参照美国BD医疗器械(上海)有限公司提供的《MGIT液体培养操作手册》进行标准化操作。 取处理好的脑脊液标本1~2 ml加入液体培养管中,并放入BACTEC MGIT 960液体培养系统中进行培养;培养阳性的标本进一步行药敏试验。
6.实验分组:所有患者按照入组时间进行排序。参照2010年国际TBM协作组制定的诊断标准[3],以临床评分≥6分作为参考标准,对研究对象进行分组:(1)结核性脑膜炎组:符合临床诊断标准,同时临床评分≥6分;共15例;其中确诊组5例:即符合临床诊断标准,同时脑脊液结核分枝杆菌培养阳性;很可能组8例:即符合临床诊断标准,同时临床评分≥10分(无神经影像学表现)或临床评分≥12分(伴神经影像学表现),同时排除其他类型脑膜炎;可能诊断组2例:即临床评分6~9分(无伴神经影像学表现);(2)非结核性脑膜炎组:不符合结核性脑膜炎临床诊断标准,未进行抗结核治疗,排除TBM,共6例。所有患者在进行结核检测的同时留取脑脊液进行常规、生化检测。
三、统计学处理
采用 SPSS18.0软件进行统计学分析。不同检测方法之间的敏感度比较采用卡方检验,P<0.05为差异有统计学意义。不同检测方法之间的一致性采用Kappa值表示,Kappa值落于0.0~0.20则一致性极低、0.21~0.40为一般、0.41~0.60 为中等、0.61~0.80为高度一致、0.81~1.00为几乎完全一致。敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%; 特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%;阴性预测值=真阴性例数/(真阴性例数+假阴性例数)×100%。
结 果
一、各方法的检测结果
1. 15例结核性脑膜炎患者中,10例患者脑脊液Xpert Ultra检测阳性,阳性率66.7%。1例检测值为“低(low)”,7例检测值为“极低(very low)”,2例检测值为“微量(trace call)”。4例患者脑脊液Xpert检测阳性,阳性率26.7%。4例患者脑脊液培养阳性,阳性率26.7%。在单纯Xpert Ultra阳性的5例患者中,例2为抗结核药物治疗10 d后采集的脑脊液,该患者在治疗前脑脊液Xpert检测及分枝杆菌培养均为阳性;例12的患者留取脑脊液同时进行了二代测序,提示检出结核分枝杆菌DNA;3例患者(例5、例9、例21)均为全身多系统结核病患者,未行脑脊液其他结核分子生物学诊断。10例脑脊液Xpert Ultra检测阳性的患者中有3例未能判断利福平的耐药性,其中例21患者Xpert Ultra 检测值为“极低”,例6和8患者检测值为“微量”;其他7例患者未发现对利福平耐药,与临床其他标本(痰液、关节液)结核分枝杆菌药敏试验结果一致(表1)。
2. 6例非结核性脑膜炎患者中,排除脑膜炎者4例(1例肝性脑病,1例神经性头痛,2例代谢性脑病),病毒性脑膜炎1例,中枢神经系统肿瘤1例。所有患者的脑脊液进行Xpert Ultra检测、Xpert检测、液体培养的结果均为阴性。
二、各检测方法的诊断效能
Xpert Ultra检测用于脑脊液诊断结核性脑膜炎的敏感度为66.7%,特异度为100.0%,阳性预测值为100.0%,阴性预测值为54.5%。Xpert与培养法结果一致,用于脑脊液诊断结核性脑膜炎的敏感度为26.7%,特异度为100.0%,阳性预测值为100.0%,阴性预测值为35.3%;3种检测方法在诊断敏感度上差异有统计学意义(χ2=4.821,P=0.028)(表2)。
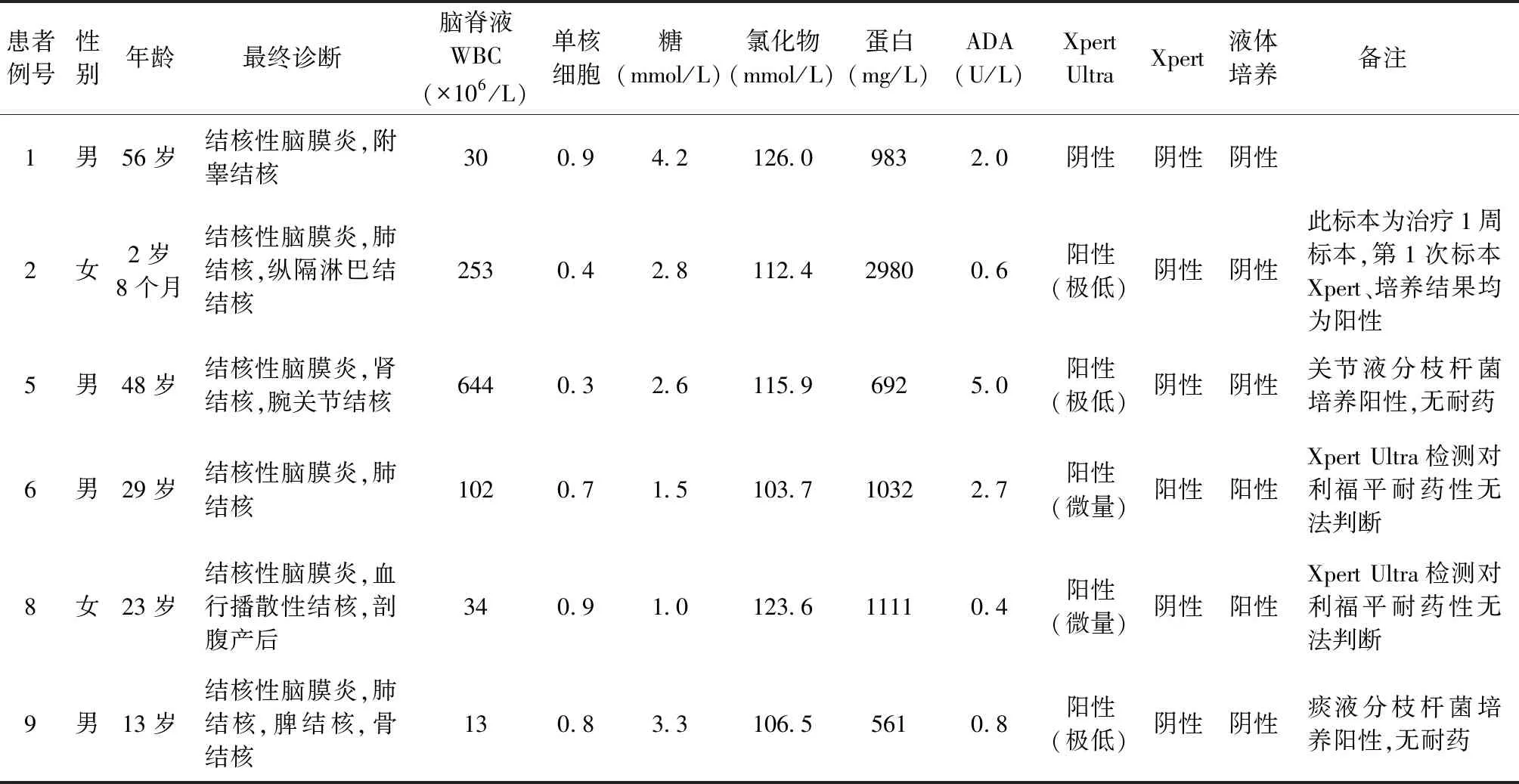
表1 15例结核性脑膜炎患者临床资料和脑脊液实验室检测结果
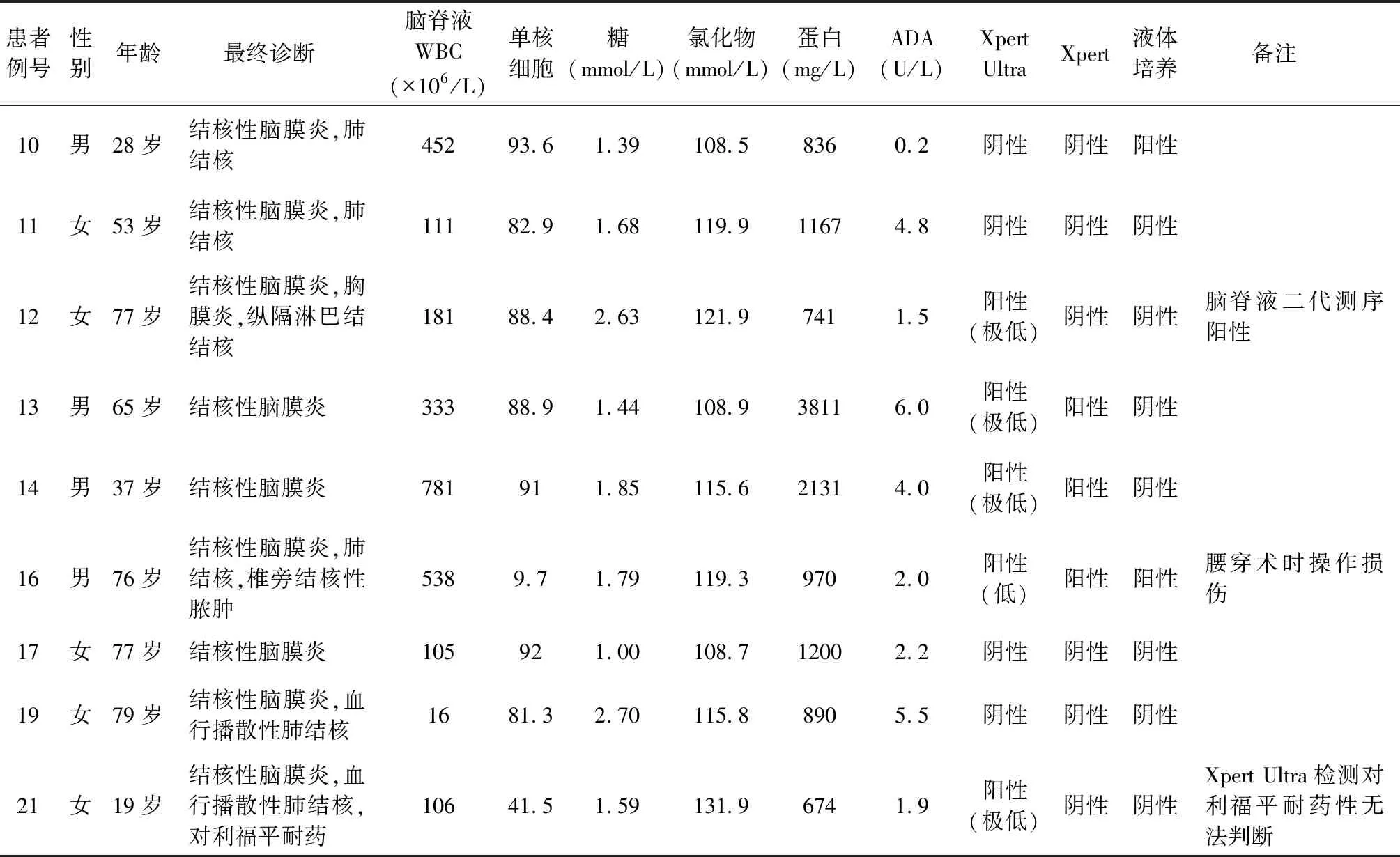
续表1
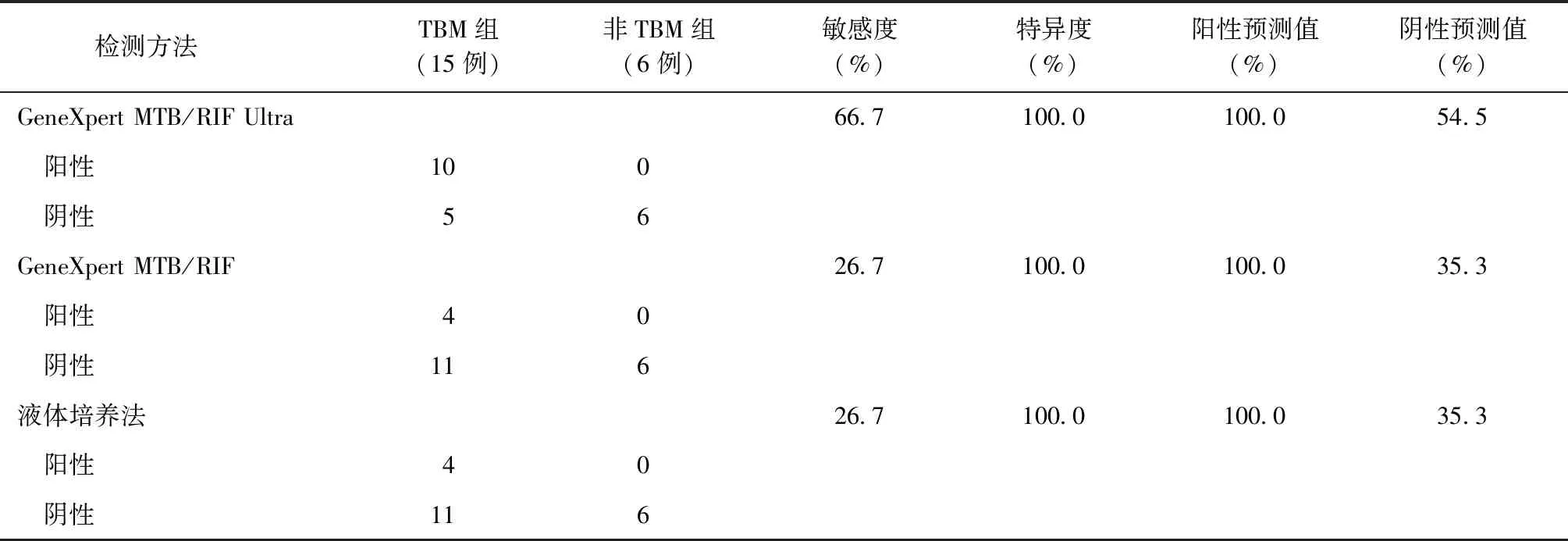
表2 不同检测方法以临床诊断结果为标准对结核性脑膜炎的诊断效能
注3种检测方法检测的标本为脑脊液;敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%; 特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%;阴性预测值=真阴性例数/(真阴性例数+假阴性例数)×100%
三、对3种检测方法的一致性评价
15例结核性脑膜炎患者中,2例3种检测方法均阳性,4例Xpert Ultra检测、Xpert检测阳性,3例患者Xpert Ultra、液体培养阳性(图1)。
讨 论
结核性脑膜炎是严重威胁人类生命的结核病,结核性脑膜炎快速、准确的诊断及制定合理的治疗方案是决定预后的关键因素[4]。传统脑脊液的细胞学检查、生化检查、抗酸染色涂片检查、分枝杆菌培养因敏感度低或耗时过长等原因难以满足临床需要,寻找早期快速准确的诊断方法一直是临床上亟待解决的问题。
一、Xpert Ultra检测技术在诊断结核性脑膜炎中的敏感度问题
近年来研发的Xpert检测技术以rpoB基因为靶基因,实现MTB的分子生物学快速检测及利福平耐药性评价,该技术检测脑脊液诊断TBM的敏感度为23%~41%[5-6],使用6 ml以上的脑脊液离心浓集后再进行检测能进一步提高敏感度[7],但临床上往往难以一次性获得大量脑脊液用于检测,因此其诊断效能仍难以满足临床需求[8]。新一代Xpert Ultra以rpoB和多拷贝的插入序列IS1081、IS6110基因片段为靶基因,使用较Xpert更大的PCR反应管(在Xpert Ultra中为50 μl PCR反应体系,而在Xpert中为25 μl),全巢式PCR技术联合高分辨率熔解曲线(high-resolution melting,HRM)分析技术,与Xpert的114 菌落形成单位(CFU)/ml的检测限(limit of detection, LOD)比较,Xpert Ultra的LOD为16 CFU/ml[9],检测位点增加及检测方法的改进使敏感度进一步提高,特别是对于含菌量较少的标本,其检测效能将进一步提升[10-13]。Xpert Ultra的检测结果在原来Xpert的“高、中、低、极低”4个级别的基础上增加了“微量”,共5个级别。Bahr等[14]报告129例HIV感染患者取脑脊液3~15 ml进行离心浓集后分别采用与本研究一致的Xpert Ultra、Xpert、液体培养法进行检测,在临床判断为“确定”及“很可能”的23例结核性脑膜炎患者中,16例患者Xpert Ultra检测阳性,敏感度为70.0%;而Xpert及液体培养法的敏感度为43%,提示Xpert Ultra具有更高的敏感度。笔者使用1~2 ml非离心浓集的脑脊液进行检测,15例患者中有10例Xpert Ultra阳性,敏感度为66.7%,高于Xpert及培养法26.7%。这一敏感度与Bahr等[14]使用离心浓集后的脑脊液标本的报告结果相似,提示1~2 ml的脑脊液用于Xpert Ultra检测仍具有良好的敏感度。为了验证Xpert Ultra的特异度,笔者分析5例单纯Xpert Ultra检测阳性的患者,其中例2为抗结核药物治疗2周后的标本,该患者在用抗结核药物治疗前脑脊液Xpert及培养均为阳性,结核性脑膜炎诊断明确,而用药2周后仅Xpert Ultra 检测为阳性,Xpert及培养均为阴性;例12在进行Xpert Ultra检测的同时,进行二代测序也提示检出了结核分枝杆菌,病原学诊断结核性脑膜炎成立。例5、例9、例21属多系统结核病患者,痰液结核分枝杆菌检测均为阳性,但因其他原因未能提供足够的脑脊液标本行进一步分子生物病原学检查,参照目前国外应用Xpert Ultra检测的经验,在HIV感染者、儿童、肺外结核标本,检测结果为阳性甚至是“极低值”被认为是真阳性的结果,用于临床决策及患者的随访治疗[2]。因此,笔者认为这3例患者病原学确诊结核性脑膜炎成立。但由于本研究样本量少,对于3种方法检测TBM的敏感度及特异度在判定时可能仍存在一定的偏差,未来需要进一步增加样本量达到更精确的判断。
二、Xpert Ultra检测技术在诊断结核性脑膜炎利福平耐药性中的的问题
Xpert Ultra检测技术采用熔解曲线而不是实时荧光PCR的方法提高了利福平耐药性检测的准确性。Xpert Ultra检测技术使用4条rpoB基因探针检测利福平耐药突变,当目标基因片段上发生突变时会改变其熔解温度,将4条探针的熔解温度与系统内野生型参考值对比,从而判断样本的利福平耐药性状态。 与Xpert检测相比,该方法理论上可以更好地区分沉默突变和导致耐药的突变[9,13,15-16];但当检测值为“微量”时,利福平的耐药性无法判断。本研究中,例6、例8的Xpert Ultra检测值为“微量”,无法进行耐药性判定;例21的Xpert Ultra检测值为“极低”,同样无法进行利福平耐药性判断;这与Xpert Ultra的耐药检测方法相关[9],当Xpert Ultra检测到极少量TB-DNA时,可能出现利福平耐药性检测困难的问题。综合分析7例检测值为“极低”的标本中,仅1例(例21)利福平耐药性无法判断,其他6例患者均明确提示未检测到利福平耐药位点,与其他部位(如痰、关节液)的标本耐药性检测结果基本一致,提示其在检测值为“极低”时仍具有良好的利福平耐药性判断。同样,由于本研究样本量少,尚未能就Xpert Ultra在检测值为“极低”时的利福平耐药性做出明确评价。
因此,基于笔者的初步探索发现,Xpert Ultra在结核性脑膜炎的诊断中具有良好的特异度和优于Xpert 的敏感度。笔者认为将Xpert Ultra用于可疑结核性脑膜炎的早期诊断,将有助于临床进行精准的病原学诊断;当检测到极低及微量的TB-DNA时,存在利福平耐药性判断困难的问题,需要临床进一步对利福平的耐药性进行验证。
