全豆乳液体发酵制备纳豆激酶工艺优化
2019-04-01辛志宏张丽静王凤忠李淑英
倪 楠, 辛志宏, 张丽静, 王凤忠*, 李淑英*
1.南京农业大学食品科技学院, 南京 210095;2.中国农业科学院农产品加工研究所, 农业农村部农产品加工重点实验室, 北京 100193
纳豆激酶是由纳豆枯草芽孢杆菌(Bacillussubtilisnatto)在一定条件下发酵合成的一种碱性丝氨酸蛋白酶,具有直接溶解血栓、间接激活机体血栓溶解系统和抑制机体凝血因子等多效溶栓机制。纳豆激酶的血栓溶解活力是纤溶酶的4倍[1,2],是降低血液粘稠度、疏通血管、改善血液循环和预防心脑血管疾病极有效的功能因子[3,4]。与目前临床应用的溶栓药物尿激酶、链激酶、纤溶酶原激活剂等相比,具有可以口服、高效快速、特异性强、半衰期长、成本低廉、无毒副作用等优点[5]。最新研究发现,纳豆激酶除了能溶解血栓外,对其他疾病的治疗也有潜在作用,例如低血压和玻璃体视网膜疾病[6]。
当前市场上纳豆激酶(nattokinase)的主要来源是纳豆,即大豆通过固体发酵制备的一种即食产品。但是固体发酵不适合大规模工业化生产和纳豆激酶的分离提纯。相比而言,液体发酵生产工艺简单、成本低廉且更利于后期纳豆激酶的富集纯化。因此,研究纳豆激酶的液体发酵工艺显得尤为必要。而多数纳豆激酶液体发酵所用培养基碳氮源主要是蛋白胨、牛肉膏及一些化学试剂[7,8],存在成本较高且不适于功能性食品开发的缺陷。目前已有将纳豆枯草芽孢杆菌直接接种到食品中进行液体发酵的研究,例如Kitamura等[9]将纳豆枯草芽孢杆菌接种至牛奶中,制备含有纳豆激酶的冰激凌产品。吴昱含[10]以豆粕为原料,不仅降低了成本,更是对加工副产品的高效利用。卓晓沁[11]以鹰嘴豆为主要发酵原料,优化了液态纳豆发酵培养基的营养成分和发酵条件。聂光军等[12]将豆浆和牛奶的混合液作为发酵培养基,进行气味和稳定性等研究。
本研究以大豆为原料,制备的豆乳为发酵培养基进行液体发酵工艺优化。首先通过单因素试验,研究液体发酵工艺参数中发酵时间、装液量、接菌量和初始pH对纳豆激酶活力的影响,确定每个因素的最适计量。再通过正交试验进行组合优化,明确最佳工艺参数,以期获得以豆乳为原料生产高活力纳豆激酶的工艺条件,为纳豆激酶的大规模工业化生产奠定基础。
1 材料与方法
1.1 材料与仪器
1.1.1材料与试剂 材料:大豆为市售。菌种:纳豆枯草芽孢杆菌,实验室筛选[13]。
试剂:纤维蛋白原(1.0 g)、凝血酶(1 000 U)、尿激酶(10 000 IU/mg,10 mg)均为Sigma公司产品;蛋白胨、酵母提取物均为英国Oxoid公司产品;氯化钠、氯化钾、琼脂粉等均购于国药集团化学试剂有限公司。
1.1.2主要仪器设备 电子分析天平AL204、pH计FE28[梅特勒-托利多仪器(上海)有限公司];生化培养箱LRH-250(上海一恒科学仪器有限公司);超净工作台ZHJH-011128(上海智城分析仪器制造有限公司);离心机3K15[曦玛离心机(扬州)有限公司];生化培养箱LRH-250(常州中成仪器制造);高压灭菌锅GI36T[致微(厦门)仪器有限公司];恒温摇床RH-QA(常州中诚仪器制造有限公司);豆浆机RD-808T(合肥荣事达小家电有限公司)。
1.2 方法
1.2.1菌种活化 将-80℃保存的纳豆枯草芽孢菌株转接至LB固体培养基,37℃恒温培养12 h备用。
1.2.2种子液培养 挑取单菌落,接入20 mL LB液体培养基(50 mL 三角瓶),37℃ 200 r/min,摇床恒温培养12 h,取1 mL接入100 mL LB液体培养基(250 mL三角瓶),37℃ 200 r/min,摇床恒温培养12 h备用。
1.2.3发酵豆乳制作工艺流程 大豆清洗→浸泡(40℃水浴6 h)→沥干加水煮制豆乳(豆水比1∶8)→接种(菌液)→发酵→离心取上清→测酶活。
1.2.4尿激酶标准曲线 本试验应用的琼脂糖-纤维蛋白平板法检测纳豆激酶活力,参照Astrup[14]的方法并加以改进。纤维蛋白平板的制备:称取1 g琼脂加到250 mL三角瓶中,量取100 mL PBS(10 mmol/L pH 7.2)缓冲液溶解琼脂,三角瓶置于微波炉中加热溶解;待琼脂冷却至50℃时向瓶中加入800 μL 50 mg/mL的纤维蛋白原溶液及120 μL 10 U/mL的凝血酶,混合均匀后迅速倾入平皿中;37℃生化培养箱反应105 min,以形成纤维蛋白凝块。
标准曲线的制作:参照奚晓琦[15]的方法。用打孔器打孔,将尿激酶样品(1 562.5 IU/mL、3 125 IU/mL、6 250 IU/mL、12 500 IU/mL、25 000 IU/mL、50 000 IU/mL)各20 μL点样于新配置的纤维蛋白平板上,放置10 min后转至37℃生化培养箱反应,18 h后取出测定各溶解圈的垂直直径。上述操作设定3个平行组,测量后计算溶解圈面积,去除点样孔面积后,取其平均值为横坐标。尿激酶标准溶液对应的活力,取对数值为纵坐标,溶解圈面积为横坐标,制作尿激酶酶活标准曲线。
Y=0.008 2X+2.849 4,线性相关系数为0.996 8。
式中,Y表示尿激酶活力的对数值,X表示溶解圈面积(mm2)。
1.2.5纳豆激酶活力测定 取发酵液样品15 mL,9 500 r/min离心10 min,将上清液倒入空的离心管中。上清液和沉淀分别称重,计算出渣率A,上清液作为粗酶液测pH和纳豆激酶活力。取待测样品20 μL,按上述操作上样、培养、测量溶解圈直径,计算溶解圈面积,根据尿激酶标准曲线计算对应的纳豆激酶活力。出渣率的计算公式为:
式中,A表示出渣率(%),m表示沉淀质量(g),M表示上清和沉淀总质量(g)。
1.2.6单因素试验 本试验选取纳豆激酶活力、发酵液出渣率和终点pH作为评价指标,考察因素分别为发酵时间、装液量、接菌量和初始pH。
①发酵时间:以1%的接菌量将种子液接种至初始pH 6.56,100 mL/250 mL的豆乳中,于37℃ 200 r/min的条件下分别培养12 h、24 h、36 h、48 h、60 h、72 h、84 h、96 h,制备粗酶液,测定酶活力、出渣率和终点pH,确定最佳发酵时间。
②装液量:在确定最适发酵时间的基础上,在500 mL的三角瓶中分别装入50 mL、100 mL、150 mL、200 mL、250 mL豆乳,以1%的接菌量将种子液接种至初始pH 6.56的豆乳中,于37℃ 200 r/min的条件下培养至最适发酵时间,制备粗酶液,测定酶活力、出渣率和终点pH,确定最适装液量。
③接菌量:在确定最适发酵时间和装液量的基础上,分别以0.5%、1.0%、1.5%、2.0%、2.5%的接菌量接菌发酵,于37℃ 200 r/min的条件下培养,制备粗酶液,测定酶活力、出渣率和终点pH,确定最适接菌量。
④初始pH:在确定的最适发酵时间、装液量和接菌量的基础上,将种子液接至初始pH分别为5、6、7、8、9的豆乳中,于37℃ 200 r/min的条件下培养,制备粗酶液,测定酶活力、出渣率和终点pH,确定最佳初始pH。
1.2.7正交试验 设计4因素3水平的正交试验L9(34),确定上述4个因素的最佳参数组合(正交设计因素水平见表1)。

表1 正交试验因素水平表Table 1 Factors and levels of orthogonal test.
1.3 数据处理
采用Graphpad 5.0进行作图和分析;运用正交设计助手进行正交试验设计和分析。
2 结果与分析
2.1 发酵时间对酶活的影响
发酵时间对酶活的影响见图1A,发酵时间对出渣率和终点pH的影响见图1B。发酵时间在12~36 h之间,随着发酵时间的增加,纳豆激酶的活力持续上升(P<0.01),36 h时出现第一个峰;36~60 h之间,随着发酵时间的增加,纳豆激酶的活力呈现下降趋势(P<0.01);84 h处出现第二个峰;随后下降。酶活既有上升又有下降趋势,原因可能为酶在合成的同时也会有部分失活,失活数小于合成数则表现为上升趋势,失活数大于合成数则表现为下降趋势。离心后沉淀中既有豆渣,也有菌体,因此出渣率即反应菌体的生长情况,又反应菌体对豆渣的利用程度。出渣率随着时间的增加呈现下降趋势,菌体理论上会随着时间的增加而累积,但后期也会存在自溶现象,从整体下降趋势推测,可能是豆渣被利用导致的。终点pH随着发酵时间增加而增加,这与碱性物质的产生有关,包括纳豆激酶和原料分解产物。综合酶活力和生产成本,选择36 h作为纳豆枯草芽孢杆菌发酵产酶的最佳发酵周期。
2.2 装液量对酶活的影响
装液量对酶活的影响见图2A,装液量对出渣率和终点pH的影响见图2B。纳豆枯草芽孢杆菌是好氧型细菌,通过改变装液量可调节通气量。随着装液量的增加,纳豆激酶活力显著下降(P<0.01),出渣率呈现上升趋势。装液量越小,通气量越大,豆乳中溶氧水平就越高,因此产生的纳豆激酶活力越高,菌对豆渣的利用率越高,碱性产物积累越多。而装液量高时,出渣率高的原因可能是此条件下菌体主要利用豆乳进行自身生长繁殖和代谢活动,而没有开始利用豆渣。因此,确定最佳装液量为10%。
2.3 接菌量对酶活的影响
接菌量对酶活的影响见图3A,接菌量对出渣率和终点pH的影响见图3B。当接菌量为2%时,产酶活力最高;出渣率随着接菌量的增加呈现先上升后急速下降的趋势;终点pH随着接菌量的增加呈现先上升,随后趋于平缓,最后下降的趋势。这是由于接菌量较低时,营养物质主要供菌体生长,接菌量高时,产生的酶失活率高。以产酶活力为核心指标,因此把接菌量定为2%。
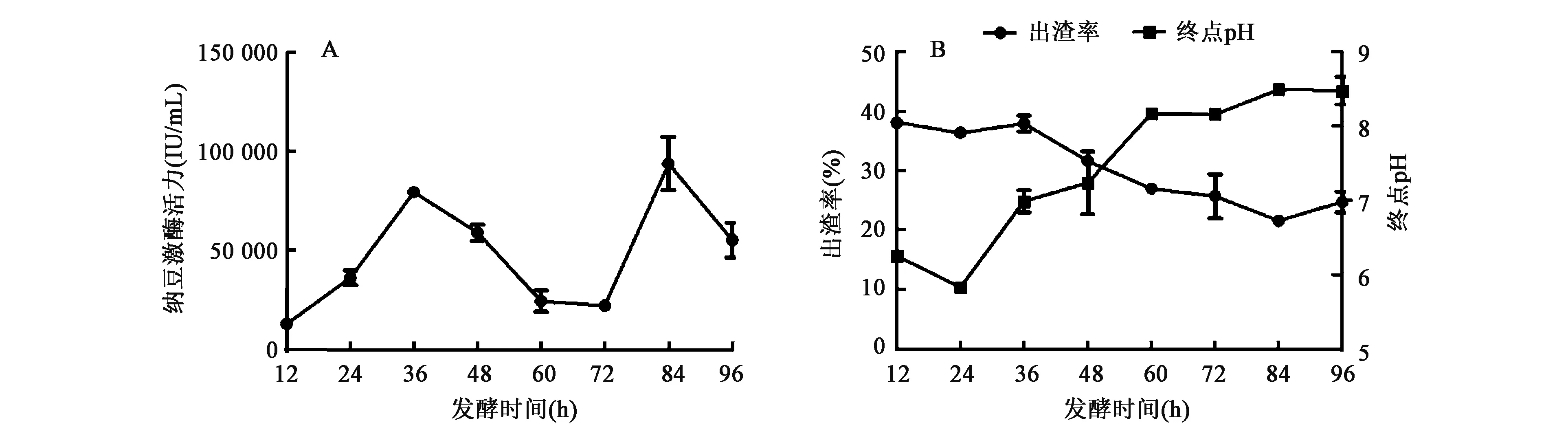
图1 发酵时间对纳豆激酶活力、出渣率和终点pH的影响Fig.1 The effects of fermentation time on nattokinase activity, slag rate and finial pH.

图2 装液量对纳豆激酶活力、出渣率和终点pH的影响Fig.2 The effects of liquid loading on nattokinase activity, slag rate and finial pH.

图3 接菌量对纳豆激酶活力、出渣率和终点pH的影响Fig.3 The effects of bacteria loading on nattokinase activity, slag rate and finial pH.
2.4 初始pH对酶活的影响
初始pH对酶活的影响见图4A,初始pH对出渣率和终点pH的影响见图4B。菌体生长过程中pH主要通过影响菌体细胞膜电荷、膜渗透性及营养物质离子化程度,从而影响菌体对养分的吸收。pH超过6后纳豆激酶活力呈现下降趋势,表明纳豆枯草芽孢杆菌适宜产酶的初始条件为中性偏酸,而碱性条件下不适合纳豆枯草芽孢杆菌产纳豆激酶。酶活最高点所对应的终点pH也最高,出渣率最低,表明在此条件下菌体生长旺盛,酶的表达量最高。因此初始pH定为6。
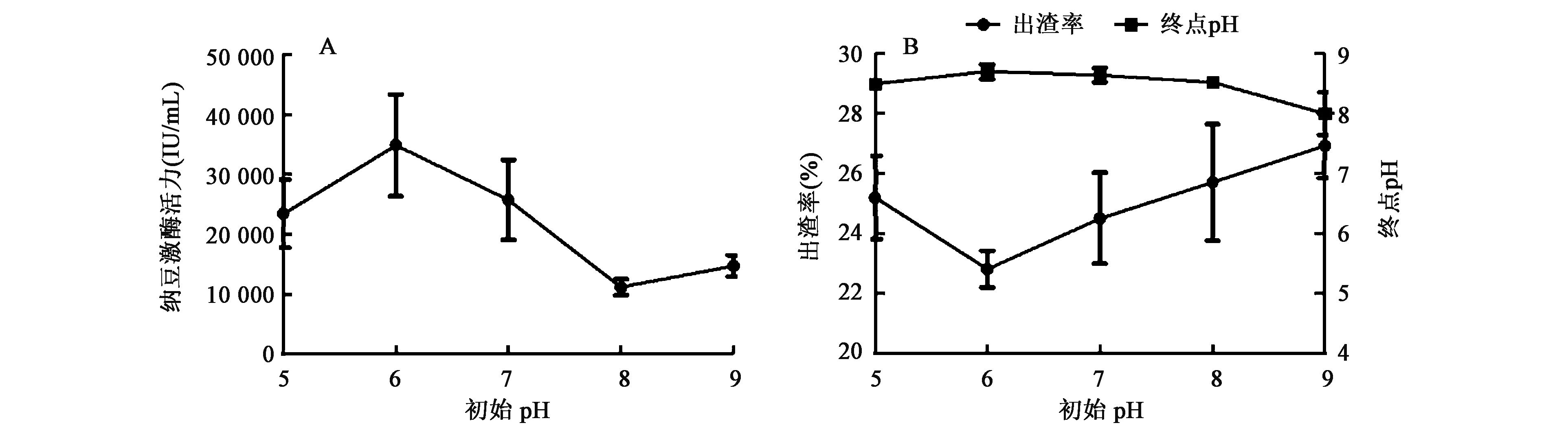
图4 初始pH对纳豆激酶活力、出渣率和终点pH的影响Fig.4 The effects of initial pH on nattokinase activity, slag rate and finial pH.
2.5 正交试验
上述单因素试验结果表明,发酵时间、装液量、接菌量和初始pH对发酵液酶活有较大影响。由于上述几个因素间可能存在交互作用,故设计正交试验以确定其最适发酵条件。表2为正交试验结果。正交试验表明,4个因素对纳豆激酶活力的影响主次顺序为装液量>发酵时间>接菌量>初始pH。理论优化方案为A1B1C3D1,即发酵时间30 h,装液量5%,接菌量2.25%,初始pH 5.5。正交试验表中无此理论配方,配方1与理论配方最接近。为了考察理论配方与实际配方,需进行验证试验。
2.6 验证试验
将理论配方(A1B1C3D1)和实际配方(A1B1C1D1)进行产酶活力验证,理论配方酶活为120 414.85 IU/mL,实际配方酶活为429 869.34 IU/mL,与正交试验结果(454 518.18 IU/mL)接近,说明数据可信。但理论酶活与实际酶活相差较大,条件不同之处在于接菌量。理论配方(A1B1C3D1)接菌量大于实际配方(A1B1C1D1),酶活力远小于实际配方,说明接菌量过大不利于产酶。因此,最优组合确定为发酵时间30 h,装液量5%,接菌量1.75%,初始pH 5.5,该条件下纳豆激酶活力为429 869.34 IU/mL,是优化前(79 434.68 IU/mL)的5.41倍。
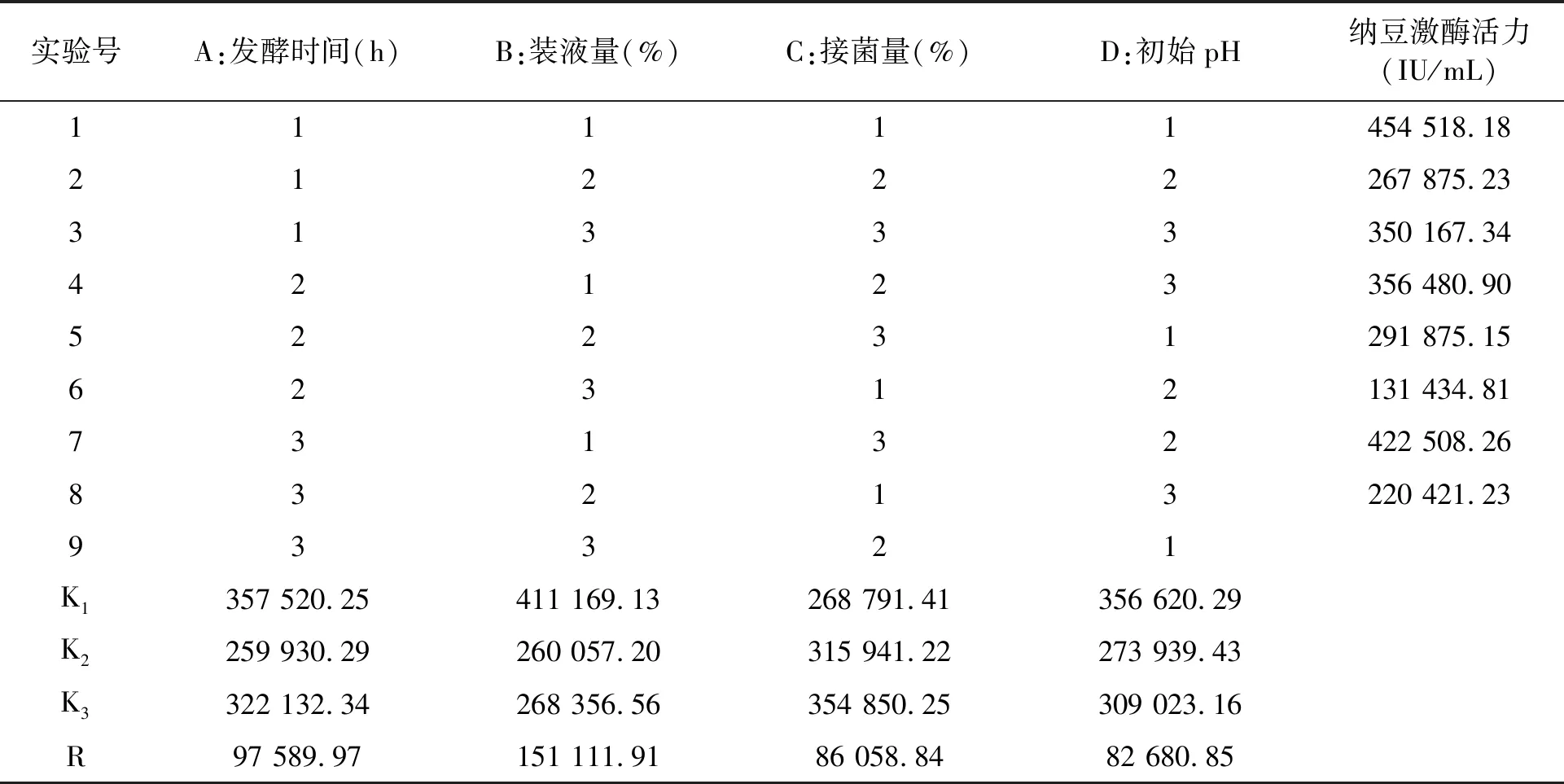
表2 正交试验结果表Table 2 Results of the orthogonal test.
3 讨论
本试验中,以纳豆激酶活力为核心评价指标,以出渣率和终点pH为辅助评价指标,通过单因素及正交试验法,优化了以豆乳为发酵基质的纳豆激酶液体发酵条件。

本试验为今后纳豆激酶功能食品的开发应用提供了理论依据,进一步扩大实验规模是下一步努力的方向,拟采用发酵罐放大培养,实现从实验室到生产线的过渡。同时,后期发酵豆乳风味的改良、纳豆激酶功能食品开发、生产工艺的完善等也将是我们重点关注的方向。
