蒺藜苜蓿MtFVE基因功能初步解析
2019-04-01王瑞良张鹏程牛丽芳李学森王兴春
王瑞良, 张鹏程, 牛丽芳, 朱 昊, 李学森, 王兴春*, 林 浩*
1.山西农业大学生命科学学院, 山西 太谷 030801;2.中国农业科学院生物技术研究所, 北京 100081;3.新疆畜牧科学院草业研究所, 乌鲁木齐 830000
开花是高等植物实现世代交替的重要环节。植物开花时间受到复杂的分子网络调控,就模式植物拟南芥而言,主要包括6条途径,分别为赤霉素途径(gibberellin)、光周期途径(photoperiod)、春化途径(vernalization)、年龄途径(age)、温度途径(temperature)及自主途径(autonomous)等[1]。自主途径是指在缺少外源环境因素(如日照长度、温度等)的刺激诱导下,植物通过感受自身内部的生长发育情况,在营养生长达到一定程度时,实现开花的一条途径。自主途径调控开花不受外界环境因素影响,独立于光周期途径及春化途径[2]。目前,有研究报道,拟南芥中与自主通路相关的基因主要有16个,分别为FCA、FY、FPA、cleavagestimulationfactor64(CstF64)、CstF77、Pcf11p-similarprotein4(PCFS4)、GRP7、GRP8、PRP8、PRP39-1、SR45、FLK、LD、CDKC;2、FVE和FLD。根据推测的生物学功能,将其分为3大类,即RNA加工、转录调控及组蛋白修饰等[3]。
FLOWERING LOCUS VE(FVE),是哺乳动物视网膜母细胞瘤相关蛋白RbAp46/RbAp48的同源物,具有保守的WD40蛋白基序和组蛋白结合结构域[4]。7个WD40蛋白基序折叠成特有的β螺旋桨形式,利于各种蛋白质之间以及蛋白质和DNA之间的相互作用[5]。研究表明,FVE是拟南芥自主途径中重要的组成成员,不同处理条件(如长短日照、温度)下,拟南芥fve突变体均呈现晚花,而在拟南芥中过表达水稻OsFVE基因出现早花[6]。由此可见,FVE基因在调控拟南芥开花过程中具有十分重要的作用。FVE调控拟南芥开花主要通过表观遗传学机制介导下游基因FLOWERINGLOCUSC(FLC)染色质组蛋白修饰的改变,从而抑制FLC转录。FLC编码1个MADS-box转录因子,是典型的开花抑制因子,拟南芥中过表达FLC基因突变体出现晚花表型。研究表明,在fve突变体中,FLC染色质组蛋白H3乙酰化水平和H3K4甲基化水平增加[7]。因而,染色质修饰的表观遗传调控在FLC基因的转录水平调节方面具有十分重要的意义。
组蛋白乙酰化在染色质重塑和基因表达调控等方面发挥重要作用,主要发生在H3、H4的N端比较保守的赖氨酸位置上,经组蛋白乙酰转移酶(histone acetyltransferases,HATs)和组蛋白去乙酰化酶(histone deacetylases,HDACs或HDAs)共同调节[8]。通常,组蛋白去乙酰化抑制基因表达,而组蛋白高度乙酰化与基因的转录激活相关。在真核生物中,组蛋白去乙酰化酶主要分为3个家族:RPD3/HDA1(reduced potassium dependence 3/histone deacetylase 1)、SIR2(silent information regulator 2)和HD2(histone deacetylase 2)等[9]。就模式植物拟南芥而言,RPD3/HDA1家族的HDACs可进一步分为3类:I类包括HDA19、HDA6、HDA7和HDA9;II类包括HDA5、HDA15和HDA18;III类仅包括HDA2[10]。目前,大多数关于植物I类HDACs的研究主要集中在HDA6和HDA19上[11]。HDA6和HDA19被各种转录因子募集并形成多种蛋白质复合物,这些复合物参与植物的各种发育过程,如植物开花发育等。
FLOWERING LOCUS D(FLD),是拟南芥中人类lysine-specific demethylase 1(LSD1)的同源物,FLD可以使组蛋白H3K4去甲基化。除FLD外,拟南芥中还存在3个LSD1的同源基因,将其命名为LSD1-like基因,分别为LDL1、LDL2、LDL3[12]。在拟南芥中,FVE蛋白与HDA6蛋白和FLD蛋白均能发生互作。FVE基因调控开花主要通过FVE与HDA6和FLD形成蛋白复合体,介导FLC染色质组蛋白H3去乙酰化水平和H3K4去甲基化水平增加,进而导致FLC基因沉默[13]。
蒺藜苜蓿为一年生草本植物,二倍体(2n=16条染色体),具有基因组小、自花授粉、结实率高、遗传转化相对容易且具有Tnt1插入突变体库等特点,被一致认为是新兴的豆科模式植物[14]。然而,蒺藜苜蓿中缺失了FLC的同源基因[15]。因此,自主途径FVE同源基因及其他自主通路成员如何调控蒺藜苜蓿开花的分子机制有待探索。
本研究首先通过生物信息学方法筛选到蒺藜苜蓿中2个与拟南芥FVE基因高度同源的基因MtFVEa和MtFVEb,通过分子生物学方法,初步解析了MtFVEa和MtFVEb基因的功能,并通过酵母双杂实验进一步探索MtFVEa蛋白与MtFLD和MtHDA6蛋白的互作情况。本研究旨在为揭示蒺藜苜蓿自主途径开花调控分子机制提供新的思路及参考。
1 材料与方法
1.1 材料
1.1.1实验材料 蒺藜苜蓿(Medicagotruncatula)野生型R108由实验室提供。将蒺藜苜蓿种子经3%次氯酸钠消毒5 min,用无菌水清洗5次,置于浸湿的2片滤纸夹层中,于25℃、黑暗条件下萌发。将萌发的种子播种于湿润的营养土中,放置在温度为24℃、湿度为65%、光强为380 μmol/m2·s、光周期为16 h (光)/8 h (暗)的人工气候室中进行种植培养。
1.1.2实验试剂 2×TaqPCR Mix购于北京艾德莱生物科技有限公司;TRIzol试剂和焦炭酸二乙酯(DEPC)、酵母双杂试剂盒均购于美国Invitrogen公司;营养缺陷型培养基购自美国Clontech公司;DNA限制性内切酶购自美国NEB公司;反转录试剂盒(TransScript-Uni One-Step gDNA Removal and cDNA Synthesis SuperMix)和实时荧光定量试剂盒(Trans Tip Green q-PCR SuperMix)均购于北京全式金生物技术(TransGen Biotech)有限公司;快速质粒小提试剂盒和DNA纯化回收试剂盒均购于天根生化科技(北京)有限公司;pGADT7(Prey)和pGBKT7(Bait)载体均由本实验室提供。
1.1.3实验仪器 5424R/5702R/5430R台式冷冻离心机(德国Eppendorf公司)、PCR扩增仪(杭州博日科技有限公司)、Light Cycler 96型实时荧光定量PCR扩增仪(瑞士Roche公司)、稳压稳流电泳系统(美国Bio-Rad公司)、天能凝胶成像系统1600(上海天能科技有限公司)和D7100照相机(日本尼康公司)。引物合成及样品测序均由生工生物工程(上海)股份有限公司完成。
1.2 蒺藜苜蓿MtFVE、MtFLD和MtHDA6蛋白序列分析
从TAIR网站上分别下载拟南芥FVE、FLD和HDA6蛋白序列。将拟南芥FVE蛋白序列在NCBI数据库中与其他物种进行蛋白同源比对,分析筛选与拟南芥FVE蛋白同源性较高的不同物种的蛋白序列。获得的FVE同源序列经ClustalW比对后,利用MEGA5软件在Bootstrap置信值为1 000的条件下构建FVE及其同源蛋白的系统进化树。使用BioEdit蛋白序列分析软件对FVE和蒺藜苜蓿MtFVE进行蛋白序列比对分析。将拟南芥FLD、HDA6蛋白在NCBI数据库中分别与蒺藜苜蓿数据库进行同源比对,获得高度同源的蛋白,全长蛋白序列经ClustalW比对,然后通过MEGA5软件(Bootstrap Repeat=1 000)和BioEdit蛋白序列分析软件分别获得FLD、HDA6蛋白的系统进化树和序列比对结果。
1.3 荧光实时定量qRT-PCR
收集蒺藜苜蓿野生型R108不同组织部位,分别为生长28 d植株的根、生长40 d植株的茎、生长50 d植株的未展开复叶和完全张开的花、授粉后7 d的果荚及营养生长28 d的茎尖,用于检测MtFVEa和MtFVEb基因(蒺藜苜蓿中拟南芥FVE的同源基因)的组织表达特异性。通过Trizol法提取以上收集的各个组织的总RNA,按照反转录试剂盒的操作步骤合成cDNA第一条链。以反转录成的cDNA链为模板,用基因特异性引物按照实时荧光定量试剂盒的操作方法进行qRT-PCR检测(特异性引物参见表1)。qRT-PCR体系(10 μL):qPCR SuperMix 5 μL,模板cDNA 3 μL,正、反向引物(2 μmol/L)各1 μL。qRT-PCR反应程序:94℃预变性5 min;94℃变性5 s,60℃退火15 s,72℃延伸20 s,共40个循环。以上均以蒺藜苜蓿体内组成型MtActin为内参进行归一化处理,用2-△△Ct计算方法对实验结果进行分析。
1.4 半定量RT-PCR实验
将1.3步骤中获得的cDNA第一条链作为模板,通过半定量RT-PCR检测MtFVEa和MtFVEb基因在野生型R108不同组织中的表达特异性,MtActin为内参(特异性引物参见表1)。
PCR体系(10 μL):2×TaqMix 5 μL,模板cDNA 1 μL,正、反向引物(10 μmol/L)各0.5 μL,ddH2O 3 μL。PCR反应程序:98℃预变性2 min;98℃变性20 s,55℃退火20 s,72℃延伸1 min;72℃再延伸2 min;24℃保存1 min。其中,MtActin基因扩增28个循环,MtFVEa基因为26个循环,MtFVEb基因为30个循环。
1.5 酵母双杂交实验
通过外切酶Ⅲ连接转化方法将MtFVEa和MtFVEb基因的CDS分别构建到pGADT7 (Prey)载体上,获得pGADT7-MtFVEa、pGADT7-MtFVEb猎物质粒。通过外切酶Ⅲ连接转化方法将MtFLD和MtHDA6基因的CDS分别构建到pGBKT7 (Bait)上,获得pGBKT7-MtFLD、pGBKT7-MtHDA6诱饵质粒。反应体系(10 μL):NEBuffer 1 1 μL,外切酶Ⅲ(10 000 U/mL)1 μL,DNA(载体和片段)8 μL,其中载体和片段的体积视情况而定。反应程序:70℃ 20 min,42℃ 10 min。酶切所用的引物及酶见表2。将以上质粒pGADT7-MtFVEa和pGADT7-MtFVEb分别与pGBKT7-MtFLD、pGBKT7-MtHDA6组合共转化酵母Golden Yeast菌株,涂布在营养缺素培养基上于28℃培养箱内生长2~3 d,观察酵母的生长情况,拍照并整理结果。

表1 引物名称及序列Table 1 Primers used in the experiment.

表2 酵母双杂载体构建引物及所用的限制性内切酶Table 2 Primers and enzymes used in the yeast double-hybrid assay.
1.6 文中涉及相关基因对应的基因序列号
MtActin(Medtr3g095530)、MtFVEa(Medtr2g-039250)、MtFVEb(Medtr2g100090)、MtFLD(Medtr1g050535)、MtHDA6-1(Medtr3g077160)、MtHDA6-2(Medtr3g077120)。
2 结果与分析
2.1 蒺藜苜蓿MtFVE蛋白系统进化树分析
为了在蒺藜苜蓿中寻找与拟南芥FVE同源的蛋白,将拟南芥FVE蛋白序列在NCBI数据库中进行比对,发现在蒺藜苜蓿中存在2个同源蛋白,将其分别命名为MtFVEa和MtFVEb。DNAMAN软件分析发现MtFVEa和MtFVEb与拟南芥AtFVE的氨基酸序列一致性分别为78%和63%,MtFVEa与MtFVEb的氨基酸序列一致性为66%。随后利用MEGA5软件构建了FVE同源蛋白的系统进化树(图1),分析表明蒺藜苜蓿MtFVEa与AtFVE的亲缘关系较MtFVEb更近。
2.2 蒺藜苜蓿MtFVE蛋白序列比对
使用BioEdit蛋白序列分析软件将MtFVEa和MtFVEb蛋白与拟南芥AtFVE蛋白进行序列比对,分析发现这2种蛋白均与拟南芥AtFVE蛋白高度同源(图2),且均具有保守的WD40结构域,表明MtFVE可能具有与拟南芥FVE类似的功能。

图1 MtFVE蛋白与不同物种FVE蛋白的进化树分析Fig.1 Phylogenetic tree of MtFVE protein and the FVE proteins from different plant species.
2.3 蒺藜苜蓿MtFVE基因的组织表达模式分析
目前,MtFVEa和MtFVEb基因在蒺藜苜蓿中的生物学功能尚不清楚,为了探索MtFVEa和MtFVEb的功能,首先通过半定量RT-PCR和荧光定量PCR分析MtFVEa和MtFVEb基因在蒺藜苜蓿野生型R108不同组织部位的表达模式。2种实验结果均表明MtFVEa和MtFVEb基因在根、茎、叶、花、果荚及茎尖部位均有不同程度的表达(图3),且在花和茎尖中表达水平较高。由此推测MtFVE基因可能在花和茎尖中具有特异性功能,参与蒺藜苜蓿开花调控过程。
2.4 蒺藜苜蓿MtFLD蛋白系统进化树分析
经NCBI数据库蛋白序列比对发现,蒺藜苜蓿中也相应存在6个拟南芥LSD1-like的同源蛋白。用全长蛋白序列构建了系统进化树,如图4所示,Medtr1g050535与拟南芥AtFLD的亲缘关系最近,命名为MtFLD。进一步通过DNAMAN软件分析发现MtFLD与AtFLD氨基酸序列一致性为65%。

图2 MtFVE与AtFVE蛋白序列比对Fig.2 Protein sequence alignment of MtFVE and AtFVE.
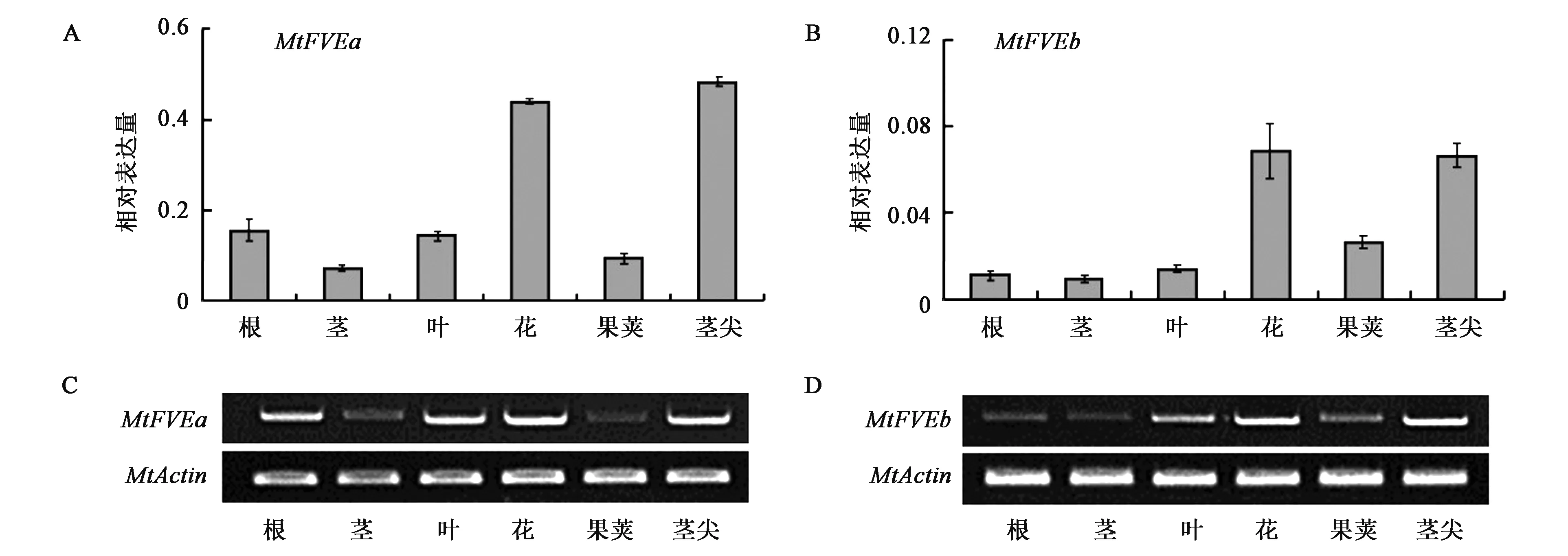
图3 MtFVEa和MtFVEb基因组织表达模式分析Fig.3 Gene expression of MtFVEa and MtFVEb in different tissues of M. truncatula R108.

图4 LSD1-like近缘蛋白的系统进化树分析Fig.4 Phylogenetic tree of LSD1-like proteins.
2.5 蒺藜苜蓿MtFLD蛋白序列比对
使用BioEdit蛋白序列分析软件进一步分析,结果如图5所示,蒺藜苜蓿MtFLD蛋白与拟南芥AtFLD蛋白高度同源,均具有保守的SWIRM结构域和组蛋白去甲基化结构域。其中,SWIRM结构域在形成染色质和蛋白质复合物的过程中介导特定的蛋白质与蛋白质相互作用;组蛋白去甲基化结构域在染色质组蛋白修饰过程中发挥作用。
2.6 蒺藜苜蓿MtHDA蛋白系统进化树分析
经NCBI数据库蛋白序列比对发现,蒺藜苜蓿中RPD3/HDA1家族的I类组蛋白去乙酰化酶总共有5个成员。全长蛋白的系统进化树分析(图6)显示与HDA6最近缘的蛋白有2个,将其分别命名为MtHDA6-1和MtHDA6-2,其中MtHDA6-1蛋白与AtHDA6具有73%的氨基酸序列一致性,而MtHDA6-2蛋白与AtHDA6仅有27%的一致性。MtHDA6-1蛋白与MtHDA6-2具有37%的氨基酸序列一致性。
2.7 蒺藜苜蓿MtHDA6蛋白序列比对
经NCBI数据库分析,MtHDA6-1基因的全长为6 234 bp,开放阅读框为1 431 bp,可编码477个氨基酸;MtHDA6-2基因的全长为763 bp,开放阅读框为579 bp,可编码193个氨基酸。AtHDA6蛋白C端从第333位氨基酸到第471氨基酸负责与其他蛋白互作,该区域天冬氨酸的富集程度较高。如图7所示,MtHDA6-1与AtHDA6氨基酸序列一致性程度较高,且C端从对应于AtHDA6蛋白第333位氨基酸算起,氨基酸序列一致性为56%。而MtHDA6-2则总共编码193个氨基酸,C端不存在,推测其可能没有与其他蛋白互作的功能,因此后续实验重点关注MtHDA6-1。
2.8 酵母双杂实验检测MtFVE与MtFLD、MtHDA6-1之间的蛋白相互作用
为了探索拟南芥中FVE与FLD、HDA6的互作是否在蒺藜苜蓿中具有保守性,通过酵母双杂实验,发现MtFVEa分别与MtFLD和MtHDA6-1互作(图8A),而MtFVEb未与2个蛋白发生互作(图8B),表明在蒺藜苜蓿中MtFVEa同MtFLD及MtHDA6-1的互作具有保守性。而MtFVEb未检测到互作的原因还需进一步研究。
3 讨论
开花时间是高等植物从营养生长向生殖生长转变的重要生物学特征,受到多种环境因素与遗传网络的调控,适时开花影响植物繁殖发育及产量效益。拟南芥自主途径[16]和春化途径[17]基因均通过抑制下游FLC基因的表达进一步调控开花。FLC编码1个MADS-box转录因子,主要通过负调控下游基因FLOWERINGLOCUST(FT)及SUPPRESSOROFOVEREXPRESSIONOFCO1(SOC1)的表达来抑制开花。FLC基因的表达受到表观遗传调节,且这种调节响应于内外源环境的变化[18]。FVE是自主途径重要的组成成员,具有WD40蛋白基序和组蛋白结合结构域,WD40蛋白参与高等植物许多细胞生命活动,尤其可通过介导染色质组蛋白修饰的表观遗传调控进一步影响基因转录[19]。在拟南芥中,FVE分别与FLD和HDA6发生蛋白互作,且形成多蛋白复合体介导下游的FLC染色质组蛋白修饰,从而抑制FLC基因的转录,导致fve突变体晚花。HDA6可与FLD直接互作,促进拟南芥开花。与fve突变体类似,hda6、fld突变体均呈现晚花表型[20]。由此可见,拟南芥中FVE-FLD-HDA6形成三元蛋白复合体在染色质水平抑制FLC基因表达进一步调控开花时间。

图5 MtFLD与AtFLD蛋白序列比对Fig.5 Protein sequence alignment of MtFLD and AtFLD.
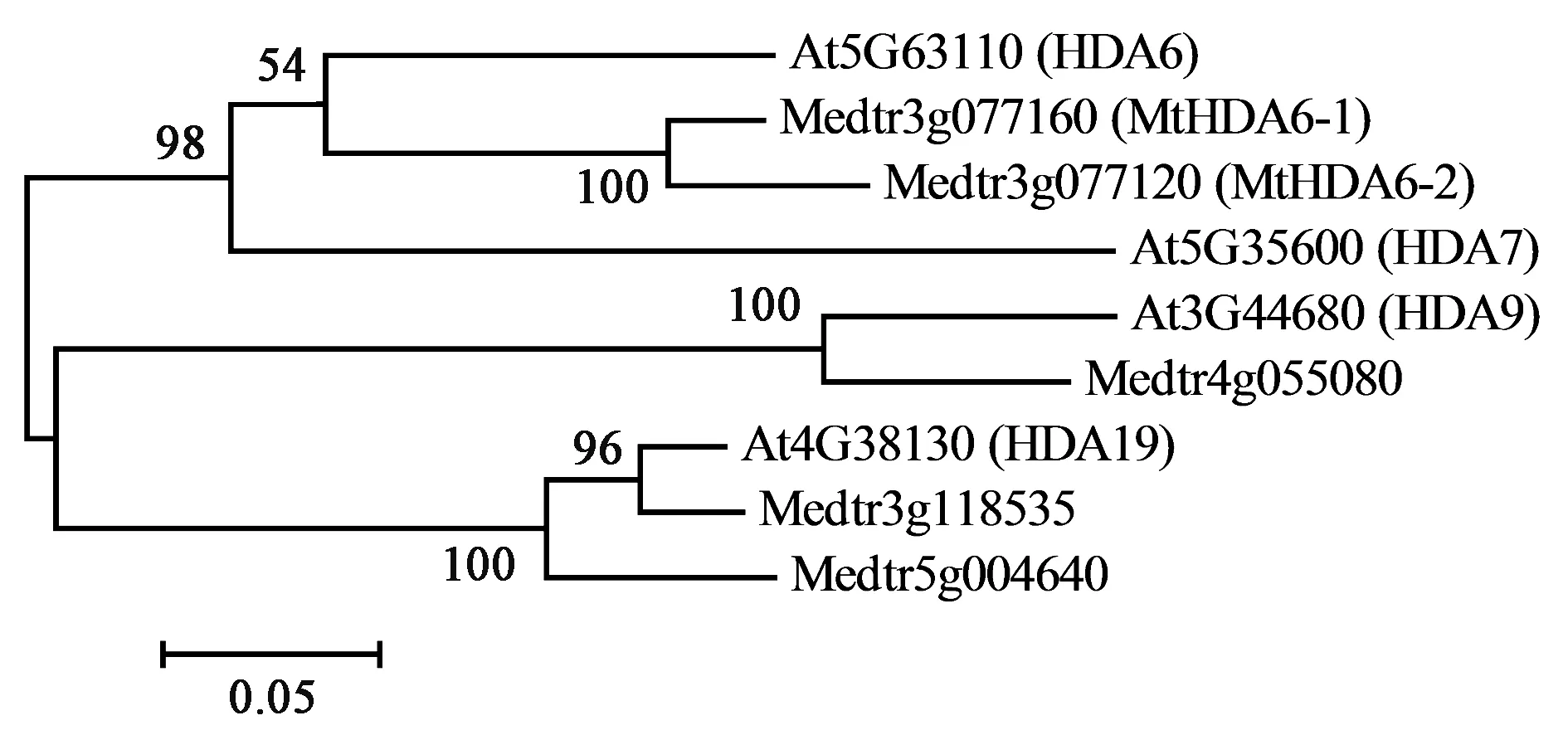
图6 RPD3/HDA1家族Ⅰ类近缘蛋白的系统进化树分析Fig.6 Phylogenetic tree of class Ⅰ RPD3/HAD1 proteins.

图7 MtHDA6与AtHDA6蛋白序列比对Fig.7 Protein sequence alignment of MtHDA6 and AtHDA6.

图8 酵母双杂检测MtFVE与MtFLD及MtHDA6-1的蛋白互作Fig.8 Detection the interaction between MtFVE and MtFLD or MtHDA6-1.
本研究发现在蒺藜苜蓿中存在FVE、FLD和HDA6的同源蛋白,并且酵母双杂交结果显示MtFVEa与MtFLD和MtHDA6存在蛋白互作。然而,蒺藜苜蓿中缺失开花关键抑制因子FLC的同源基因[15],因此这个三元复合体在蒺藜苜蓿中具体的直接作用位点值得后续深入研究。如在拟南芥中春化通路基因VERNALIZATION2(VRN2)编码核定位的锌指蛋白,是Polycomb Group Repressive Complex 2(PRC2)的成员之一,通过组蛋白H3第27位赖氨酸三甲基化(H3K27me3)介导FLC的表达沉默,VRN2基因的突变表现为晚花[21]。但在蒺藜苜蓿中,VRN2同源基因MtVRN2的功能缺失突变体表现为早花,在mtvrn2突变体中FT同源基因MtFTa1的表达量上升,且mtvrn2-mtfta1双突变体表型与mtfta1突变体相似,呈现晚花。然而在mtvrn2突变体中MtFTa1组蛋白H3第27位赖氨酸三甲基化(H3K27me3)水平与野生型相似,表明MtVRN2作为一个开花抑制子可能并不直接抑制MtFTa1的表达[15]。
因此,后续研究中需要详细分析MtFVE、MtFLD和MtHDA6等基因功能缺失突变体的表型,以及研究蒺藜苜蓿自主途径基因MtFVE的开花调控机制,从而寻找其作用的直接靶位点。同时,需要进一步解析在蒺藜苜蓿中是否同样以FVE-FLD-HDA6三元蛋白复合体的形式在染色质水平上抑制下游基因的表达来调控苜蓿的开花时间,从而为蒺藜苜蓿开花时间调控网络提供新的研究思路。
