功能性糖防治畜禽沙门氏菌病和大肠杆菌病的作用机制研究进展
2019-04-01乔宇,石波
乔 宇, 石 波
中国农业科学院饲料研究所, 北京 100081
致病性沙门氏菌(Salmonellaspp.)和大肠杆菌(Escherichiacoli)是两类常见的引起人畜共患病的病原菌[1]。沙门氏菌和大肠杆菌是杆状、不产孢子的革兰氏阴性细菌,属肠杆菌科。目前已报道的沙门氏菌血清型有2 500余种,我国有290多种血清型[2,3]。不同血清型的沙门氏菌的致病性存在差异,能够引起伤寒、副伤寒以及胃肠道疾病等[4]。据欧洲食品安全局报道,欧洲新鲜猪肉中沙门氏菌的检出率为0.7%~26%[5]。在2013年欧洲爆发的传染性疾病中沙门氏菌病占25.8%(2013年共88 715例)[5]。Jackson等[6]报道,美国在1998年-2008年80%的沙门氏菌病是由鸡蛋和鸡肉感染沙门氏菌引起的。根据测算,我国每年因沙门氏菌食物中毒的发病人数达300万人次,其中近半数与生鸡肉交叉污染有关。
大肠杆菌普遍存在于人类和畜禽肠道内,大部分血清型作为肠道内的共生菌是没有毒性的,仅少数血清型的大肠杆菌具有致病性,可引起严重的肠道感染[7, 8]。致病性大肠杆菌有6种类型:产肠毒素性大肠杆菌(enterotoxigenicE.coli,ETEC)、肠侵袭性大肠杆菌(enteroinvasiveE.coli,EIEC)、肠致病性大肠杆菌(enteropathogenicE.coli,EPEC)、肠出血性大肠杆菌(enterohemorrhageE.coli,EHEC)、肠聚集性大肠杆菌(enteroaggregativeE.coli,EAEC)及弥散黏附性大肠杆菌(diffusely adherentE.coli,DAEC)[9]。2014年欧洲爆发的传染性疾病中1.7%是由产肠毒素的致病性大肠杆菌引起的[10],新鲜猪肉中致病性大肠杆菌的检出率为0~70%[1]。尤其是仔猪断奶阶段,ETEC引起的腹泻病具有发病率高、死亡率高、使仔猪生长性能严重下降等特点,给养殖行业带来巨大危害,并严重威胁着人类健康[11,12]。我国致病性大肠杆菌主要来源于畜禽产品、被动物粪便污染的水和土壤[9]。
控制畜禽养殖中沙门氏菌和大肠杆菌的污染主要包括养殖环节、屠宰加工环节以及运输和零售环节。其中,在养殖环节抑制沙门氏菌和大肠杆菌增殖是最为有效的控制病原菌进入食物链的手段。畜禽养殖环境卫生消毒、畜禽注射疫苗等手段只能在一定程度上防治沙门氏菌和大肠杆菌。抗生素作为一种可有效地抑制沙门氏菌和大肠杆菌感染的抗菌药物,被广泛地应用于畜禽养殖中[1,6]。近年来,随着多重抗生素耐药细菌的出现以及人们对畜禽产品抗生素残留认识的深入,在畜禽养殖中添加的抗生素即将被一些绿色饲料添加剂取代。糖生物学和糖工程技术的迅速发展逐渐揭示出糖及糖链的生物学功能,其中对于功能性糖在抑制沙门氏菌和大肠杆菌感染方面的研究取得了一定的进展。本文就沙门氏菌和大肠杆菌的宿主感染机制以及功能性糖抑制其感染的机制等方面的最新研究成果进行了综述,以期为解析功能性糖抑制病原微生物的作用机理提供参考,指导功能性糖抑制病原微生物的应用研究,最终实现功能性糖替代抗生素防治畜禽细菌病。
1 功能性糖在抑制沙门氏菌和大肠杆菌感染中的作用
研究发现,糖广泛参与基本的生命活动,在疾病的发生和发展、免疫系统的识别和介导、炎症及病原体感染过程中发挥了重要作用[13]。其中,功能性糖在抑制沙门氏菌和大肠杆菌感染方面表现出特有的功效。功能性糖在体外细胞试验中能够抑制沙门氏菌和大肠杆菌与肠道上皮细胞粘附,减少炎症反应;在动物饲喂试验中能降低病原菌的数量,增加有益菌的数量,促进畜禽肠道发育。因此,对可抑制沙门氏菌和大肠杆菌感染的功能性糖及其效果进行了总结(表1)。
功能性糖共有3大类:寡糖、多糖和糖复合物。寡糖包括乳果糖、几丁寡糖、低聚半乳糖(galactooligosaccharide,GOS)、低聚果糖(fructo-oligosaccharide,FOS)、酵母细胞壁甘露寡糖(mannan oligosaccharide,MOS)和棉子糖等;多糖包括β-半乳甘露聚糖、阿拉伯木聚糖、胞外多糖、可溶性非淀粉多糖、菊粉等;糖复合物有酪蛋白糖巨肽(casein glycomacropeptide,CGMP)。其中,酵母细胞壁甘露寡糖和β-半乳甘露聚糖在体外细胞试验中均可减少沙门氏菌和大肠杆菌与小肠上皮细胞的粘附,下调细胞中促炎细胞因子和趋化因子的分泌[14~17],β-半乳甘露聚糖还能够显著降低肉鸡肠道的大肠杆菌数量(数据未发表);而在断奶仔猪日粮中添加乳果糖,能减少仔猪肠道大肠杆菌数量,促进仔猪小肠发育[19],在体外纯培养试验中也发现乳果糖可抑制沙门氏菌的生长[24]。
2 沙门氏菌和大肠杆菌宿主感染机制
沙门氏菌和大肠肝菌感染宿主分为3个阶段:粘附、效应蛋白转运、病原菌在宿主细胞中增殖(图1)[1]。
沙门氏菌和大肠杆菌粘附到宿主细胞表面:2种病原菌经口服进入宿主体内,2~3 h后到达小肠,粘附到小肠的黏蛋白和小肠上皮细胞表面,这一过程可通过2种粘附机制实现。首先,沙门氏菌和大肠杆菌的黏附素,如菌毛(EHEC聚集性的黏附因子)、鞭毛(Salmonellaenterica的Saf聚黏附因子)或表面抗原(ETEC大肠杆菌表面抗原),识别宿主细胞上的受体[16,27,28],如沙门氏菌菌毛与宿主神经氨酸包含蛋白识别[29]以及AIEC菌毛、鞭毛与宿主的癌胚抗原识别[30]均属这一过程。其次,沙门氏菌和大肠杆菌的Ⅲ型分泌系统(type Ⅲ secretion system,T3SS)将黏附素转运到宿主细胞表面,完成病原菌附着的第一步。此外,2种病原菌聚集在宿主肠上皮细胞表面形成细菌生物膜也是其粘附的重要因素[31],常见于EAEC和EPEC菌株[32],这些生物膜的结构较为复杂,由菌毛、鞭毛和胞外多糖等结构组成[33]。
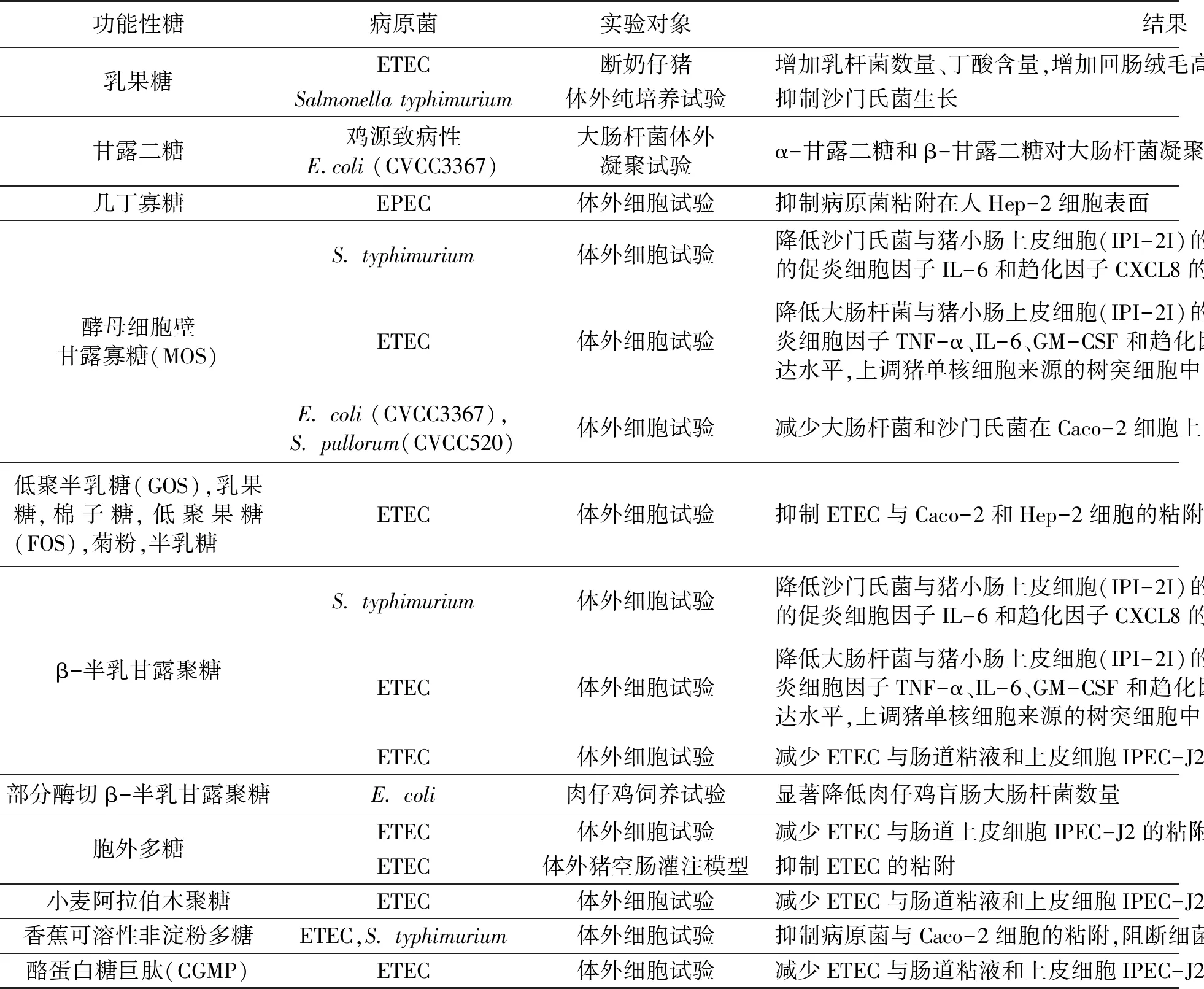
表1 功能性糖对沙门氏菌和大肠杆菌的抑制结果Table 1 Inhibitory effects of functional carbohydrates on Salmonella and E. coli.

图1 沙门氏菌和大肠杆菌子在畜禽体内的定殖方式和致病性示意图[1,8,26]Fig.1 Schematic representation of the colonization ways and pathogenicity of Salmonella enterica and Escherichia coli into livestock and poultry host[1,8,26].
宿主细胞转运病原菌效应蛋白:致病性沙门氏菌和大肠杆菌粘附到宿主细胞后,通过T3SS将细菌效应蛋白转运到胞外空间或宿主细胞的细胞质中[34]。这些效应蛋白帮助病原菌抵抗宿主免疫系统的攻击,通过诱导多个可破坏宿主肠道细胞的紧密连接和炎症反应的信号通路引发细胞裂解、破坏肠道稳态,使病原菌最终入侵宿主的器官组织[1]。
宿主病原菌的入侵和复制:沙门氏菌定植在肠上皮细胞、粘液和肠粘膜基底膜表面,引起粘膜炎症,从而产生含半乳糖的糖脂和粘蛋白等物质;随后,沙门氏菌利用这些营养物质获得快速增殖[35]。几乎所有的沙门氏菌都能在吞噬细胞(树突细胞、M细胞、单核/巨噬细胞)和中性粒细胞中增殖和存活[36]。这一过程需沙门氏菌的效应蛋白SPI-2的参与,SPI-2通过修饰宿主细胞的液泡,帮助沙门氏菌逃脱溶酶体的降解[37]。沙门氏菌还能快速侵染肠相关的淋巴组织,在口腔感染了沙门氏菌后,其可迅速转移到扁桃体、空肠和回肠淋巴结[38]。而与沙门氏菌相反,多数大肠杆菌存在于细胞外,在呼吸道内腔、中空肠到回肠的宿主细胞外生长[28]。大肠杆菌仅能利用肠上皮细胞和粘液释放的单糖(葡萄糖酸盐、甘露糖、岩藻糖和核糖)、其他的粘液糖蛋白和氨基酸增殖生长[1]。
3 功能性糖抑制沙门氏菌和大肠杆菌感染的机制
功能性糖抑制沙门氏菌和大肠杆菌感染的机制包括阻断粘附位点、改善肠道内环境和增强机体免疫功能等。
3.1 阻断病原菌的粘附位点
功能性糖作为病原菌宿主受体蛋白的结构类似物可以阻断病原菌的粘附。功能性糖可结合于病原菌黏附素的糖结合位点,进而阻断病原菌对宿主细胞的粘附[22,39],如小麦可溶性提取物阿拉伯木聚糖、CGMP、几丁寡糖、GOS等均可作为抗粘附剂抑制ETEC或EPEC在猪IPEC-J2细胞或人Hep-2细胞上的粘附(表1)。
不同进化起源的肠道致病菌沙门氏菌和大肠杆菌都具有Ⅰ型菌毛,其与宿主细胞表面糖蛋白的甘露糖残基有很高的亲和力。正是这一结合位点决定了病原菌在肠上皮细胞的粘附和定植。富含甘露聚糖的功能性糖,如酵母细胞壁甘露寡糖和半乳甘露聚糖,能够抑制沙门氏菌和大肠杆菌Ⅰ型菌毛上的FimH黏附素分子与宿主细胞的粘附(表1)。ETEC具有Ⅳ型菌毛,可与唾液酸化的糖蛋白和中型鞘糖脂的半乳糖残基结合[18],因此,富含半乳糖的功能性糖能够抑制大肠杆菌与宿主细胞的粘附。体外细胞培养实验表明,存在于刺槐豆胶中的β-半乳甘露聚糖降低大肠杆菌K88或鼠伤寒沙门氏菌与猪肠道IPI-2I细胞表面的粘附[18,19]。
Shoaf等[21]研究发现菊粉能够抑制ETEC与人小肠上皮细胞Caco-2和人喉癌上皮细胞Hep-2的粘附;但在Chen等[24]的报道中,菊粉不具备抑制粘附的功效。这说明不同结构的功能性糖对不同血清型病原菌和宿主细胞类型的抗粘附功效存在差异。
3.2 促进有益菌的增殖
乳果糖可选择性地促进肠道中有益结肠细菌的生长,尤其是乳酸菌[14],这些有益细菌可以形成生物膜,附着在肠上皮细胞上[22],阻断病原菌对肠上皮细胞的粘附[40,41]。此外,有益菌也显示出了急性抗菌作用,通过产生病原菌受体类似物-胞外多糖(如罗伊氏乳杆菌胞外多糖-Reuteran)与病原菌[24]结合,或分泌抗菌物质,如植物乳杆菌分泌的细菌素可抵御机体感染病原菌[41]。
3.3 下调黏附素或毒力因子的基因表达
功能性糖在畜禽肠道内的发酵产物——短链脂肪酸(short chain fatty acids,SCFA),包括乙酸、丙酸和丁酸,能够抑制S.typhimurium黏附素和细菌侵染相关基因的表达。丁酸和丙酸可下调沙门氏菌毒力相关的效应蛋白SPI-1的基因表达和EHEC菌Ⅰ型菌毛的表达,从而抑制病原菌的侵入[42,43]。此外,SCFA在沙门氏菌细胞内的累积能够打破其渗透平衡,抑制菌自身的生长[42]。
3.4 调节畜禽肠道生理及生态环境
功能性糖可通过选择性地刺激肠道有益菌的生长来调节肠道微生物菌群。畜禽肠道微生物群通过发酵不可消化碳水化合物来释放SCFA,从而对畜禽的生理和健康产生影响。这主要是由于SCFA和乳酸可降低肠道pH,而致病性的沙门氏菌和大肠杆菌在低pH环境中生长受到抑制。如EAEC在pH 7.4时呈现典型的聚集模式,但在pH 4.0时会丢失生物膜,呈现分散的模式。Fooks和Gibson[44]研究发现,大肠杆菌和肠炎沙门氏菌(Salmonellaenteritidis)在pH<5.0时不生长。
3.5 增强畜禽机体免疫功能
病原菌在动物体内被降解时,会释放病原体相关分子(pathogen-associated molecular patterns,PAMP),激活抗原呈递细胞,将T细胞转化为树突细胞和T辅助细胞[45]。一些功能性多糖属PAMP类物质,可作为免疫刺激剂(immunostimulant)增强动物体的免疫机能,增强巨噬细胞的吞噬功能,促进单核细胞和T细胞的增殖,激活T细胞、B细胞等免疫细胞的活性;还可促进细胞因子如IL-1、IL-2、TNF-α、TNF-β等生成,促进抗体和补体的形成[46]。White等[47]的研究表明,啤酒酵母干酵母来源的MOS可提高血清免疫球蛋白G(immunoglobulin G,IgG)水平,抑制大肠菌群增殖。此外,具有增强机体免疫功能的糖还包括多种来源的葡聚糖[45]、海洋来源的多糖[48]、植物来源的黄芪多糖和芦荟多糖[46,49]以及真菌来源的香菇多糖[9]等。
另一方面,功能性糖的肠道发酵产物SCFA可增加上皮细胞的增殖,促进胰腺分泌活性物质。丁酸作为一种结肠上皮细胞能量来源能够增强结肠上皮细胞的屏障功能,有利于阻止机体分解,并降低DNA的氧化损伤[1]。功能性糖还可改善上皮细胞的生理功能以抵御病原菌的入侵。向断奶仔猪的日粮中添加乳果糖或菊粉后,乳酸菌和双歧杆菌的数量、SCFA(尤其是结肠中的丁酸)浓度以及回肠绒毛高度,均有显著的提高[14]。
4 展望
综上所述,功能性糖在畜禽健康养殖中具有卓越的功效。首先,功能性糖具有与病原菌受体糖蛋白相似的结构,能够阻断沙门氏菌、大肠杆菌与畜禽肠道上皮细胞的粘附。其次,某些功能性糖作为免疫刺激剂,可激活免疫细胞活性,增强动物体的免疫机能。再次,功能性糖具有非消化性,可选择性地刺激肠道有益菌增殖,尤其是乳酸菌、双歧杆菌,从而抑制沙门氏菌和大肠杆菌的生长。同时,功能性糖的发酵产物SCFA可下调黏附素或毒力因子的基因表达,增强肠道上皮细胞的屏障功能。
随着研究的不断推进,越来越多的功能性糖被应用到畜禽沙门氏菌病和大肠杆菌病的防治中。但是也有一些研究表明,功能性糖对提高畜禽生长性能、减少疾病发生并无显著效果。这说明功能性糖的防治效果与诸多因素有关,如饲料中功能性糖的添加量、畜禽养殖环境、动物日龄和种类等。随着糖生物学和糖生物工程的基础研究和应用研究水平的不断提高,糖生物工程产品必将在畜禽沙门氏菌和大肠杆菌感染的防治以及应对养殖行业“禁抗、限抗”的挑战中发挥出巨大的作用。
