蒺藜苜蓿赤霉素氧化酶基因MtGA20ox的功能解析
2019-04-01马青霞殷鹏程金竹萍王欢庆杨江平裴雁曦牛丽芳
马青霞, 殷鹏程, 林 浩, 金竹萍, 王欢庆, 杨江平, 裴雁曦*, 牛丽芳*
1.山西大学生命科学学院, 太原 030006;2.中国农业科学院生物技术研究所, 北京 100081;3.克拉玛依绿成农业开发有限责任公司, 新疆维吾尔自治区 克拉玛依 834000
紫花苜蓿(MedicagosativaL.)作为一种优质牧草在世界范围内被广泛种植,由于其含有黄酮类化合物、优质膳食纤维、食用蛋白等成分,且具有优异的消化率和较低的生产成本,故而被称为“牧草之王”[1,2]。紫花苜蓿在中国已有2 000多年栽培历史,是我国种植历史最久、经济价值最高的豆科牧草,所以苜蓿产量的提高可极大促进牧草产量的增加。
对近年来苜蓿产量的分析表明,我国苜蓿产业远远落后于美国,以2017年为例,2017年我国国内苜蓿总产量为250万t,而美国苜蓿总产量已超过1 000万t,随着今后我国对苜蓿需求量的不断增加,苜蓿将呈现供不应求的状态,依然需要通过进口途径大量获得[3]。已有研究表明,苜蓿的产量受到多重因素的共同影响,包括茎叶比、生长速度、鲜干比、株高和单枝重等,其中株高是呈现苜蓿生长状态、衡量其产量的重要指标,株高与苜蓿产量呈显著正相关[4]。同时,株高也受到多个因素的影响,其中,植物激素赤霉素(gibberellic acid,GA)对株高的调控作用至关重要,早在20世纪60年代已有研究证实赤霉素的调控会对植物株高产生影响[5,6]。
GA作为五大植物激素之一,参与调控植物生命周期的多个过程,包括植物的开花、种子的萌发、果实的发育、叶的伸展以及茎的伸长等。迄今为止,在植物中发现的GA已达136种,且按时间顺序将它们命名为GA1~GA136,其中只有少量GA具有生物活性(即对植物生长发育的调节具有生物效应),包括GA1、GA3、GA4和GA7等[7,8]。GA水平受到多种途径的共同调控,其中GA合成途径是调控GA水平必不可少的过程。GA是一种由四环骨架衍生而得的双萜类化合物,GA合成的过程可分为3个阶段,在此期间参与GA合成的酶主要有古巴焦磷酸合成酶、内根-贝壳杉烯氧化酶、GA20-氧化酶(GA20-oxidase,GA20ox)、GA2-氧化酶(GA2-oxidase,GA2ox)以及GA3-氧化酶(GA3-oxidase,GA3ox)等[9]。GA20ox、GA2ox以及GA3ox是GA生物合成过程中的关键酶,其中,GA20ox是一种双加氧酶,其可将GA合成途径中无生物活性的GA53和GA12氧化成有生物活性的GA20和GA9[10]。GA20ox作为GA生物合成阶段的限速酶,在GA生物合成过程中起关键作用。
已有研究表明,在水稻、拟南芥和玉米等多个物种中,GA20-氧化酶基因的缺失会导致植株矮化,如水稻Os20ox2基因的缺失导致sd-1突变体植株出现半矮化的表型;拟南芥AtGA20ox1、AtGA20ox2和AtGA20ox3基因的缺失导致突变体植株出现不同程度的矮化性状等[9,11,12],值得注意的是,拟南芥AtGA20ox1、AtGA20ox2、AtGA20ox3和AtGA20ox4均具有完整的GA20-氧化酶活性,而GA20ox5不能将无生物活性的GA氧化生成有生物活性的GA。同时,在多个物种中的研究发现GA20-氧化酶基因的过表达植株呈现株高增加的表型[10,13,14]。
紫花苜蓿由于转化效率低、基因组较大且为同源四倍体等特征不易开展基因功能解析研究,而紫花苜蓿的的近源种蒺藜苜蓿(Medicagotruncatula)由于生长周期较短、基因组较小、遗传转化效率较高和自花授粉等特点成为豆科模式植物,蒺藜苜蓿和紫花苜蓿在遗传上具有相似性,因此在蒺藜苜蓿中获取的信息也可用于紫花苜蓿。目前已有研究表明,在蒺藜苜蓿中GA20ox基因的变化与体细胞胚发生过程相关[15],但是在蒺藜苜蓿中该基因对株高的调控尚不清楚,由于该基因功能与植株矮化的性状密切相关,而植株矮化和半矮化的表型有利于植物抗倒伏,进而可促进农业的发展[16],因此,本研究以蒺藜苜蓿为实验材料,通过反向遗传学的方法对蒺藜苜蓿GA20ox基因进行初步研究,并对其对株高的调控作用进行深入解析,以期为进一步研究苜蓿中GA20ox的基因功能提供一定的参考依据。
1 材料与方法
1.1 实验材料
1.1.1植物材料 蒺藜苜蓿野生型R108由本实验室保存,突变体mtga20ox7-1、mtga20ox7-2以及mtga20ox8-1从美国诺贝尔研究所(Noble Research Institute)获得。烟草种子由本实验室保存。
蒺藜苜蓿种子处理:选择健康饱满且生长状态均匀的种子,在砂纸上将种子种皮磨破后浸泡于清水中直至种子吸水膨胀,将吸水后的种子铺在有双层湿滤纸的培养皿中进行萌发。实验材料在生长条件为温度24℃、湿度70%、光照强度380 μmol/m2·s、光周期16 h(光)/8 h(暗)的温室培养生长。
1.1.2实验试剂 TRIzol、焦炭酸二乙酯(DEPC)、Gateway LR Clonase II Enzyme mix和Gateway BP Clonase II Enzyme mix均购自美国Invitrogen公司;反转录试剂盒(TransScript-Uni One-Step gDNA Removal and cDNA Synthesis SuperMix)购自北京全式金生物技术(TransGen Biotech)有限公司;高保真酶KOD FX购自日本东洋纺公司;DNA凝胶回收试剂盒和质粒提取试剂盒购自天根生化科技(北京)有限公司;各种限制性内切酶均购自美国NEB公司。
1.2 实验器材
5424R/5702R/5430R离心机(德国Eppendorf公司),PCR扩增仪(杭州博日科技有限公司),D7100照相机(日本尼康公司),LSM700激光共聚焦显微镜(德国卡尔·蔡司公司),电泳系统(美国Bio-Rad公司),凝胶成像系统1600(上海天能科技有限公司)。引物合成和样品测序由生工生物工程(上海)股份有限公司完成。
1.3 GA20ox系统进化树的构建及蛋白质序列分析
从TAIR(www.arabidopsis.org)网站下载5个拟南芥AtGA20ox的蛋白质序列,在MedicagotruncatulaGenome Database(http://blast.jcvi.org/Medicago-Blast/)中通过BLASTP找到与拟南芥AtGA20ox同源的MtGA20ox的蛋白质序列,将它们进行序列同源性比对并采用MEGA5.0软件构建系统进化树。在NCBI protein数据库(https://www.ncbi.nlm.nih.gov/)中分析GA20ox蛋白的保守结构域,通过BioEdit的ClustalW Multiple alignment软件对MtGA20ox与AtGA20ox蛋白进行序列比对分析。
1.4 RT-PCR检测MtGA20ox基因的组织表达特性
提取野生型R108不同组织的总RNA,包括生长28 d植株的根,生长40 d植株的茎,生长50 d植株的未展开的复叶、花苞,开花后10 d植株的种子以及营养生长时期的茎尖。反转录过程参照反转录试剂盒的操作说明进行,以反转录后的cDNA为模板,利用各自基因特异性引物通过RT-PCR方法进行基因表达量分析(引物见表1)。RT-PCR反应体系(20 μL):2×PCR Buffer for KOD FX 10 μL,dNTPS(150 mmol/L)2 μL,KOD FX 0.4 μL,模板cDNA 0.5 μL,上、下游引物(10 μmol/L)各1 μL,ddH2O 5.1 μL。RT-PCR反应程序:98℃ 2 min;98℃ 20 s,58℃ 20 s,68℃ 1 min;68℃ 2 min;24℃ 1 min。以MtActin为内参,检测基因在不同组织中的相对表达量,其中MtActin基因扩增25个循环,MtGA20ox基因扩增30个循环。每个实验进行3次生物学重复。
1.5 MtGA20ox蛋白的亚细胞定位
通过Gateway系统,分别构建了含有融合绿色荧光蛋白(green fluorescent protein,GFP)标签的过表达载体pMDC83-35S∷MtGA20ox1-GFP、pMDC83-35S∷MtGA20ox7-GFP和pMDC83-35S∷MtGA20ox8-GFP。再通过EHA105农杆菌介导的烟草瞬时转化的方法将3个载体分别转入生长3~4周龄的烟草叶片中,对侵染后的烟草进行3 d黑暗处理后在激光共聚焦扫描显微镜下观察MtGA20ox蛋白的亚细胞定位。

表1 实验所用引物Table 1 Primers used in the experiment.
1.6 突变体表型观察及数据统计
分别取3个50 d突变体植株进行表型观察和数据统计,统计所有突变体主茎的长度,每个突变体至少统计15个植株。
2 结果与分析
2.1 MtGA20ox蛋白的系统进化树
为了分析蒺藜苜蓿MtGA20ox与拟南芥AtGA20ox的亲缘关系,通过MEGA软件对拟南芥和蒺藜苜蓿的GA20ox蛋白进行分子系统进化分析并构建系统进化树。如图1所示,发现在蒺藜苜蓿中有8个拟南芥AtGA20ox的近缘蛋白,这与Igielski等[15]的研究结果一致。其中,与参与有活性GA合成的AtGA20ox1~4亲缘关系较近的为MtGA20ox1、MtGA20ox7和MtGA20ox8。同时,系统进化树表明,其他5个MtGA20ox均与GA20ox蛋白聚在1个分支。
2.2 MtGA20ox蛋白的氨基酸序列比对
通过BioEdit软件将MtGA20ox与拟南芥AtGA20ox的氨基酸序列进行比对,结果如图2所示,发现MtGA20ox1、MtGA20ox7以及MtGA20ox8与拟南芥AtGA20ox蛋白的氨基酸序列高度同源,且所有的氨基酸序列均含有1个保守的2OG-FeⅡ_Oxy结构域[17,18]。
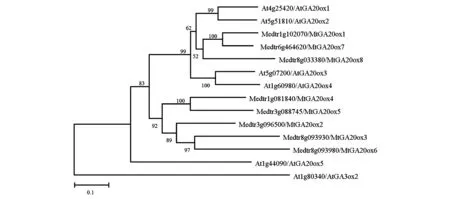
图1 拟南芥AtGA20ox与蒺藜苜蓿MtGA20ox蛋白的系统进化树Fig.1 Phylogenetic tree of AtGA20ox and MtGA20ox.
2.3 MtGA20ox基因的表达模式分析
为了进一步分析MtGA20ox1、MtGA20ox7和MtGA20ox8在不同组织器官中的表达情况,本实验通过RT-PCR分别检测了3个基因在蒺藜苜蓿各组织中的表达量。如图3所示,MtGA20ox1在蒺藜苜蓿的根、茎、花、种子和茎尖中均有表达,在叶中表达量较低;MtGA20ox7在蒺藜苜蓿的根、叶、花、种子和茎尖中均有表达,在茎中表达量较低;而MtGA20ox8在蒺藜苜蓿的茎和种子中有表达,在根、叶、花以及茎尖中表达量较低。其中,MtGA20ox1、MtGA20ox7、MtGA20ox8分别在花、叶、种子中表达量最高,且它们分别与其他组织中表达量相比差异明显,表明MtGA20ox1、MtGA20ox7以及MtGA20ox8的表达具有组织特异性[19],可能与它们参与不同的组织发育相关。
2.4 MtGA20ox蛋白亚细胞定位
蛋白质是生命活动体现者,亚细胞定位对分析其功能及作用极其重要[20],为了确定MtGA20ox蛋白在植物亚细胞结构中的分布情况,将MtGA20ox1、MtGA20ox7和MtGA20ox8基因的编码序列分别构建到pMDC83载体中,得到它们分别与GFP融合的表达载体,再通过注射渗透法对烟草叶片进行瞬时转化,利用激光共聚焦显微镜来观察瞬时表达的绿色荧光。结果表明,MtGA20ox1、MtGA20ox7和MtGA20ox8定位在细胞核和细胞质中[21],这与前人研究的GA20ox在许多其他物种中的定位相一致[22]。

图2 GA20ox氨基酸序列比对Fig.2 Alignment of the amino acid sequences of GA20ox.
2.5 MtGA20ox7和MtGA20ox8的突变体鉴定
为了研究MtGA20ox1、MtGA20ox7和MtGA20ox8的基因功能,本实验从蒺藜苜蓿Tnt1逆转座子插入突变体库中筛选获得了MtGA20ox7和MtGA20ox8对应的插入突变体。如图5A所示,MtGA20ox7筛选到2个Tnt1插入突变体,分别命名为mtga20ox7-1和mtga20ox7-2,其中mtga20ox7-1中Tnt1插入在第1个外显子上,mtga20ox7-2中Tnt1插入在第2个外显子上,通过RT-PCR检测发现在mtga20ox7-1和mtga20ox7-2中均未检测到全长MtGA20ox7基因的表达(图5C)。如图5B所示,MtGA20ox8筛选到Tnt1插入在第1个外显子上的1个突变体mtga20ox8-1,通过RT-PCR检测发现在mtga20ox8-1中未检测到全长MtGA20ox8基因的表达(图5D),表明这3个突变体均为基因功能缺失突变体。
2.6 突变体表型分析及主茎长度的统计
进一步对得到的3个突变体进行表型观察和主茎长度数据统计分析。如图6所示,mtga20ox7-1、mtga20ox7-2和mtga20ox8-1与野生型相比株高无明显变化,上述结果表明,MtGA20ox7和MtGA20ox8的单独突变对蒺藜苜蓿的主茎长度没有影响。

图3 MtGA20ox1、MtGA20ox7和MtGA20ox8在蒺藜苜蓿不同组织中的表达模式Fig.3 Expression patterns of MtGA20ox1, MtGA20ox7 and MtGA20ox8 in different tissues of M. truncatula.
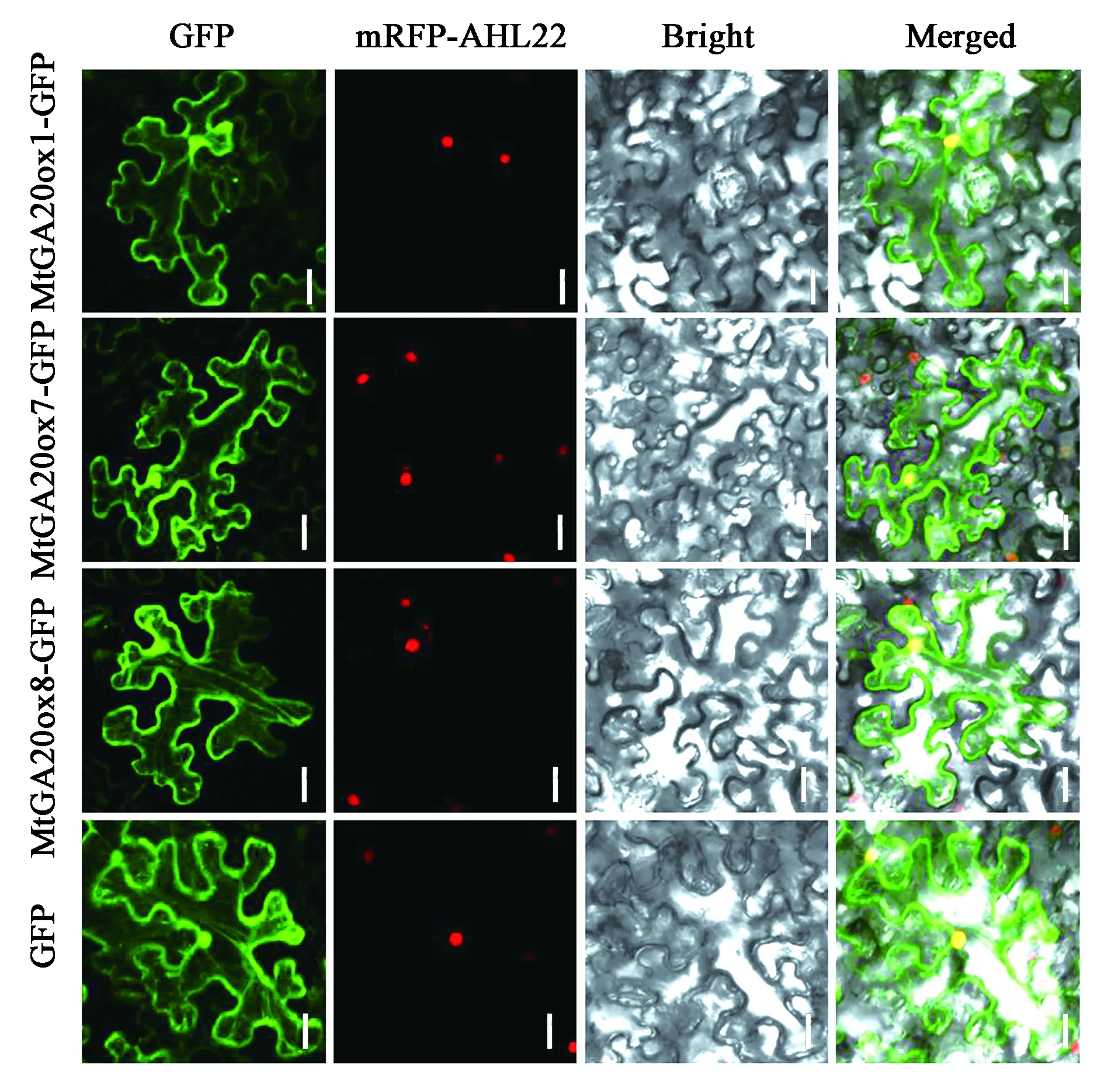
图4 MtGA20ox1、MtGA20ox7和MtGA20ox8在烟草表皮细胞的亚细胞定位Fig.4 Subcellular localization of MtGA20ox1, MtGA20ox7 and MtGA20ox8 in tobacco epidermal cells.

图5 MtGA20ox的基因结构以及突变体中MtGA20ox的表达检测Fig.5 Structures of the MtGA20ox genes and transcriptions of MtGA20ox in mutants.
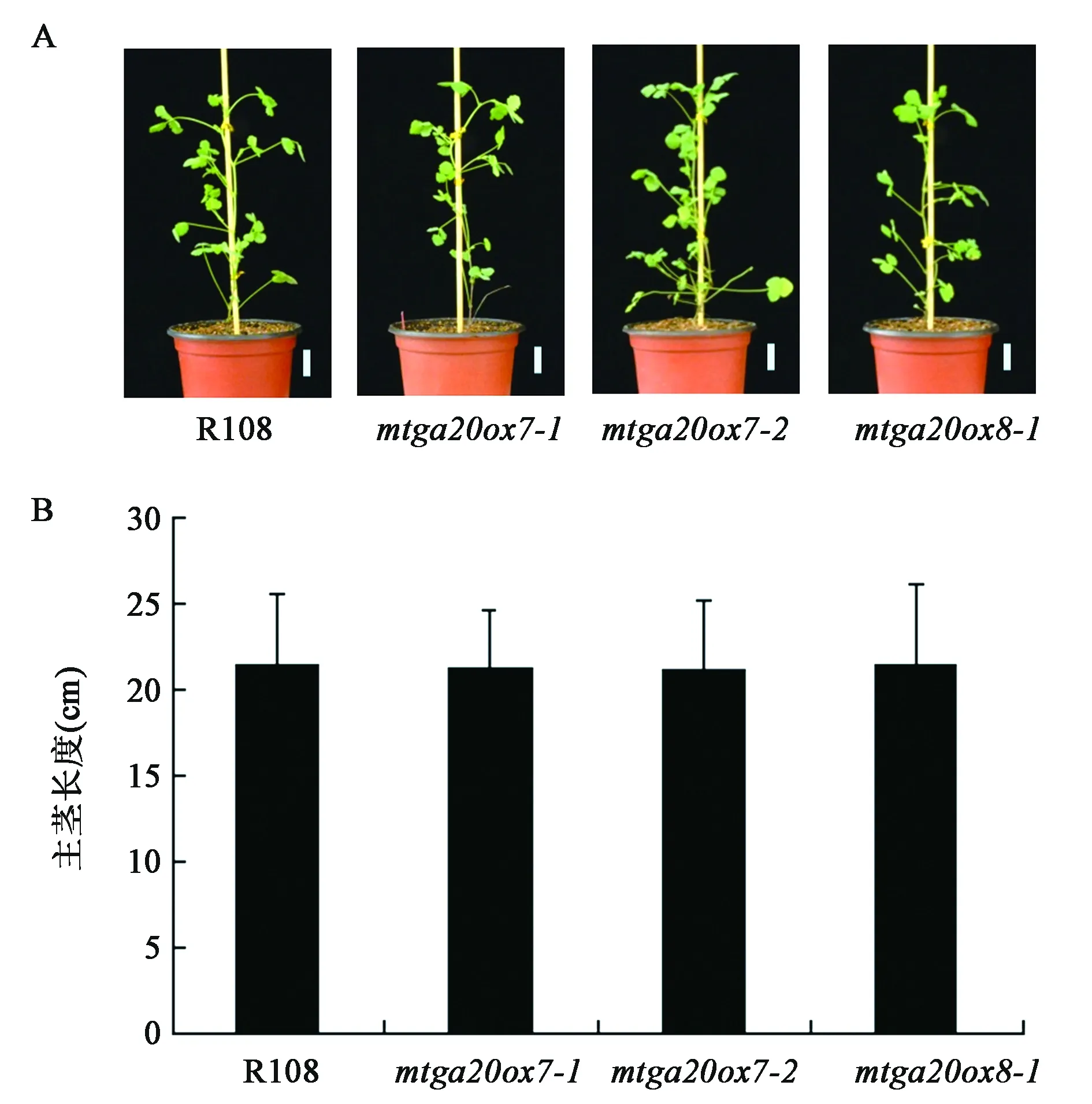
图6 突变体株高表型分析Fig.6 The phenotypes of plant height of mutants.
3 讨论
中国作为草原资源大国,天然草原面积393万km2,约占国土总面积的41.7%,仅次于澳大利亚,居世界第2位[23]。但我国苜蓿产量仍不理想,同时随着畜牧业的发展,我国对苜蓿的需求也逐年增加,因此,提高苜蓿产量已成为生产中亟待解决的问题。
已有研究表明,株高与作物产量和生物量密切相关。植物株高受到不同遗传信号、环境因素和植物激素的共同调控,其中GA对株高的影响尤为重要。在水稻、玉米、拟南芥中,GA20ox基因的突变都会导致植株不同程度的矮化[10,12,24],但在苜蓿中关于GA20ox基因对株高调控的研究尚未开展。
拟南芥5个GA20ox同源蛋白中,AtGA20ox1、AtGA20ox2、AtGA20ox3和AtGA20ox4均能够在体外将无生物活性的GA12转化为有生物活性的GA9,而在相同的反应条件下,AtGA20ox5不能将GA12转化为有生物活性的GA9。由此可见,在拟南芥5个同源蛋白中,AtGA20ox1、AtGA20ox2、AtGA20ox3和AtGA20ox4具有完整的GA20ox活性,而AtGA20ox5仅催化GA12转化为GA9的前2个反应[9]。在蒺藜苜蓿中与拟南芥AtGA20ox1、AtGA20ox2、AtGA20ox3和AtGA20ox4亲缘关系较近的GA20ox基因有3个,分别为MtGA20ox1、MtGA20ox7和MtGA20ox8,本实验通过反向遗传学的方法对MtGA20ox1、MtGA20ox7和MtGA20ox8基因的生理特性和功能进行了研究。通过氨基酸序列比对发现,MtGA20ox1、MtGA20ox7和MtGA20ox8氨基酸序列都含有2OG-FeⅡ_Oxy结构域。已有研究表明,2OG-FeⅡ_Oxy是一个2-酮戊二酸和Fe2+依赖的双加氧酶超家族保守结构域,2-酮戊二酸和Fe2+能与底物相互作用发生反应,进而催化赤霉素生物合成过程中不同的羟基化和去饱和步骤[25,26],因此下一步实验计划将检测MtGA20ox是否具有酶活。
通过对筛选得到的突变体进行表型观察和数据统计发现mtga20ox7和mtga20ox8突变体与野生型相比株高无变化,可能由于MtGA20ox在控制株高性状时存在功能冗余或者这2个MtGA20ox无酶活。为了深入研究MtGA20ox基因的功能,首先需要获得MtGA20ox1基因的功能缺失突变体,同时通过人工杂交构建其两两之间的双突变体和三突变体并对其进行表型观察;其次通过转化实验获得3个MtGA20ox过表达植株观察其是否具有株高增加的表型,最后通过测定各个突变体中GA的含量以及体外酶活实验确定其是否具有酶活性。
