陇西腊肉加工过程中优势乳酸菌的分离及其发酵性能研究
2019-04-01邓展瑞贠建民牛耀星李彦虎
邓展瑞, 贠建民, 郭 娟, 牛耀星, 李彦虎
甘肃农业大学食品科学与工程学院, 兰州 730070
腊肉是一种中国特色传统发酵肉制品,具有色泽鲜美、风味浓厚、食用方便、便于贮藏等特点[1]。传统的腊肉制品是以新鲜的畜禽肉为原料,添加一定的辅料,经过腌制、风干等多道工序加工而成[2],我国腊肉按地区可分为四川腊肉、甘肃陇西腊肉、湖南腊肉、广东腊肉等[3]。陇西腊肉是以五花肉为原料,添加食盐、八角、花椒等十多种辅料,以传统的生产加工方式腌制而成[4]。
长期以来,腊肉制品多通过手工作坊生产,多种微生物自然发酵产生的独特风味物质赋予了其良好的口感[5]。但由于在腊肉生产加工过程中缺乏对微生物的有效控制,腊肉在货架期易发生微生物性腐败等不同程度的质量问题[6],而且传统发酵肉制品工业化生产及工艺现代化改造等方面的研究起步较晚,这种状况制约了传统肉制品加工产业的持续发展。

本研究以陇西腊肉为分离材料,通过经典形态学分类和生理生化鉴定,分析陇西腊肉中的优势乳酸菌;并通过测定优势乳酸菌菌株的产酸能力、生长特性、耐氯化钠和亚硝酸钠能力以及产气、产黏液、产蛋白酶和脂肪酶的能力等,筛选出具有优良发酵性能的菌株;随后开展人工接种优良菌株的腊肉模拟加工试验,分析其对腊肉感官品质的影响,以期筛选出可用于陇西腊肉加工的发酵性能优良的乳酸菌,为陇西腊肉发酵剂的研制及其向工艺现代化改造发展提供一定的依据和参考。
1 材料与方法
1.1 材料
试验所用陇西腊肉为甘肃省陇西县大胡子腊肉。采样阶段:原料肉、腌制中期(1~25 d,于第23 d采样)、腌制后期(26~45 d,于第45 d采样)、风干中期(46~90 d,于第70 d采样)、成品肉。每个采样时间点3次重复。
1.2 仪器与设备
LDZX-50KBS型立式压力蒸汽灭菌器(上海申安医疗器械厂);超净工作台(苏净集团苏州安泰空气技术有限公司);XSP-SM02型显微镜(重庆光学仪器厂);pHS-3C型pH计(上海雷诺仪器厂);FA1204B型电子天平和722S型可见分光光度计均购自上海佑科仪器仪表有限公司;电热鼓风干燥箱和电热恒温培养箱均购自上海精宏仪器设备有限公司。
1.3 微生物计数
1.3.1取样 ①表面取样。陇西腊肉的表面取样参照GB 4789.17-2003[14],采用棉拭取样法。首先,制作1个5 cm2(2.5 cm×2 cm)的取样器,于无菌条件下,在陇西腊肉的表面确定10个点。然后,将5 cm2的取样器依次压在陇西腊肉表面已确定的10个点上,将灭菌棉签稍沾湿,于取样器5 cm2的范围内揩抹多次,随后立即剪断,投入装有50 mL灭菌水的锥形瓶中。10个棉签完全浸在锥形瓶的无菌水中,将锥形瓶放置在摇床培养箱中,于30℃、160 r/min的条件下振荡培养30 min,然后取瓶中的液体作为基础液,再按要求作10倍递增稀释。
②内部取样。陇西腊肉的内部面取样参照GB 4789.17-2003[14]。将内部面进行表面灼烧消毒,再用无菌剪刀剪取陇西腊肉内部深层肌肉25 g,放入灭菌乳钵内,用灭菌剪刀剪碎后,加入灭菌海沙,磨碎后加入灭菌水225 mL,混匀,即为10-1稀释液。
1.3.2乳酸菌计数 乳酸菌计数方法参照GB 4789.2-2016[15]。乳酸菌计数通常选用菌落个数在30~300之间的平板进行。
1.4 优势乳酸菌的鉴定
1.4.1优势乳酸菌的菌落观察 选取适宜浓度的陇西腊肉不同加工阶段的微生物稀释液涂布在MRS培养基上,培养48 h后,对平板上菌落形态不同且数量多的单菌落进行纯化;再以革兰氏染色为阳性、在含有2% CaCO3的MRS培养基上37℃培养24 h后出现溶钙圈为标准,筛选符合条件的菌株,并进行单菌落形态观察和菌落特征描述。
1.4.2优势乳酸菌的细胞形态观察 根据《微生物学实验手册》[16]的方法,挑取MRS固体培养基上的优势乳酸菌株菌落进行革兰氏染色,在光学显微镜(目镜10×,物镜100×)下观察菌株的细胞形态。
1.4.3优势乳酸菌的生理生化鉴定 以《乳酸细菌分类鉴定及实验方法》[17]和《常见细菌系统鉴定手册》[18]为参考依据,将初筛得到的菌株通过石蕊牛奶分解、V-P产生、接触酶检测、革兰氏染色、七叶灵水解、糖发酵实验、硝酸盐还原、氧化酶检测、明胶水解、运动性检测、葡萄糖产酸产气等实验进行进一步鉴定。
1.5 发酵性能优良的菌株筛选
1.5.124 h产酸能力测定 通过活化筛选出的优势乳酸菌菌株得到种子液,将种子液按照1%比例接种在150 mL MRS液体培养基中,于37℃培养24 h,每4 h吸取5 mL发酵液,用pH计测定相应的pH。
1.5.2生长曲线的测定 参照潘晓倩等[19]的方法。通过活化筛选出的优势乳酸菌菌株得到种子液,将种子液按照1%比例接种在150 mL MRS液体培养基中,于37℃培养24 h,每2 h吸取10 mL发酵液,以未接种的MRS培养基做空白对照,测量每株菌株发酵液的OD600,以培养时间为横坐标、OD600为纵坐标绘制其生长曲线。
1.5.3耐受能力测定 参照胡美忠等[20]的方法测定菌株对6.5%氯化钠和150 mg/L亚硝酸钠的耐受能力。通过活化筛选出的优势乳酸菌菌株得到种子液,将种子液按照1%比例分别接种在添加了6.5% NaCl和150 mg/L NaNO2的100 mL MRS液体培养基中,于37℃静置培养24 h后,以空白MRS培养基为对照,分别测定各菌株菌液的OD600。
1.5.4产黏液能力测试 参照胡美忠等[20]的方法。将筛选得到的优势乳酸菌菌株接种于MRS固体培养基(其中以蔗糖代替葡萄糖)上,30℃培养24 h,用接种针挑取菌落直接观察是否出现黏液。
1.5.5产气能力测试 参照胡美忠等[20]的方法。将筛选得到的优势乳酸菌菌株穿刺接种到含0.8%琼脂的MRS培养基试管中,再向试管中倾倒2 cm 2%琼脂封口,37℃培养48 h,观察试管产生气泡情况,若试管内出现气泡或者顶起2%的琼脂,说明产气。
1.5.6产酶能力测定 利用琼脂板法测定菌株产蛋白酶能力[21]。将筛选得到的乳酸菌接种在添加了10%脱脂牛奶的MRS培养基中,37℃静置培养72 h后观察菌落周围是否出现蛋白水解圈。参照胡珺等[22]的方法测定菌株产脂肪酶能力。将筛选得到的优势乳酸菌菌株划线培养于MRS培养基,37℃静置培养48 h后进行活化,将活化后的菌落转接种于添加了1%三丁酸甘油酯的MRS培养基,37℃静置培养72 h后观察菌落周围是否出现脂肪水解圈。
1.6 乳酸菌优良菌株的分子生物学鉴定
提取筛选出的优良菌株的总DNA,16S rDNA扩增和测序由北京天一辉远生物科技有限公司完成,将测序所得的16S rDNA序列校对后,利用NCBI的GenBank(http://www.ncbi.nlm.nih.gov/BLAST)数据库进行BLAST分析,根据序列同源性,确定菌株的种属关系。采用MEGA 7.0建立菌株的系统发育树。
1.7 接种乳酸菌优良菌株的模拟腊肉发酵试验
将新鲜菌液按2%的接种量转接至MRS肉汤培养基中,37℃培养18~24 h,于4℃ 5 000 r/min离心15 min后收集沉淀,用无菌生理盐水洗涤,再次离心收集沉淀,随后加入无菌生理盐水将菌体悬浮,制备107CFU/g菌悬液,4℃保存备用。
在甘肃省陇西县大胡子腊肉生产基地,在传统的陇西腊肉制作工艺方法和配料的基础上,对原料肉进行乳酸菌优良菌株的喷涂接种,接种量为1 mL/kg。原料肉大小为40 cm×15 cm,约4 kg。55 d后获得成品肉。同时,以未进行接种的腊肉作为对照组。
1.8 成品肉感官评价
选择15位专业人员组成感官评定小组,将接种和未接种的腊肉分别在高压锅内蒸30 min,蒸熟后切成厚度为4~5 mm的切片,分别对2种产品的气味、滋味、色泽、口感和组织结构5项指标进行评定(表1),确定产品整体可接受性。根据腊肉产品的感官要求,设定各指标的权重为气味0.3、滋味0.3、色泽0.2、口感0.1、组织结构0.1。

表1 感官评价评分标准Table 1 Standard of sensory evaluation.
1.9 数据分析
所有数据均为3次重复试验所得,然后利用SPSS 20进行显著性分析、Excel 2010计算平均值和标准误差、Origin 8.0绘图。
2 结果与分析
2.1 陇西腊肉加工过程中乳酸菌数量动态变化
为了更好地控制陇西腊肉加工过程中的有益菌群,保证产品品质,首先对陇西腊肉加工过程中乳酸菌数量的动态变化进行了分析。图1反映了陇西腊肉加工过程不同阶段表面和内部乳酸菌数的变化规律。从原料肉到成品肉,陇西腊肉表面和内部的乳酸菌数均呈先升高后降低趋势。每个阶段中表面乳酸菌数都比内部乳酸菌数多,但腌制中后期表面乳酸菌数比内部乳酸菌数增长速度慢,从腌制中期到腌制后期,表面和内部的乳酸菌数分别增长了7.22倍和38.11倍;到风干中期,陇西腊肉表面和内部的乳酸菌数达到峰值,分别为3.62×107CFU/g和2.77×106CFU/g,表面乳酸菌数比内部乳酸菌数高出3.34×107CFU/g;之后随着加工过程的进行,乳酸菌数逐渐下降。
从原料肉到腌制后期,由于肉块基质中含有丰富的营养物质,且pH、水分活度适宜,有利于乳酸菌的生长,因而引起表面和内部的乳酸菌数持续增加;到了风干中期,因为肉块要悬于晾晒架上进行晾晒,肉块开始与空气接触,来自环境的乳酸菌又附着在肉块表面并开始生长繁殖,且这个阶段肉块基质中水分含量和营养物质也满足乳酸菌生长需要,因此,表面和内部的乳酸菌数仍在逐渐增加。但是随着风干的进行,肉块基质中的水分含量迅速下降,同时因微生物的生长消耗,基质中还原糖含量逐渐减少,不适宜乳酸菌生长,从而使陇西腊肉表面和内部的乳酸菌数呈下降趋势。
从乳酸菌数在肉块基质的分布来看,内部乳酸菌数量明显低于表面,这可能是由于内部乳酸菌主要是从表面侵入肉块的。而在腌制中后期,表面乳酸菌数量比内部乳酸菌增长速度缓慢,这是由于在腌制过程中,大量食盐和辛香料的添加,致使肉块表面渗透压迅速增加,并随食盐和辛香料从肉块表面慢慢渗入内部。由于表面食盐浓度高于内部,所以肉块基质表面的水分活度低于内部的水分活度,不利于乳酸菌等微生物的生长,从而导致内部乳酸菌增长速度比表面的快。

图1 陇西腊肉加工过程乳酸菌数的变化趋势Fig.1 Changing trend of LAB number during the processing of Longxi bacon.
2.2 优势乳酸菌分离鉴定
选取适宜浓度的陇西腊肉不同加工阶段的微生物稀释液涂布在MRS培养基上培养48 h,随后在平板上挑取菌落形态不同且数量多的单菌落,利用平板划线法,将分离到的菌株在MRS培养基上进行纯化,共得到38株乳酸菌。经革兰氏染色试验以及在含有2% CaCO3的MRS培养基上培养,进一步筛选获得7株符合条件的菌株,即革兰氏染色为阳性、有溶钙圈且溶钙圈与菌落直径之比大的菌株[23]。将初筛得到的7株菌株分别编号为R-1、R-2、R-3、R-4、R-5、R-6和R-7(图2)。其中,腌制中期分离出的菌株为R-2和R-6;腌制后期分离出的菌株为R-3;风干中期分离出的菌株为R-1、R-4和R-7;成品肉分离出的菌株为R-5。
以《乳酸细菌分类鉴定及实验方法》[17]和《常见细菌系统鉴定手册》[18]为参考依据,对筛选出的7株优势菌进行形态学分类和生理生化鉴定。由表2和表3可知,R-1为植物乳杆菌(Lactobacillusplantarum),R-2为米酒乳杆菌(L.sake),R-3为乳酸乳球菌(Lactococcuslactis),R-4为戊糖片球菌(Pediococcuspentosaceus),R-5为肠膜明串珠菌(Leuconostocmesenteroides),R-6为食品乳杆菌(L.alimentarius)和R-7为弯曲乳杆菌(L.curvatus)。
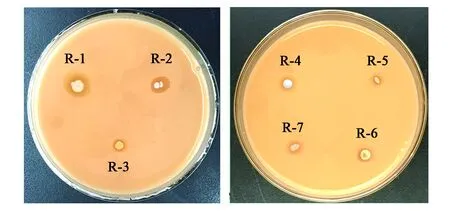
图2 乳酸菌菌株的溶钙圈大小Fig.2 Sizes of dissolved calcium circle of LAB strains.

表2 乳酸菌菌株的形态特征Table 2 Morphological characteristics of LAB.
2.3 发酵性能优良的乳酸菌筛选
2.3.124 h产酸能力测定 乳酸菌的24 h产酸能力是衡量菌株品质优劣的一个重要指标[24]。图3揭示了乳酸菌在发酵过程中pH的变化规律。随着时间的延长,培养基的pH不断降低,所有菌株培养基pH由最初的6.78左右下降到了4.27以下。其中R-1和R-4下降幅度最大,在培养24 h后pH分别为3.30和3.47。菌株在生长过程中的前12 h,pH迅速下降,主要与培养初期乳酸的形成有关,12 h后,菌株产酸能力减弱,pH的下降速度开始减慢。
2.3.2生长曲线测定 在腊肉制品加工过程中,乳酸菌的生长情况也起着非常重要的作用。乳酸菌可通过产生酸性物质抑制某些不耐酸的有害菌生长,从而抑制腐败菌和致病菌对腊肉制品的危害[25,26]。将7株菌株的种子液接种于MRS液体培养基中,菌株的生长曲线如图4所示,0~2 h为菌株的延迟期,时间较短;2 h到10~12 h为对数期;10~12 h到24 h为稳定期。可见7株菌株的延迟期较短,稳定期时间较长。其中R-1和R-4对数期增长速度最快,R-1的OD600由0.143增长到2.027,R-4的OD600由0.111增长到1.705。7株菌株的生长速度由快到慢分别是R-1>R-4>R-2>R-6>R-7>R-5>R-3,其中R-1生长速度最快。
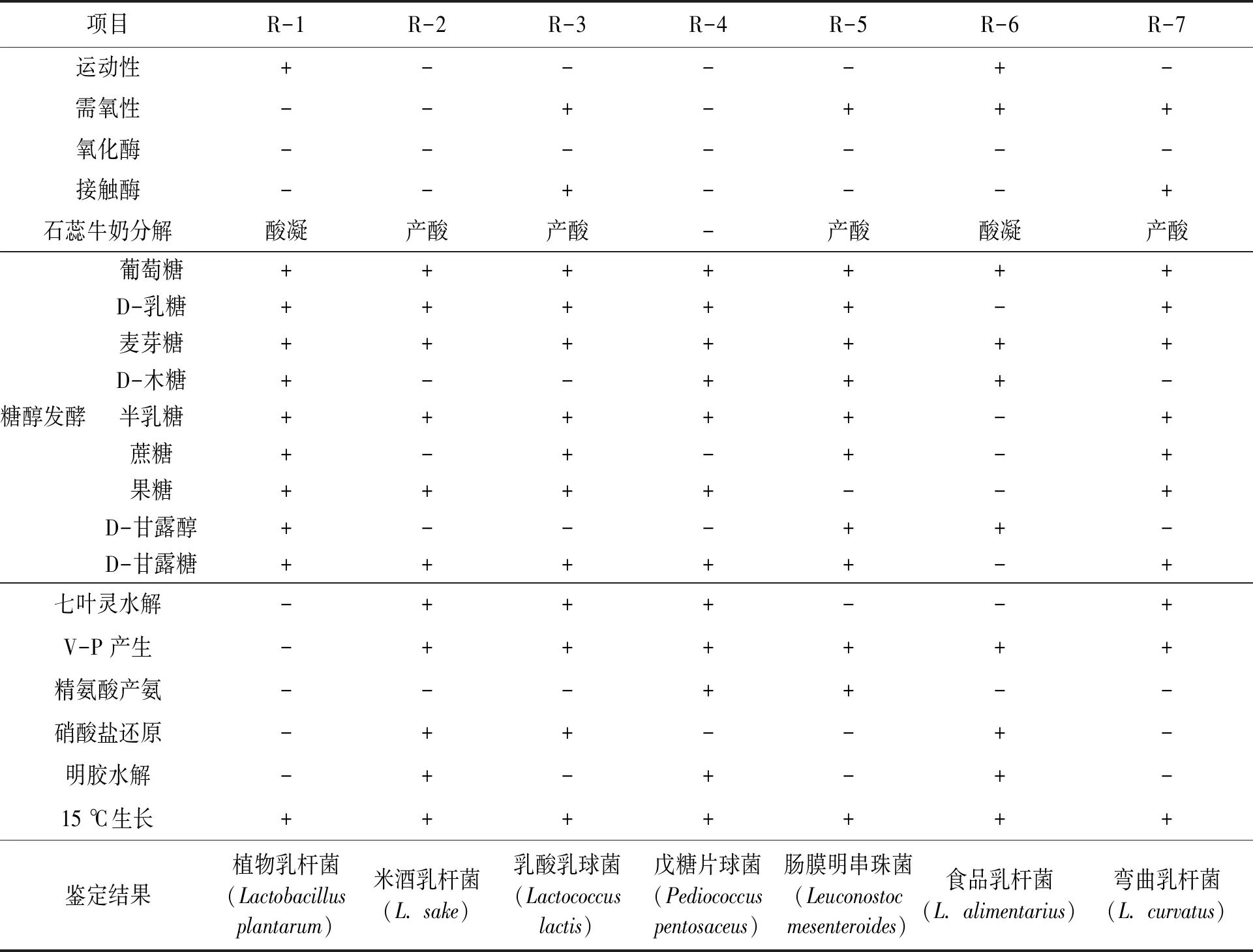
表3 乳酸菌菌株的生理生化特性Table 3 Physiological and biochemical characteristics of LAB.

图3 乳酸菌的产酸能力Fig.3 Acid-producing capacity of LAB.
2.3.3耐受能力测定 对NaCl的耐受能力是选择发酵肉制品发酵剂的一个重要因素,实际生产要求菌株至少耐受6% NaCl[27]。从图5可以看出,添加6% NaCl后7株菌株的生长均受到了不同程度的抑制。其中R-1受抑制程度最小(P<0.05),添加NaCl后OD600由1.989下降至1.887,抑制程度为5.09%;R-2受抑制程度最大(P<0.01),添加NaCl后OD600由1.342下降至0.737,抑制程度为45.10%;R-3、R-4、R-5、R-6、R-7受抑制程度分别为17.33%、14.11%、22.57%、16.39%、18.34%。

图4 乳酸菌的生长曲线Fig.4 Growth curve of LAB.
GB 2762-2017规定亚硝酸钠在肉制品中的最大使用量是150 mg/kg[28],GB 2760-2014规定亚硝酸钠在肉制品中的最大残留量不超过30 mg/kg[29]。如图5所示,当NaNO2浓度为150 mg/kg时,7株菌株生长均受到不同程度抑制,其中R-1受抑制程度最小(P<0.05),添加NaNO2后OD600由1.989下降至1.763,抑制程度为11.37%;R-5受抑制程度最大(P<0.01),添加NaNO2后OD600由1.103下降至0.750,抑制程度为30.12%;R-2、R-3、R-4、R-6、R-7的抑制程度分别为23.33%、15.50%、23.97%、25.33%、14.94%。

图5 乳酸菌耐氯化钠和亚硝酸钠的能力Fig.5 Tolerance to sodium choride and sodium nitrite of LAB.
2.3.4产气、产黏液及产酶能力测定 在腊肉加工过程中,一些乳酸菌经异型乳酸发酵会产生醋酸和CO2,影响产品的风味品质、组织结构[30];而乳酸菌发酵产生的黏液会影响肉制品的颜色、质地甚至口味[31]。同时,肉制品在发酵过程中,在其内源蛋白酶的作用下,将蛋白质降解为氨基酸或多肽等,对于发酵肉制品良好风味的形成至关重要。因此,肉制品发酵所使用的微生物发酵剂不应具有较强的分解蛋白质的能力[32]。另外,微生物发酵剂也不应具有降解脂肪的能力,否则会将脂肪降解为游离脂肪酸,进而形成碳基化合物等小分子物质,导致发酵肉制品酸败[33]。
7株菌株的基本发酵特性结果如表4所示。可知,只有R-5产黏液;只有R-5和R-6发酵葡萄糖产气,其他菌株均不产气;所有菌株均对蛋白质和脂肪无分解作用。

表4 优势乳酸菌发酵性能Table 4 The fermentation performance of LAB.
注:+为阳性反应;-为阴性反应。
综上所述,结合菌株的产酸能力、生长能力和耐受能力,在所有菌株中,R-1产酸能力强、生长速度更快,对食盐和亚硝酸钠均具有较好的耐受性。所以在7株菌株中,R-1更适合作为陇西腊肉加工过程中的乳酸菌发酵剂。
2.4 乳酸菌R-1的分子生物学鉴定
菌株R-1的PCR产物凝胶电泳分析结果如图6所示,得到1条约1 500 bp的DNA片段,符合细菌16S rRNA序列长度,测序比对后发现,菌株R-1的16S rRNA序列与GenBank中LactobacillusplantarumLP2(登录号为CP020816.1)的序列同源性达到98%。因此,菌株R-1的16S rRNA分子生物学鉴定结果为植物乳杆菌(L.plantarum),这与R-1生理生化鉴定结果一致。
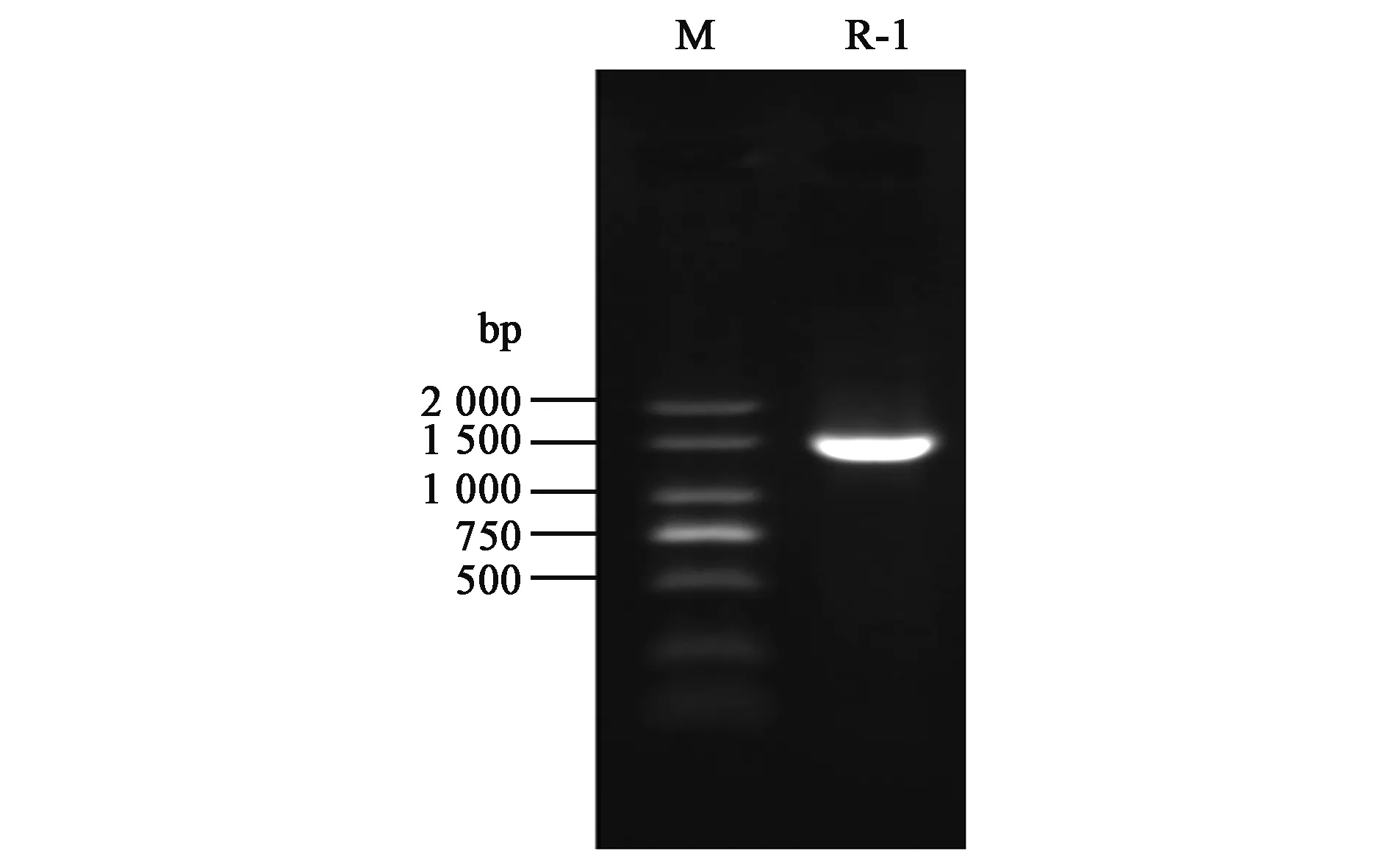
图6 菌株R-1的16S rRNA基因PCR扩增结果Fig.6 PCR-amplified results of 16S rRNA gene from R-1.
2.5 人工接种乳酸菌R-1的模拟腊肉发酵试验
在传统的陇西腊肉制作工艺的基础上,对原料肉进行乳酸菌R-1的人工喷涂,获得成品肉后,由专业人员进行感官评定。由图8可知,接种菌株R-1后,与对照组相比,接种菌株的成品腊肉除口感和色泽外,其他感官品质指标如气味、滋味、组织结构和整体可接受性均显著高于未接种菌株的腊肉(P<0.05)。接种菌株的腊肉在保持了陇西腊肉原有的风味、酸味纯正等优良品质的基础上,有效降低了因脂肪降解为游离脂肪酸而造成的产品酸败的发生,同时改善了传统腊肉制作工艺下某些乳酸菌通过异型乳酸发酵产气造成的腊肉结构松散的问题,证明接种菌株R-1可使陇西腊肉的品质得到提升。

图7 菌株R-1的系统发育树Fig.7 Phylogenetic tree of strain R-1.

图8 陇西腊肉模拟腊肉发酵试验感官评价结果Fig.8 Sensory evaluation results of the simulated Longxi bacon fermentation test.
3 讨论
乳酸菌是传统发酵肉制品中重要的优势菌群,在自然发酵过程中占重要地位,与产品的品质有着密切的关联。如白琴琴等[34]从3种不同发酵肉制品中筛选出的优势乳酸菌为乳酸片球菌(Pediococcusacidilactici)、植物乳杆菌(Lactobacillusplantarum)和发酵乳杆菌(L.fermentum)。而从腊鱼和腊肠中筛选出的具有潜在应用价值的乳酸菌分别为米酒乳杆菌(L.sake)、植物乳杆菌(L.plantarum)、干酪乳杆菌(L.casei)及鼠李糖乳杆菌(L.rhamnosus)[35]。本研究从陇西腊肉中分离出了7株优势乳酸菌菌株,结合形态学特征和生理生化特性分别鉴定为植物乳杆菌(L.plantarum)、米酒乳杆菌(L.sake)、乳酸乳球菌(Lactococcuslactis)、戊糖片球菌(Pediococcuspentosaceus)、肠膜明串珠菌(Leuconostocmesenteroides)、食品乳杆菌(L.alimentarius)和弯曲乳杆菌(L.curvatus)。
肉制品的发酵一般采用2种方式:一种是自然发酵,另一种是人工辅助接种发酵。目前,陇西腊肉采用在自然条件下发酵,这种粗放式的生产工艺使得陇西腊肉存在生产周期过长、品质不可控等问题。筛选发酵性能优良的乳酸菌作为陇西腊肉的辅助发酵剂菌株,可为产品风味的改善和腊肉安全性的提高奠定基础。因此,从陇西腊肉中分离出的7株优势乳酸菌菌株经一系列发酵性能测试,筛选得到1株发酵性能优良,经鉴定为植物乳杆菌(L.plantarum)。该菌株生长性能良好,产酸能力强,在6% NaCl和150 mg/kg NaNO2环境下均具有较好的耐受性,不产气、不产黏液,对蛋白质、脂肪均无分解作用,这些特性均有利于改善发酵肉制品的品质。这与刘有晴等[36]对四川腊肉中乳酸菌的筛选、产酸特性分析结果一致。而且,在陇西腊肉加工过程中接种植物乳杆菌(L.plantarum)R-1的试验结果也证实了其能够改善产品风味,使成品表现出更好的感官可接受性。因此,菌株R-1具有可开发为陇西腊肉辅助发酵菌剂的潜质,可为陇西腊肉乃至传统腌腊肉制品发酵剂的研制提供一定的理论依据。但关于该菌株在其他传统腌腊肉制品中的应用及与其他菌种结合开发复配发酵剂,还有待于进一步研究。
