国产硬脂酸红霉素口服固体制剂质量分析
2019-03-29傅蓉刘杨易大为孙苓苓张亚杰
傅蓉 刘杨 易大为 孙苓苓 张亚杰
(辽宁省药品检验检测院,沈阳 110036)
硬脂酸红霉素(erythromycin stearate)为第一代大环内酯类抗菌药,是红霉素的硬脂酸盐,其合成工艺为红霉素盐基在丙酮(或95%乙醇)溶液中和过量的硬脂酸反应,再加水沉淀得到不溶性的盐。片剂由美国Arbor Pharmaceuticals LLC公司生产研制,目前国内已有3家原料药和36家制剂生产企业。未列入国家基本药物。本品系抑菌剂,在高浓度时对某些细菌也具杀菌作用,但仅对分裂活跃的细菌有效。主要机理为:透过细菌细胞膜,与细菌核糖体的50S亚基成可逆性结合,从而使细菌蛋白质合成受抑制。硬脂酸红霉素片(胶囊、颗粒)是2018年国家药品抽验品种。本文通过对上市硬脂酸红霉素片(胶囊、颗粒)的标准检验与探索性研究,从安全性、有效性和质量可控性等方面对其进行全面质量分析评价。
1 材料与方法
1.1 药品
据国家食品药品监督管理总局网站数据库检索,硬脂酸红霉素片的国内生产企业共28家,批准文号49个;硬脂酸红霉素胶囊的国内生产企业共7家,批准文号8个;硬脂酸红霉素颗粒的国内生产企业共1家,批准文号1个。本次抽验从全国20个省(直辖市、自治区)共抽到59批次样品,其中片剂11批,涉及1个生产企业;胶囊剂15批,涉及2个生产企业;颗粒剂33批,涉及1个生产企业。59批样品抽样环节统计分别为生产企业1.7%,经营单位39.0%,医疗机构59.3%。本次抽取硬脂酸红霉素片的规格为0.125g;硬脂酸红霉素胶囊的规格为0.1g和0.125g;硬脂酸红霉素颗粒的规格为50mg。1家硬脂酸红霉素原料药生产企业提供3批原料药。
1.2 对照品
红霉素对照品(以红霉素计含量为93.3%,批号:130307-201417),红霉素系统适用性对照品(批号:130670-201501),购自中国食品药品检定研究院;红霉素A(纯度:96.7%,批号:E130500)为欧洲药典标准物质;红霉素B(纯度:98%,批号:R05250),红霉素C(纯度:97%,批号:F4L354),N-去甲基红霉素A(杂质B,批号:H0L401)为美国药典标准物质;脱水红霉素A(杂质D,批号:3-GAB-37-1),红霉素F(杂质A,批号:IHMS-FCP-20170812-07),红霉素E(杂质C,批号:IHMS-ECP-20170823-01),红霉素A烯醇醚(杂质E,批号:6-GAC-65-1),伪红霉素A烯醇醚(杂质F,批号:3-ZPK-76-1)来源于加拿大Toronto research chemical;硬脂酸(分析纯,批号:F20080821)国药集团化学试剂有限公司产品;棕榈酸(分析纯,批号:850726)北京化工厂产品。
1.3 试药和试剂
乙腈、甲醇为色谱纯,美国天地公司产品;磷酸氢二钾、磷酸、乙酸铵为分析纯,国药集团化学试剂有限公司产品。
1.4 仪器
Waters 2695_2480系列高效液相色谱仪;Shimadzu液相色谱系统,LC-20A,SIL-20A,CTO-20A,SPD-20A,LC solution色谱工作站;Waters G2 Q-TOF飞行时间质谱;Mettler XP-205电子分析天平;Waters XBridge C18柱(250mm×4.6mm, 5μm);Waters XTerra RP C18柱(4.6mm×250mm, 3.5μm);Phenomenex Gemini C18柱(4.6mm×250mm, 5μm)。
1.5 法定检验方法
按照ChP 2015二部进行法定检验。
1.6 探索性研究方法
根据专题调研、文献检索和标准检验结果及分析等情况,开展了组分及有关物质、溶出度检查等研究。
1.6.1 有关物质
参考ChP2015红霉素项下组分及有关物质检查液相色谱条件,对4家生产企业59批抽检样品、及3批原料药的组分及有关物质进行考察,研究杂质来源,对结果进行评价。两种方法色谱条件见表1。
1.6.2 溶出度
参考ChP2015、美国药典40版(以下简称USP40)、BP2017标准,溶出度检查法,进行溶出条件和测定方法的筛选和确认。分别考察不同溶出方法,不同溶出介质,不同转速及不同测定方法对测定结果的影响。采用新建立的溶出度检查方法,对19批样品溶出度进行测定。国内外标准及新修订标准溶出度检查条件见表2。
2 结果
2.1 法定检验结果及分析
硬脂酸红霉素片(胶囊、颗粒)现行法定标准为ChP2015二部,片剂检验项目包括:性状、鉴别、红霉素B、C组分及有关物质、溶出度、重量差异、含量测定;胶囊剂检验项目包括:鉴别、红霉素B、C组分及有关物质、溶出度、重量差异、水分、含量测定;颗粒剂检验项目包括:性状、鉴别、红霉素B、C组分及有关物质、酸碱度、干燥失重、装量差异、含量测定。对全部样品按法定标准检验, 59批次样品有51批次结果符合规定,合格率86.4%;有8批次结果不符合规定,不合格率13.6%,不合格项目为水分和(或)溶出度检查项。法定检验性状及定量指标结果见表3,对与产品质量密切相关的主要定量检查项目如有关物质、水分(干燥失重)、溶出度和含量测定等结果进行统计分析如下。
2.1.1 组分和有关物质
按法定标准检验,11批硬脂酸红霉素片的红霉素B、C组分分别在0.8%~1.0%、0.3%~1.9%之间;杂质I、烯醇醚、单个杂质分别在0.02%~0.06%、未检出~0.4%、0.7%~1.1%之间;杂质总量分布在1.0%~3.3%的范围内,均符合规定,合格率100%。11批片剂样品均为A厂产品,对样品杂质测定结果进行统计分析,结果显示,红霉素B、杂质I、其他杂质总量的测定结果比较集中,红霉素C、红霉素A烯醇醚、其他单个杂质各有1批次的检测数据离群,但这些离群数据均低于群数据的中间值。硬脂酸红霉素片组分及有关物质各批次样品数据相对比较较集中,生产工艺控制较好。

表1 色谱条件比较Tab.1 Comparison table of chromatographic condition

表2 溶出度检查方法比较Tab.2 Comparison of the method of dissolution
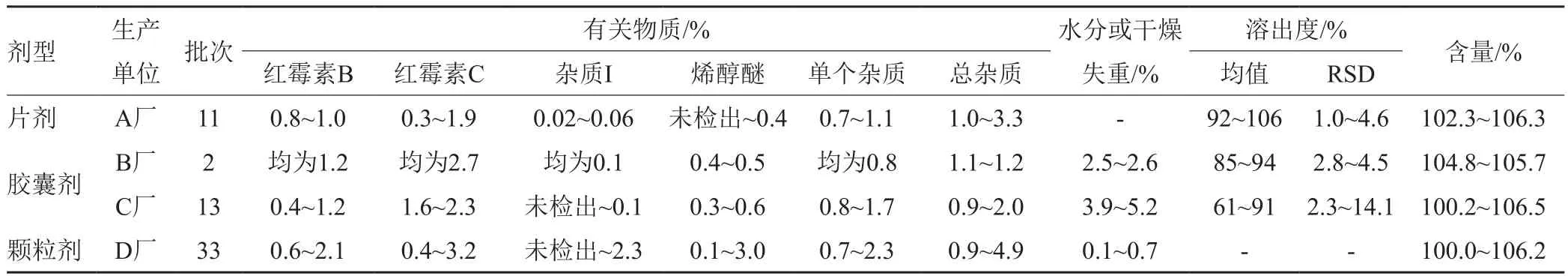
表3 硬脂酸红霉素片(胶囊、颗粒)法定检验定量指标结果Tab.3 Statutory inspection indexes of erythromycin stearate tablets (capsules and granules)
15批硬脂酸红霉素胶囊的红霉素B、C组分分别在0.4%~1.2%、1.6%~2.7%之间;杂质I、烯醇醚、单个杂质分别在未检出~0.1%、0.3%~0.6%、0.8%~1.7%之间;杂质总量分布在0.9%~2.0%的范围内,均符合规定,合格率100%。其中2批样品为B厂生产,其余13批为C厂生产,对C厂生产的13批样品杂质测定结果进行统计分析,结果显示,各批次产品组分及有关物质的检测结果均低于限度值,红霉素C、单个杂质和其他杂质和项有向上离群数据,提示这些批次样品中组分和杂质含量较大,偏离中心值较高。但总体来看,该厂家各批次产品数据较集中,组分及有关物质在可控范围内。
33批硬脂酸红霉素颗粒的红霉素B、C组分分别在0.6%~2.1%、0.4%~3.2%之间;杂质I、烯醇醚、单个杂质分别在未检出~2.3%、0.1%~3.0%、0.7%~2.3%之间;杂质总量分布在0.9%~4.9%的范围内,均符合规定,合格率100%。33批样品均为C厂产品,对样品杂质测定结果进行统计分析。结果显示,样品各组分及有关物质的检测结果均低于限度值,但杂质I、红霉素烯醇醚以及其他单个杂质均有向上离群数据。颗粒剂的杂质水平较片剂、胶囊剂大。硬脂酸红霉素口服固体制剂组分及有关物质典型色谱图见图1。
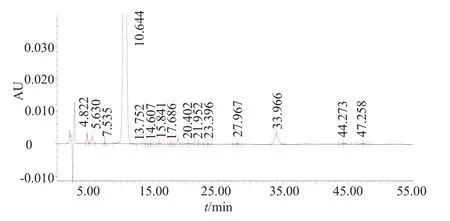
图1 硬脂酸红霉素口服固体制剂组分及有关物质典型色谱图Fig.1 Components and related substances chromatogram of erythromycin stearate for oral solid preparations
由前期调研可知,目前国内硬脂酸红霉素只有1家原料药生产企业还在生产,此次国家药品抽验工作抽到的制剂样品所用的原料,以及探索性研究所用的原料药,均来自该企业,但生产批号不同。硬脂酸红霉素起始原料为红霉素,红霉素A、B、C 3个组分是发酵菌种决定的,在硬脂酸红霉素中变化应不大。从原料药生产企业提供的材料看,起始原料红霉素也是该企业自己发酵生产的。统计片剂、胶囊剂和颗粒剂企业的红霉素B、C组分的测定结果,红霉素B组分总体在0.4%~2.1%之间,红霉素C组分在0.3%~3.2%之间,对结果进行统计分析,红霉素B组分均值为1.04,红霉素C组分均值为2.12,二者均基本呈正态分布,原料药生产工艺较稳定。
从测定结果看,颗粒剂的杂质水平总体较片剂、胶囊剂大,尤其是烯醇醚杂质。有研究表明烯醇醚是工艺的降解杂质,在颗粒剂中变异最大,提示与其制剂工艺控制有关,颗粒剂企业应关注生产工艺,控制烯醇醚产生的关键步骤。
2.1.2 水分或干燥失重
硬脂酸红霉素片,现行法定标准无水分检查项。硬脂酸红霉素胶囊,15批样品水分测定结果分布在2.5%~5.2%的范围内。现行标准规定,水分限度值为不得过4.0%,有8批次不符合规定,不合格率53.3%,不合格样品均为C厂产品。对C厂13批样品水分测定结果进行统计分析,测定结果比较集中,离散程度较小,但中值为4.2%,已经超出限度值。分析水分不合格原因,主要因素为处方影响,次要因素为样品运输及贮存环境控制不好。除不合格批次外,C厂其余5批次水分测定结果也都是处于“边缘合格”。该厂产品处方中含有几种具有较强引湿性的辅料,在样品运输及贮存过程中未严格控制环境条件,易造成样品吸水,可能导致产品水分超限。此外,通过SPSS软件分析胶囊剂水分与有关物质相关性,结果表明水分与杂质I、烯醇醚、单杂及总杂均无明显相关性。即水分大的样品,有关物质未见明显增加。
硬酯酸红霉素颗粒,33批样品干燥失重测定结果分布在0.1%~0.7%的范围内。现行标准规定,减失重量不得过2.0%,结果均符合规定,合格率100%。对33批样品进行频数分布图分析,减失重量均值为0.43%,最小值为0.1%,最大值为0.7%,69.7%的样品减失重量为0.4%~0.6%。干燥失重结果的频数分布图基本呈正态分布,该项目限度设置合理。
2.1.3 溶出度
硬脂酸红霉素片,11批样品按法定标准检验溶出度,结果全部符合规定,合格率为100%。以每批样品的平均溶出量为变量,对11批样品溶出度结果统计分析,结果表明,所有抽样批次平均溶出量均值为96%,最小值为92%,最大值为106%,全部样品平均溶出量大于90%,测定结果基本呈正态分布,各批次产品数据较集中,批间差异不大;以每批6片样品的溶出量RSD为变量,进行统计分析,RSD结果在1.09%~4.8%范围内,均小于5%。总体上看,各批次批内差异较小。按法定标准检验,硬脂酸红霉素片总体溶出情况较好,产品工艺较稳定。
硬脂酸红霉素胶囊,15批样品按法定标准检验溶出度,结果有11批符合规定,合格率为73.3%;4批不符合规定,不合格率为26.7%,不合格样品均为C厂产品。以每批样品的平均溶出量为变量,对15批样品频数分布图分析。结果表明,平均溶出量均值为80%,最小值为61%,最大值为94%,由检验结果看,按法定标准检验,硬脂酸红霉素胶囊总体溶出情况较差。以每批6粒样品的溶出量RSD为变量,对15批样品进行频数分布图分析,RSD结果在2.3%~14.1%范围内。其中,6粒溶出量RSD结果在5%以上的占比73.3%,且均来自于C厂。进一步对C厂13批样品溶出度测定结果进行统计分析,测定结果在61%~91%范围内,数据结果差异较大,提示各批次样品批间差异大。分析溶出度不合格原因,主要因素为处方影响,次要因素为工艺影响。辅料种类和配比的不当,可能导致药物在溶出条件下不能有效崩解释放。检验过程中发现,该企业样品囊壳溶解后,胶囊内容物在转篮内呈块状且不分散,导致样品不能有效崩解释放,样品溶出不完全。鉴于该厂产品处方中含有几种具有较强引湿性的辅料,提示C厂产品批内和批间差异较大,可能与其在生产过程中对工艺等细节控制不够有关。
硬脂酸红霉素颗粒,现行法定标准中无溶出度检查项。
2.1.4 含量测定
硬脂酸红霉素片,依据现行标准对11批样品进行检验,均符合规定,合格率为100%。以每批样品的含量为变量,对检验结果进行统计分析。11批样品的含量均值为103.65%,测定结果在102.3%~106.3%范围内,均在均值±2σ(100.9%~106.4%)范围内,离散程度较小,总体上看,各批次产品数据较集中。检测方法及限度制定较合理。
硬脂酸红霉素胶囊,依据现行标准对15批样品进行检验,均符合规定,合格率为100%。以每批样品的含量为变量,对检验结果进行统计分析。15批样品的含量均值为104.28%,含量的测定结果在102.3%~106.3%范围内,均在均值±2σ(100.1%~107.5%)范围内,离散程度较小,总体上看,各批次产品数据较集中。检测方法及限度制定合理。
硬脂酸红霉素颗粒,依据现行标准对33批样品进行检验,均符合规定,合格率为100%。以每批样品的含量为变量,对检验结果进行统计分析。33批样品的含量均值为103.21%,含量的测定结果在100.0%~106.2%范围内,均在均值±2σ(100.0%~106.2%)范围内,离散程度较小,总体上看,各批次产品数据较集中。检测方法及限度制定合理。
2.2 探索性研究结果及分析
2.2.1 组分及有关物质
新修订组分和有关物质测定方法与现行标准差别较大,方法学研究和样品的检测结果表明,新修订方法较现行标准方法分离并检出的已知杂质更多,检测灵敏度更高,适用性更好。现行标准原料药控制红霉素A、B、C组分、伪红霉素A烯醇醚、红霉素A烯醇醚、其他单个杂质和其他杂质和,共7项;制剂控制红霉素B、C组分、伪红霉素A烯醇醚、红霉素A烯醇醚、其他单个杂质和其他杂质和,共6项。新方法原料控制红霉素A、B、C组分,杂质A~D、伪红霉素A烯醇醚、红霉素A烯醇醚、其他单个杂质和其他杂质和,共11项;制剂控制红霉素A、B、C组分,杂质A~D、伪红霉素A烯醇醚、红霉素A烯醇醚、其他单个杂质,共10项。典型色谱图见图2。该图为按新修订检验硬脂酸红霉素组分及有关物质系统适用性典型色谱图。
从破坏性试验的结果显示,本品制剂对酸、碱、加热和氧化条件均较为敏感,提示该品种在生产、销售、储运环节,均应注意避免接触上述不利因素,保证药品质量。
2.2.2 溶出度
前期标准比对发现,USP、BP与ChP溶出度测定方法差别较大,具体见表2。而现行标准中,溶出度检查方法存在一定缺陷,主要表现为:硬脂酸红霉素胶囊采用篮法,在检测过程中发现,部分厂家样品,胶囊壳溶解后,内容物易堵塞篮网孔,造成崩解释放不完全,导致溶出量较低;测定方法为硫酸显色法,方法灵敏度不高、专属性不强;此外,硬脂酸红霉素颗粒无溶出度检查项。为此,对硬脂酸红霉素制剂溶出度检查方法进行考察研究,建立新的溶出度检查方法。以pH6.0磷酸盐缓冲液为溶出介质,采用桨法,测定方法选用灵敏度专属性更强的HPLC方法,采用标准品,按外标法以红霉素A组分计算溶出量。
采用该方法对4个厂家、19批次(其中片剂4批、胶囊剂7批,颗粒剂8批)样品进行溶出度测定,进一步评价硬脂酸红霉素制剂质量。以75%为限度,按新修订方法检验,19批样品溶出度均符合规定。
其中片剂和胶囊剂两种方法测定结果对比见表4。测定结果经SPSS统计分析软件进行配对t检验,硬脂酸红霉素片P=0.242>0.05,认为两种方法不存在显著性差异。硬脂酸红霉素胶囊P=0.971>0.05,认为两种方法也不存在显著性差异。两种方法6粒溶出量RSD结果相当,其中C厂生产的硬脂酸红霉素胶囊按新修订方法测定,6粒溶出量RSD结果偏大,提示样品批内差异较大,和ChP2015方法测定结果一致。
3 讨论
本次国家药品抽验采取了法定检验结合探索性研究模式对国产硬脂酸红霉素制剂,从标准到质量的现状、质量影响因素各方面进行了较全面的分析和评价。由法定检验可知4个生产企业59批样品按现行标准检验,合格率为86.4%,不合格样品为C厂胶囊剂,不合格项目为水分和(或)溶出度。按法定标准检验目前国内硬脂酸红霉素制剂的处方和生产工艺有待进一步优化和提高,总体质量情况一般,质量标准有待提高。
修订了组分和有关物质检查项,两种方法比较,新修订方法分离并检出的已知杂质更多,检测灵敏度更高,适用性更好,能够更好地从安全性方面控制产品质量。
修订了片剂(胶囊剂)溶出度检查方法,增加了颗粒剂溶出度测定方法,能够更好地从有效性方面控制产品质量。比较两种方法,主要不同点为:所用溶出介质不同(法定标准采用0.1mol/L盐酸溶液;新修订标准采用pH6.0磷酸盐缓冲液),溶出方法不同(法定标准采用篮法;新修订标准采用桨法),测定方法不同(法定标准采用硫酸显色、紫外测定;新修订标准采用HPLC法)。相比于法定标准,新修订标准能相对合理地模拟药物在体内释放吸收过程,测定方法准确度和专属性也较强。
4 存在主要问题及建议
4.1 批准文号闲置问题
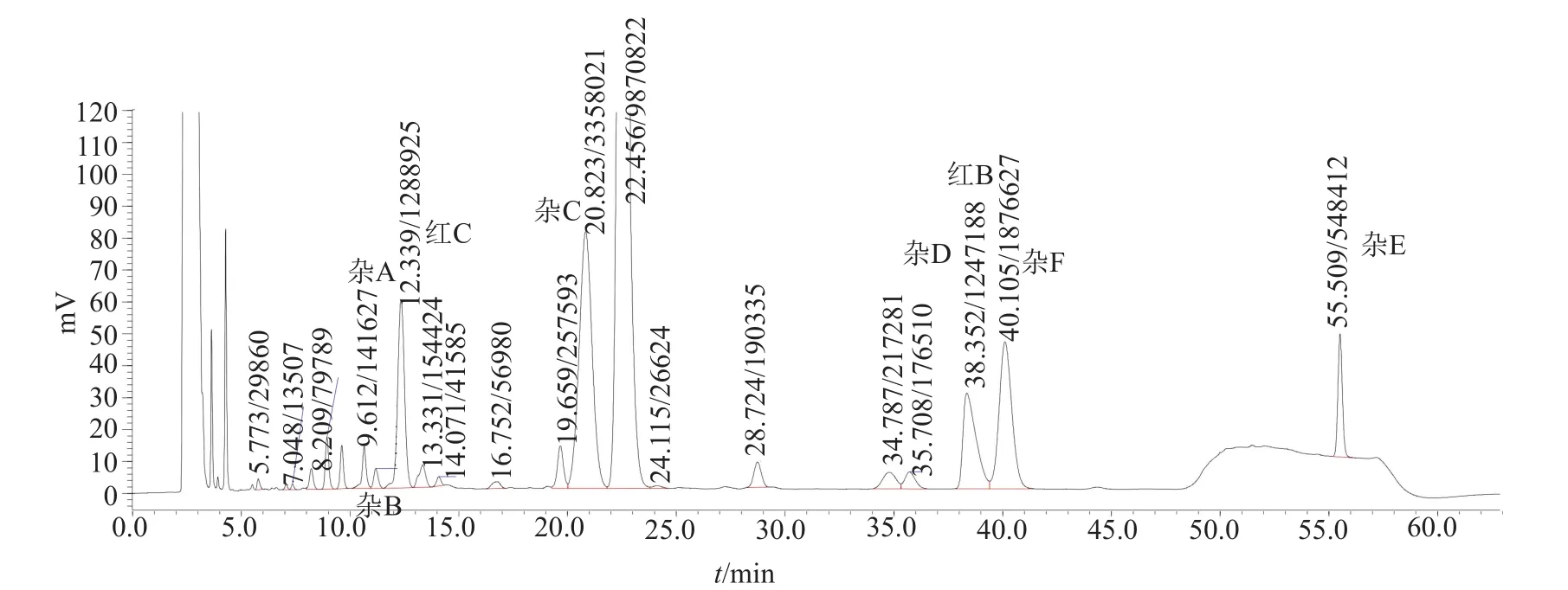
图2 按新修订检验硬脂酸红霉素组分及有关物质系统适用性典型色谱图Fig.2 Components and related substances chromatogram of erythromycin stearate
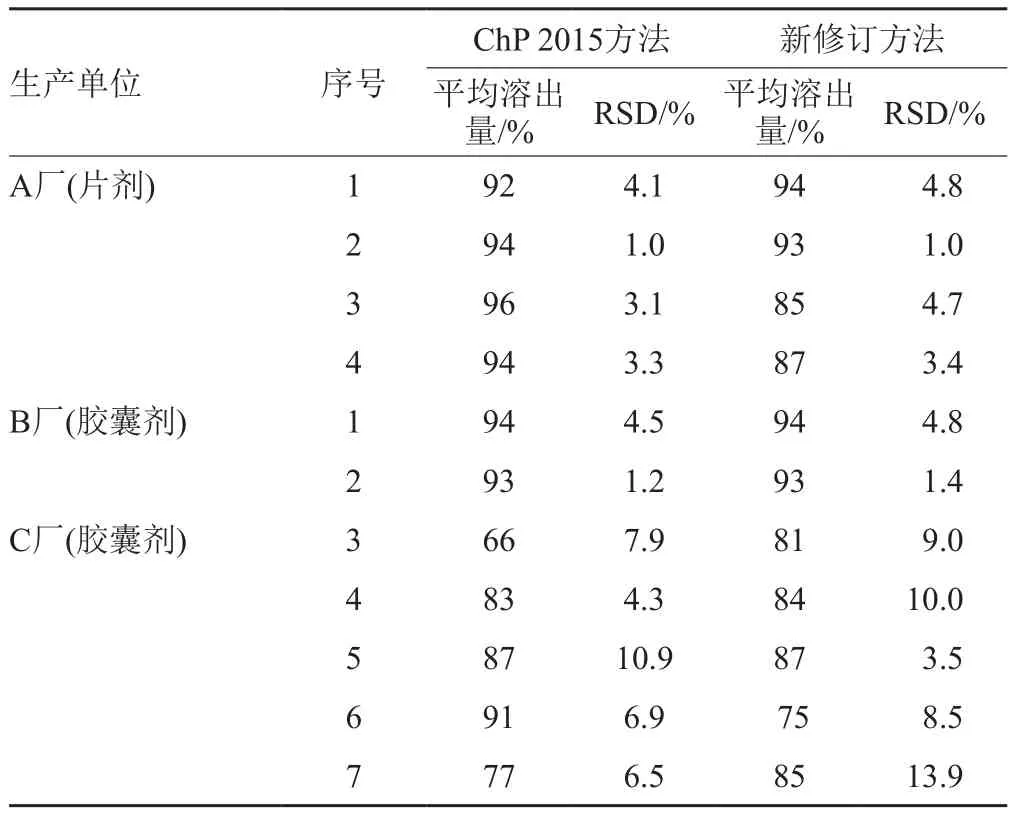
表4 片剂和胶囊剂两种方法测定溶出度结果对比Tab.4 Result of dissultion of erythromycin stearate tablets and capsules by 2 methods
此次抽取的硬脂酸红霉素制剂共计59批,共涉及4个生产企业和5个批准文号。抽样涉及的生产企业数占总生产企业数的11.1%,抽样涉及批准文号数占总批准文号数的8.6%。这与我们前期调研的情况相吻合,大部分生产企业近3年未生产该品种,硬脂酸红霉素制剂目前在市场占有率较低,获取批准文号的生产企业中仅有少数的企业仍在生产,且产量正逐年降低或准备停产。这可能存在一些临时生产的质量隐患。建议为防止生产企业临时生产带来的质量隐患,建议监管部门对闲置批准文号加强整顿。
4.2 处方工艺合理性问题
硬脂酸红霉素在体内吸收部位主要应在小肠,一般情况下,人体在空腹状态下,十二指肠pH环境大约在5.5左右,小肠大约为6.0,小肠末端大约6.8。虽然通常认为红霉素的衍生物(琥乙红霉素、硬脂酸红霉素等)较红霉素对酸稳定,但前期查阅文献[5]可知,硬脂酸红霉素易受胃酸破坏;在酸碱破坏试验中也发现,硬脂酸红霉素在酸中不稳定,降解杂质较多,因此如何通过合理的剂型设计,保证该类药物的有效性有待于进一步的研究。
4.3 现行标准问题
按标准检验结果分析表明,胶囊剂的水分与有关物质及溶出度无明显相关性,建议进一步收集样品,探讨胶囊剂水分限度的合理性。
