斑节对虾性腺组织、细胞的原代培养条件优化
2019-03-29朱丹丹江世贵黄建华周发林杨其彬杨丽诗
朱丹丹,江世贵,黄建华,周发林,杨其彬,姜 松,杨丽诗
( 1.中国水产科学研究院 南海水产研究所,农业农村部南海渔业资源开发利用重点试验室,广东 广州 510300; 2.上海海洋大学 水产与生命学院,上海 201306; 3.中国水产科学研究院 南海水产研究所 深圳试验基地,广东 深圳 518108 )
斑节对虾(Penaeusmonodon),属节肢动物门、甲壳动物亚门、十足目、枝鳃亚目、对虾科、对虾属,是对虾属中的最大型种。斑节对虾的人工繁育过程一直以人工授精为主,但此方法会受到多种外界因素的影响,导致受精成功率及受精卵质量下降,因此目前针对斑节对虾性腺成熟规律的研究已成为人工繁育技术创新的重要突破口。
尽管对甲壳动物的性腺成熟过程的研究已较多[1-4],并且在人类、果蝇等模式生物成熟细胞系的水平上也进行了较为深入的研究[5-6],但因为对虾成熟细胞系的缺失,诸多结论无法在对虾的细胞水平上进行验证,因此如果能建立起斑节对虾的性腺组织成熟细胞系,将有助于对斑节对虾性腺成熟调控机制的探索和验证。
迄今为止,有不少国内外专家学者对对虾组织细胞体外培养进行了研究和探索,如Chen等[7]首次进行了斑节对虾卵巢组织的原代培养,并且成功传至3代;胡珂等[8]对中国明对虾(Fenneropenaeuschinensis)肝胰腺组织进行离体培养,传代至28代;Luedeman等[9]使用了10种培养基配方对蓝对虾(Penaeusstylirostris)和凡纳滨对虾(Litopenaeusvannamei)的卵巢组织进行了培养;Hsu等[10]利用碱性成纤维细胞生长因子等使淋巴器官的细胞传至90代,并建立了有限细胞系;王立平等[11]将中国明对虾甲壳下上皮组织细胞传代至25代。经分析发现,即便是针对同一种对虾,报道的培养条件也不同,无法确定体外组织细胞存活所需的最适条件,原代培养的成功率也较低,永生性的细胞株一直未能建立,但已有一些利用培养出的离体组织进行相关机制研究的报道,如李国鹏[12]证实,MAPK信号通路在原代培养斑马鱼(Daniorerio)卵母细胞的成熟过程中起到了关键作用;Jose等[13]以原代培养的斑节对虾淋巴组织为基础,探究了白斑综合征病毒与细胞的作用关系及相关免疫基因的表达情况;韩萍等[14]利用斑节对虾卵巢组织的离体培养初步探究了多种促性腺激素释放激素对卵母细胞的影响。笔者在前人研究的基础上,为更进一步了解不同培养方法和不同培养基配方对斑节对虾离体组织和细胞的生长、形态、活力及基因表达的影响,通过比较在3种改良培养基和2种处理方法(酶解法和机械分离法)下的细胞生长情况、活力变化规律以及原代培养状态下MAPK信号通路相关基因的表达变化情况,对培养过程中细胞和基因的变化规律进行探索,以期对斑节对虾性腺组织和细胞的原代培养过程进行初步优化,从而通过提高性腺细胞存活率,建立成熟高效的原代组织及细胞培养体系,为建立斑节对虾原代细胞研究平台提供支持数据。
1 材料与方法
1.1 试验动物
斑节对虾取自中国水产科学研究院南海水产研究所深圳试验基地,充氧运回广州实验室,雌虾3尾,体质量30~50 g,雄虾2尾,体质量20~30 g,体色正常、健康有活力,用充分曝气的自来水和海水晶配制人工海水,盐度15,水温(20±3) ℃,连续充气暂养1 d[15]。
1.2 组织培养材料
1.2.1 培养基
取1包Leibovitz′s L-15培养基粉末(Invitrogen),加入500 mL电阻率为18.2 MΩ·cm超纯水(Millipore公司),配置成2×L-15培养基母液,经0.45 μm滤膜过滤后高压灭菌备用。
以2×L-15培养基为基础培养基,通过添加15%胎牛血清(Invitrogen)及相应无机盐溶液配置出3种试验培养基,调节pH为7.2,具体培养基配方见表1。
1.2.2 其他培养用溶液
100×PSN(三抗,Gibco),胎牛血清(Gibco),0.25%胰蛋白酶(Trypsin-EDTA,Gibco);配制7.5 g/L NaCl,5 g/L NaCl,1 g/L 葡萄糖,0.32 g/L KCl,1.02 g/L MgCl2,0.49 g/L MgSO4,2 g/L CaCl2溶液,均使用18.2 MΩ·cm的超纯水配置,充分溶解后经0.45 μm滤膜过滤,高压灭菌备用。

表1 培养基配方
1.3 试验方法
将斑节对虾先用0.1%高锰酸钾溶液充氧浸泡20 min,再用70%乙醇对体表进行2次消毒,最后用含1% PSN的Dulbecco磷酸盐缓冲液(Gibco)冲洗2~3次。取出卵巢(侧叶部分)及精巢组织,将性腺组织在75%乙醇中快速漂洗1次,然后转移至无菌Dulbecco磷酸盐缓冲液中漂洗至少2次,用眼科剪剪碎成约1 mm3的组织小块,根据以下处理方法分为2组:
(1)机械分离组:用巴斯德吸管进行机械吹打, 使组织块分散成游离细胞团,之后均匀接种在加入不同完全培养基的96孔板中。
(2)酶解组:使用0.1%胰蛋白酶(由含有1%PSN的Dulbecco磷酸盐缓冲液稀释)在室温黑暗的环境下消化组织块10~20 min后终止酶解反应,经过80孔目的细胞筛多次过滤后加入完全培养液,吹打均匀后接种在加入不同完全培养基的96孔板中。
每个处理分别设置3个试验组,每个试验组均设置3个平行。之后将培养板置于28 ℃恒温培养箱中,过夜培养后观察并更换培养基,之后每2 d更换50%培养液。
1.4 试验样品采集与处理
每隔24 h观察、记录细胞生长情况。分别在接种24、72、120 h后取出部分样品进行苏木精—伊红染色切片的制作、细胞活力的检测以及基因表达定量试验cDNA模板的制作。
(1)苏木精—伊红染色切片制备:将取出的部分卵巢或精巢组织小块置于波恩氏固定液中固定过夜,经流水冲洗及70%~100%梯度酒精脱水后,使用1∶1乙醇二甲苯透明,经过浸蜡包埋后过夜放置,进行连续切片,切片厚4 μm,取其中一张切片进行苏木精—伊红染色。
(2)细胞活力检测:按照全式金公司的TransDetect® Cell Counting Kit 说明书,用培养液配成单个细胞悬液,用血球计数板进行细胞计数,在96孔板中接种100 μL细胞悬液,每孔细胞数量在2×103个,置于37 ℃恒温培养箱中培养24 h,之后每孔加CCK溶液10 μL,孵育4 h后终止培养。5000 r/min离心5 min,吸取孔内培养上清液。使用酶标仪测量450 nm处的吸光值并记录结果。
(3)基因表达定量:按照Megan公司HiPure Total RNA Plus Kits试剂盒(No.R4122)提取斑节对虾性腺细胞培养各时间点样品的总RNA,提取的总RNA经琼脂糖凝胶电泳确定其完整度,经分光光度计测定含量及纯度。使用上海宝生物公司的PrimeScript RT reagent Kit with gDNA Eraser逆转录试剂盒(No.RR047)将1 μg RNA逆转录为荧光定量PCR的模板。在Roche Lightcycler 480荧光定量PCR仪(Roche,USA)中进行荧光定量PCR反应。反应程序设计为:95 ℃预变性40 s;95 ℃变性 5 s,60 ℃退火20 s,共进行40个循环。每个组分别设置3个重复。扩增EF-1α作为内参,其他基因的定量引物设计见表2。
1.5 数据处理
试验数据采用相对ΔCt法 (2-ΔΔCt法)计算各组样品中的相对表达量,显著性检验利用SPSS 19.0软件进行,采用单因素方差分析和多重比较分析数据,P<0.05为差异显著。

表2 试验中所用引物序列
2 结果及分析
2.1 受试样品发育分期确定
参照文献[14,18-19]的方法对斑节对虾性腺分期情况进行判定。所解剖的斑节对虾卵巢组织呈嫩黄色,组织切片显示,卵巢内含有大量处于核染色质期或核仁周期的卵原细胞和初级卵母细胞致密排列(图1),符合卵黄发生前期的形态特征,判定本试验用雌虾卵巢处于Ⅱ期。同时所解剖的斑节对虾精巢组织呈白色,组织切片可见4种类型的细胞(图2),精原细胞、初级精母细胞、次级精母细胞、精子细胞较致密排列,据此判定本试验用雄虾精巢处于成熟期。

图1 卵巢Ⅱ期切片a~c依次为放大10倍,200倍及400倍; Oo.卵原细胞,Po.初级卵母细胞.
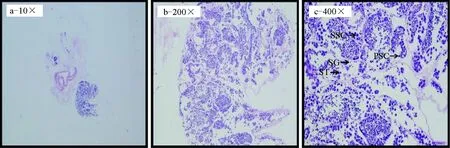
图2 精巢切片a~c依次为放大10倍,200倍及400倍;SG.精原细胞,PSC.初级精原细胞,SSC.次级精原细胞,ST.精子细胞.
2.2 不同培养基中的细胞形态观察及切片观察
2.2.1 酶解法样品的细胞形态观察
酶解后使用80目筛网进行过滤,除单个游离的卵巢细胞外,仍有部分细胞团悬浮。接种1 d后即可见细胞团的周围有大量细胞游离(图3a),2~3 d后可见部分细胞出现分裂相,随着细胞培养的继续,到第5 d时,部分组织块开始松散,出现细胞破裂、数量减少,1号和2号培养基的情况相对较好。
精巢组织酶解后可见大量分散的细胞,2~3 d后细胞数量增多,细胞团减小,细胞出现贴壁生长的现象(图3b),部分精原细胞开始发生形态变化,细胞种类增多,到第5 d,细胞呈贴壁生长,但部分细胞出现破裂现象,其中1号和2号培养基中的细胞形态较为完整。
2.2.2 采用机械分离法处理的细胞形态观察
机械分离接种后24、72、120 h取组织块样品进行苏木精—伊红染色切片观察(图4)。0 h时可见卵原细胞致密排列,24 h时各组的细胞变化不大,出现少量的分裂相卵母细胞。72 h后各组出现较大变化,2号培养基少量细胞出现染色质固缩,1号培养基处理组有部分细胞出现染色质固缩的形态,卵母细胞排列开始变松散,3号培养基细胞破裂和凋亡较严重,卵母细胞减少,120 h时1、2号培养基染色质固缩的程度有一定加深,细胞加剧分散,但仍可见正常的卵母细胞,而3号培养基几乎看不到正常的卵母细胞,视野中为大量的亮蓝色浓集细胞核,细胞核碎片状,边集。直至第7 d时,2号培养基中培养的组织中仍有少数活细胞。
精巢的苏木精—伊红染色切片中可以看到,1号培养基和2号培养基中的组织在试验第5 d时仍然保持一定形态及细胞完整度,但3号培养基的组织形态完全消散(图5)。

图3 酶解法处理后的斑节对虾性腺细胞a.雌虾卵巢细胞,b.雄虾精巢细胞.

图4 雌虾卵巢组织苏木精—伊红染色切片a.1号培养基,b.2号培养基,c.3号培养基.下同.

图5 雄虾精巢组织苏木精—伊红染色切片
2.3 不同培养条件下中的细胞活力的变化
酶解法和机械分离法进行原代培养对卵母细胞和精原细胞活力的影响见图6。1号培养基细胞活力普遍高于另外2种培养基,其中3号培养基的细胞活力相对较低。在1号培养基处理下,酶解法和机械分离法对精原细胞活力影响不大,均在离体培养24 h时达到顶峰,72 h以后逐渐下降,而酶解法培养的卵母细胞活力均高于机械分离法,并在72 h后仍然具有较高活力;2号培养基条件下,酶解法和机械分离法对精原细胞活力影响相似,而酶解法的卵母细胞活力高于机械分离法,各组别在培养后0~72 h逐渐上升,在120 h后维持平衡;3号培养基条件下,酶解法的细胞活力显著高于机械分离法,0~72 h细胞活力逐渐升高,至72 h时达到最大值,随后下降,而机械分离法不能提高精原细胞的活力,更降低了卵母细胞活力。
2.4 不同培养条件下的MAPK信号通路相关基因的表达量变化
在原代细胞培养过程中,MAPK信号通路相关基因的表达均不同(图7)。雌虾中c-Mos基因表达量最高,分别比Ras、ERK、MEK1的表达量高约27倍、10倍、11倍,雄虾中也是如此,分别比Ras、ERK、MEK1的表达量高约17倍、21倍、25倍。


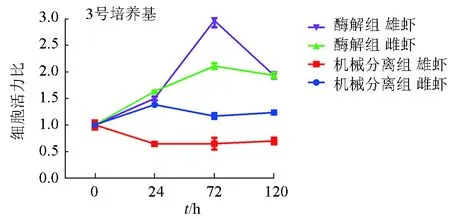
图6 雌雄虾在不同培养基中的细胞活力变化情况

图7 不同培养基中的雌、雄虾的MAPK信号通路相关基因表达量的变化情况
1号培养基中,雌虾的Ras基因的表达量在72 h时显著上调,120 h时显著下降,2、3号培养基中,72 h时显著上调,但低于1号培养条件下的表达量,随后在120 h时下降,但高于1号培养条件下该时间点的表达量;ERK基因的表达量在1号培养基中是逐渐上调的,在2号培养基中变化不大,在3号培养基中72 h时表达量最高,随后下调,且同时间点里3种培养基的表达量均差异显著(P<0.05);MEK1基因的表达量在1号和2号培养基中无显著变化,但在3号培养基中显著降低;c-Mos基因的表达量在不同培养基中表达变化趋势相似,即72 h时有所上调,120 h达到表达高峰,但1号、2号培养基中c-Mos基因的上调表达变化高于3号培养基中的表达量。
雄虾中的Ras基因在1号培养基中72 h时上调至最高,随后下降,而在2号和3号培养基中在72 h时下调至最低,随后略有上升,但均未达显著水平;ERK基因的表达量在1号培养基培养72 h后下降,120 h时显著下降,2号、3号培养基中也在72、120 h下降,但未达显著水平;MEK1基因在1号培养基培养72 h时上升,随后下降,在2、3号培养基培养72 h时下降,随后维持低水平或上升,但均未达显著水平。c-Mos基因在3种培养基中均是72 h下调后120 h显著上调,同时上调幅度依次为1号培养基>2号培养基>3号培养基。
3 讨 论
在过去的几十年中,很多研究团体和个人致力于建立持续的虾细胞系,但均未获得成功。斑节对虾的原代细胞培养已经在鳃[7]、淋巴组织[9]、卵巢[14]、心脏[16]、肝胰腺[17]等多种组织器官上进行了探索,获得了关于培养方法、培养基配方等方面的结论。本试验分别在机械分离法和酶解法条件下,采用3种改良型培养基培养斑节对虾性腺组织及细胞,以便探索不同培养方法和不同培养基下培养的组织、细胞的状态、活力及相关基因表达的变化。
3.1 不同培养方法下细胞的生长情况
目前动物组织细胞培养主要采用机械分离法和消化法。机械分离法是取所需组织用剪刀或手术刀剪切成 1 mm3的碎块,再经培养基或平衡盐溶液清洗后分散植入培养瓶,均匀接种于CO2培养箱中培养或密闭培养的过程[20]。如Chen等[7]使用机械分离的方法进行了斑节对虾淋巴器官原代细胞培养试验,而韩萍等[14]用组织培养法观察了促性腺激素释放激素对离体卵巢发育的影响。本试验结果发现,机械分离法可以成功进行体外精原和卵母细胞的培养,但在不同培养条件下差异较大。其中在1号培养基中,即仅有L-15培养基的情况下,机械分离的精原细胞活力较强,与酶解的差别不大,但3号培养基条件下对精原细胞的活力几乎没有影响。消化法是使用胰蛋白酶(含EDTA)、胶原酶或透明质酸酶对组织和细胞进行消化解离。其中,胰蛋白酶的作用是使细胞间的基质蛋白水解从而使细胞离散,但不同的组织或者细胞对胰蛋白酶的作用反应不一样。刘凯于等[16-17]的斑节对虾试验结果表明,胰蛋白酶的消化使肝胰腺、血淋巴等细胞无法在体外正常存活,或对这些细胞的结构产生较大损伤。使用胰蛋白酶处理日本囊对虾(Marsupenaeusjaponicus)淋巴组织细胞,即使在低含量、低温度、短作用时间下淋巴组织细胞也依然无法存活[21]。这说明对虾细胞对于胰蛋白酶的作用是高度敏感的。但张岩等[22]使用胰蛋白酶酶解的方法成功观察到了红螯螯虾(Cheraxquadricarinatus)XO-SG的单个神经细胞,这可能是因为神经中含有大量结缔组织,不易被胰蛋白酶酶解。
本试验利用胰蛋白酶分别酶解卵巢和精巢组织后发现,酶解后培养的精原细胞活力在3种不同培养基条件下均近于或高于机械分离方法。卵巢和精巢均具有少量结缔组织,被胰蛋白酶消化后使得原代性腺细胞团发生分散。
本研究结果表明,酶解法亦适用于对虾细胞培养,在特定培养条件下,比机械分离法效果更好。因此,酶解法与机械分离法应该根据具体试验进行选择,机械分离法易于操作,可以适用于对组织的影响变化试验,而酶解法适用于观察单个细胞的形态变化、蛋白定位等试验。
3.2 不同培养基中细胞的生长情况
目前对虾细胞培养主要还是采用改良的哺乳动物或昆虫细胞培养基,如MEM、RPMI、L-15、M199、Grace液等。其中L-15及M199已证明能很好地支持对虾细胞的生长。如Chen等[7]发现,L-15作为基本培养基培养的斑节对虾卵巢原代细胞可以进行3次传代,2×L-15培养基较1×L-15培养基的培养情况更为理想。韩萍等[14]也利用L-15作为基础培养基成功培养了离体斑节对虾卵巢组织。
本试验1号培养基直接使用2×L-15作为基本培养基,通过显微观察和切片观察发现,其对保持斑节对虾卵母细胞和精原细胞的形态维持和生长均具有促进作用。2号培养基添加了葡萄糖作为碳源,并添加一定含量的Na+来调控渗透压,对细胞生长有良好促进作用,细胞活力在0~72 h得到提高,并在120 h时仍保持较高的细胞活力水平,这提示,渗透压对原代培养的性腺细胞的生长和增殖具有重要意义。3号培养基在2号培养基的基础上又添加了K+、Mg2+、Ca2+离子,却对细胞生长无显著促进作用,相反,对细胞活力有一定的抑制作用。这与之前的报道相似,因此推测,由于斑节对虾属广盐性海洋甲壳类动物,长期适应环境中剧烈的渗透压变化,具有较强的离子调节功能,但离体培养时,培养基的渗透压通过简单地添加无机盐难以调节至虾体自身的渗透压,于是可能抑制了组织或细胞的生长,但有研究显示,若添加对虾自身的组织提取液或淋巴液及各类生长因子可以优化对虾细胞的生长情况,但对细胞生长、分裂均无明显的帮助[23-24]。
本试验的细胞培养结果显示,卵巢的组织团块和分散细胞在培养的5 d里,随着培养时间的增加,各培养基中的组织都开始出现破碎、变形的情况,但是2号培养基中相较于1、3号培养基,组织发生变化的速度较慢,直至第7 d时,组织中仍有少数活细胞(图4)。精巢的组织团块接种时就可见大量分散细胞分布在培养板上,2~3 d后细胞数量增多,组织块减小,细胞出现贴壁生长的现象,部分精原细胞开始发生形态变化,细胞种类增多,至第5 d时,1号培养基和2号培养基中的组织仍然保持一定形态及细胞完整度,但3号培养基的组织完全失去活性。离体培养过程中,虽然培养时间短,但有些细胞依然能分裂和生长。这是由于原代培养的细胞中包含的细胞种类较多,大部分细胞因具有不同的生长潜力而出现细胞死亡,只剩下少数细胞(主要是成纤维样细胞)能够存活且具备分裂的能力,之后随着培养时间的延长,细胞活力下降,可能引起了细胞的凋亡。
3.3 细胞活力的变化情况
原代培养试验的细胞活力比值结果显示,酶解后的细胞与机械分离后的细胞相比具有更高活力,卵巢及精巢的细胞活力比值相差较大。在电子耦合试剂1-Methoxy PMS存在的情况下,CCK试剂中的水溶性四唑盐可以被活细胞线粒体内的脱氢酶还原成橙黄色甲臜,而死细胞则无此功能,甲臜量与活细胞数量呈正比,因此细胞活力的上升或下降可能由细胞增殖或死亡等引起。离体培养过程中虽然培养时间短,但随着细胞培养的进行,细胞不仅发生着分裂增殖,也发生着凋亡死亡,两种过程同时发生,因此细胞的活力比值会出现波动,但当细胞生长稳定后,细胞活力比值就会趋于动态平衡。而原代培养细胞一般会包含多种细胞,大部分细胞会因为生长潜力不同而出现细胞死亡,只剩下少数细胞(主要是成纤维样细胞)能够存活且具备分裂的能力[25]。随着培养时间的延长,细胞无法形成完整的能量供给,可能引起细胞的死亡,导致活力下降。对虾卵巢Ⅱ期细胞种类较多,细胞发育时期不统一,中央卵管内的卵圆细胞增殖减弱,卵黄发生前期卵母细胞处于发育中,并逐渐充满卵室,而精巢已处于成熟期,细胞形态及种类较为稳定,本试验的结果也显示,在培养前期细胞种类杂乱,细胞活力比值低,而后期,由于细胞种类减少,细胞生长环境稳定,细胞开始正常生长增殖,细胞活力比值稳定或升高。
3.4 MAPK信号通路的变化情况
机体发育和细胞生长与MAPK信号通路密切相关,其中的ERK信号通路被证明参与生物体的多种生理病理过程,如参与性腺的生长发育、细胞再生及细胞分化[26-27]。促有丝分裂刺激因子(如生长因子、细胞因子)激活了位于细胞膜上的酪氨酸激酶受体、G蛋白偶联受体等相关受体后,通过小GTP蛋白家族Ras蛋白或相关蛋白的介导激活Raf激酶家族成员,并依次磷酸化MEK1/2和ERK1和ERK2。c-Mos参与了磷酸化MEK1/2的过程。
通过检测MAPK信号通路关键因子,结果发现卵母细胞的MAPK信号通路被激活,由于ERK-MEK1存在相互作用,其变化趋势差别不显著,而MAPK信号通路上游基因c-Mos激活效果显著,随着培养时间增加,c-Mos上调水平显著。同时在1号、2号培养基中c-Mos的上调水平高于3号培养基处理下的水平。提示c-Mos是与细胞生长呈正相关的基因,可以考虑作为指示细胞培养情况的基因。Mos蛋白是存在于生殖细胞中的丝氨酸、苏氨酸蛋白激酶,在卵母细胞生长发育过程中积累,因此该蛋白在卵母细胞第二次减数分裂中扮演着重要角色,尤其在遇到促性腺发育因子刺激后会被大量合成,激活卵母细胞,使其进入MⅡ期,之后又开始发生降解消化。本试验中,c-Mos基因在细胞培养过程中的7~17 h,表达量降低至起始的18%~43%,这也印证了MⅠ期到MⅡ期的转化[28]。在猪卵母细胞中的c-Mos基因表达量在卵母细胞被激活后也会迅速降低,卵母细胞的成熟也受到了刺激[29]。培养72 h时,培养的性腺细胞可能正在经历MⅠ期到MⅡ期的转化,卵母细胞被激活过程。而c-Mos原癌基因在小鼠附睾的区域特异性表达及定位也提示,c-Mos基因可能在精子成熟过程中发挥调节功能[30]。因此,本试验检测的不同培养基中的多种MAPK信号通路重要因子的时空分布结果证实了MAPK信号通路与细胞的增殖死亡过程相关。
总之,本试验以L-15培养基为基础,通过3种不同培养基配方考察了酶解法和机械分离法对斑节对虾的性腺细胞的离体培养效果。通过观察细胞及苏木精—伊红染色的组织切片,测定3种培养基下的细胞活力值,发现酶解法同样适用于斑节对虾性腺细胞离体培养,1、2号培养基在一定培养条件下优于3号培养基。
